多孔丝素颗粒的可控制备及药物负载研究
2018-01-25,,,,,
,,,,,
(浙江理工大学材料与纺织学院,杭州 310018)
0 引 言
近年来癌症的发病率和死亡率越来越高,抗癌药物能有效杀死癌细胞,但药物在血液环境中易被降解而无法在人体内稳定存在,为维持药物在体内的有效血药浓度,研究者们设计了将药物包覆在载体之上的载药体系[1-2]。当载体包覆药物后,药物能稳定存在于血液环境中,从而达到增强药物稳定性的效果。此外,载体还能在一定刺激条件下,对药物进行可控释放,因此研究一种抗癌药物的高效载体非常重要。
药物载体材料的类型主要有无机材料[3-4]和有机高分子材料[5-6],但无机材料在体内释放药物后难降解,丝蛋白质作为一种天然高分子材料,生物相容性良好,能被蛋白酶水解[7],可作为药物载体材料来解决在体内降解困难的问题。同时,丝蛋白制备的纤维和膜具有一定的机械强度,应用在手术缝纫线、人造血管及医用敷料[8-11]等研究方面。Kundu等[12]采用去溶剂化的方法制备丝素纳米颗粒,结果显示丝素纳米球呈β-折叠结构,且无明显细胞毒性。Wenk等[13]人以水杨酸为药物模型,制得丝素蛋白载药微囊,发现由浓度高的丝素蛋白溶液制备的载药微囊,对药物的释放速率更稳定。
本实验以丝蛋白为载体材料,阿霉素为抗肿瘤药物模型,制备粒径可控的微纳米颗粒。在颗粒形成过程中,丝素颗粒将药物阿霉素包覆在其中,从而实现对药物阿霉素的负载;并在不同pH的磷酸盐缓冲溶液(PBS)中,测定阿霉素的释放速率和累积释放量,对载药微球响应释放阿霉素的性能进行表征。
1 材料与方法
1.1 实验试剂
蚕茧购自湖州新天丝生物技术有限公司,溴化锂、碳酸钠购自阿拉丁试剂(上海)有限公司,无水磷酸氢二钠和无水磷酸二氢钠购自天津市科密欧化学试剂有限公司,阿霉素购自上海士锋生物科技有限公司。
1.2 丝素溶液的制备
将蚕茧加入0.02 mol/L的碳酸钠溶液中煮沸30 min,重复两次,用超纯水洗涤3次,于60 ℃烘箱中干燥过夜。称取15 mg脱胶后的丝素纤维,溶解在100 mL浓度为9.30 mol/L的溴化锂溶液中,60 ℃反应2 h。将溶解得到的丝素溶液置于透析袋中,去离子水透析3 d,每12 h更换去离子水,对所得溶液进行离心即得到丝素溶液,置于4 ℃冰箱保存备用。
1.3 丝素微纳米颗粒的制备及药物负载
用Na2HPO4和NaH2PO4配制pH值为8、浓度为1.25 mol/L的磷酸盐溶液,将浓度分别为0.50、1.00、1.50、2.00 mg/mL的丝素溶液缓慢滴加到磷酸盐溶液中,低温处理4 h后再在20 ℃熟化温度下处理12 h,离心去离子水洗涤三次,得多孔的丝素微纳米颗粒(silk fibroin nanoparticle,SFNPs)。选择最优的丝素溶液浓度作为下一步研究的工艺条件。
用Na2HPO4和NaH2PO4配制pH值为8浓度分别为1.00、1.25、1.50、2.00 mol/L磷酸盐溶液,将浓度为最优的丝素溶液缓慢滴加到其中,低温处理4 h后再在熟化温度下处理12 h,离心洗涤三次,得到SFNPs。选择最优的磷酸盐溶液浓度作为下一步研究的工艺条件。
用Na2HPO4和NaH2PO4配制pH值为8浓度为最优浓度的磷酸盐溶液,将浓度为最优的丝素溶液缓慢滴加到其中,低温处理4 h后再在不同熟化温度(10、20、30、40 ℃)下处理12 h,离心洗涤三次,得到SFNPs。选择最优的熟化温度作为下一步研究的工艺条件。
选取上述实验最优工艺条件,将阿霉素加入到丝素溶液中,混合均匀后,将丝素溶液加入到磷酸盐溶液中,低温处理4 h后熟化温度下处理12 h,离心洗涤,得到载药丝素颗粒。
1.4 载药颗粒对药物的体外缓释
将制备的载药颗粒分散于pH为5.0、6.5、7.4的PBS中,放入37 ℃恒温振荡箱中,振荡频率150 r/min,分别隔1.0、2.5、4.5、7.0、10.5、14.0、19.0、25.0、32.0 h检测阿霉素释放量。
1.5 表征分析
采用场发射扫描电镜(FE-SEM,日本Hitachi公司 S-4800型)观察多孔丝素颗粒的表面形貌。
采用马尔文激光粒度仪(Zetasizer,英国马尔文仪器有限公司NanoZS90型)测定丝素颗粒的粒径、粒径分布及颗粒表面电位。
采用傅里叶红外变换衰减全反射红外吸收光谱仪(FTIR,美国Thermo Electron)对丝素蛋白在形成颗粒前后进行结构分析。
采用紫外分光光度计测定阿霉素的在480 nm处的吸光度,建立标准曲线,对丝素颗粒包覆药物的载药量和包封率[14]进行定量计算。计算公式如下:


2 结果与讨论
2.1 丝素浓度对SFNPs形貌及粒径的影响
丝素溶液浓度会影响晶体生长,为了解丝素溶液浓度对SFNPs形貌及粒径分布的影响,在SFNPs制备过程中保持熟化温度为20 ℃,磷酸盐溶液浓度为1.25 mol/L不变,仅改变丝素溶液浓度,分别为0.5、1.0、1.5、2.0 mg/mL。采用扫描电镜和激光粒度仪对SFNPs的形貌和粒径分布进行表征,结果如图1所示。图1(a)中丝素浓度为0.5 mg/mL时,丝素颗粒表面为多孔结构,图1(e)中丝素颗粒的粒径最小,主要分布在500~600 nm左右,颗粒为表面呈多孔结构的球形。图1(d)在丝素浓度增加到2.0 mg/mL时,丝素颗粒表面多孔结构没有变化,图1(h)粒径增大到1500 nm左右。从图1的扫描电镜照片看出随着丝素溶液浓度增加,SFNPs的多孔结构几乎没有发生变化,颗粒粒径呈现增大的趋势,激光粒度仪结果如图1(e)-(h),随着丝素溶液浓度增加,丝素颗粒粒径增加,也证实扫描电镜观察到的结果。其原因可能是在制备丝素颗粒的过程中,丝素溶液浓度越高,越易于析出,析出的丝素小颗粒作为晶种使溶液中的丝素蛋白能够在其上生长,形成大的丝素颗粒[15]。图1中丝素溶液浓度0.5 mg/mL和1.0 mg/mL相比,后者颗粒粒径稍有增加,粒径分布变化不大,考虑到产量的问题,这里选择浓度为1.0 mg/mL。
2.2 熟化温度对SFNPs形貌及粒径的影响
温度会影响晶体生长,为探究熟化温度对丝素形貌及粒径分布的影响,在丝素溶液浓度为1 mg/mL,磷酸盐浓度为1.25 mol/L的工艺条件下,分别在不同熟化温度下制备SFNPs,采用扫描电子显微镜及激光粒度仪对SFNPs进行表征。图2(a)中熟化温度为10 ℃时,丝素颗粒主要呈球形,少部分为短棒状,表面呈多孔结构,图2(e)粒径主要分布在2000~2300 nm左右。图2(d)当熟化温度升高到40 ℃时,跟图2(a)相比,更多颗粒呈球形,表面多孔结构没有变化,且粒径减小,减少到1500~1700 nm。从图2的扫描电镜图中看出,丝素颗粒形貌变化不大,随着熟化温度的增加,丝素颗粒粒径呈现减小的趋势。激光粒度仪结果表明熟化温度越高,丝素颗粒粒径越小,而且粒径分布范围更窄。这是由于晶核在低温条件下生长速度快,高温会破坏已形成的有序晶核,特别是在均相成核中,因而随着熟化温度升高,丝素颗粒粒径减小[16]。考虑到粒径小有利于细胞吞噬,因此选熟化温度为40 ℃。

图1 不同丝素溶液浓度的SFNPs扫描电镜照片和的粒径分布
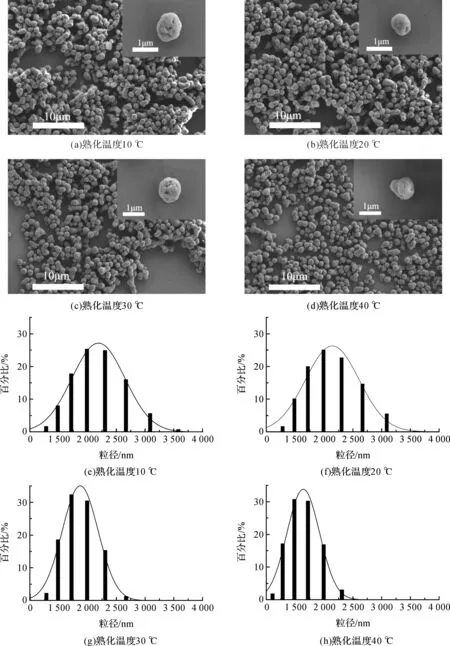
图2 不同熟化温度的丝素颗粒扫描电镜照片及其粒径分布
2.3 离子强度对SFNPs形貌及粒径的影响
蛋白质是亲水性大分子,在水溶液中有双电层结构,以保证分子的溶解度平衡并在水溶液中稳定存在。当加入无机盐类时,盐会电离成为离子态,盐离子的电性破坏溶液中蛋白质的双电层结构,从而导致蛋白质沉淀析出[17]。不同离子强度对蛋白质双电层的影响程度不同,为探究不同离子强度对丝素颗粒及粒径分布,在丝素溶液浓度为1 mg/mL,熟化温度为40 ℃工艺条件下,采用扫描电镜和激光粒度仪对丝素颗粒形貌及粒径分布进行表征。图3(a)离子强度为1.00 mol/L时,颗粒表面呈多孔结构,图3(e)粒径主要分布在950 nm左右。当离子强度增加到2.00 mol/L时,如图3(d)所示,颗粒表面多孔结构减少,图3(h)粒径主要集中在500 nm左右,且粒径分布范围更窄。图3扫描电镜结果显示,随着离子强度增加,丝素表面形貌更加趋向平滑,粒径分布呈减小的趋势,激光粒度仪结果如图3(e)-(h),随着离子强度增加,丝素颗粒粒径减小,也证实扫描电镜中粒径减小的现象。
为证实离子强度影响丝素蛋白的双电层结构,测定不同离子强度制得的丝素颗粒的表面电位。图4结果表明,当离子强度为1.00 mol/L时,颗粒表面电位为-35 mV,当离子强度增加到2.00 mol/L时,颗粒表面电位增加-47 mV左右,这表明随着离子强度的增加,丝素颗粒的表面电位也增加,这一结果跟前面图3分析得到的随着离子强度增加,颗粒粒径减小的结果一致,即离子强度越高,对蛋白质双电层影响程度越大,高的表面电位有利于颗粒在溶液体系中稳定存在,在制备药物载体时选用离子强度为2.00 mol/L的盐浴溶液。
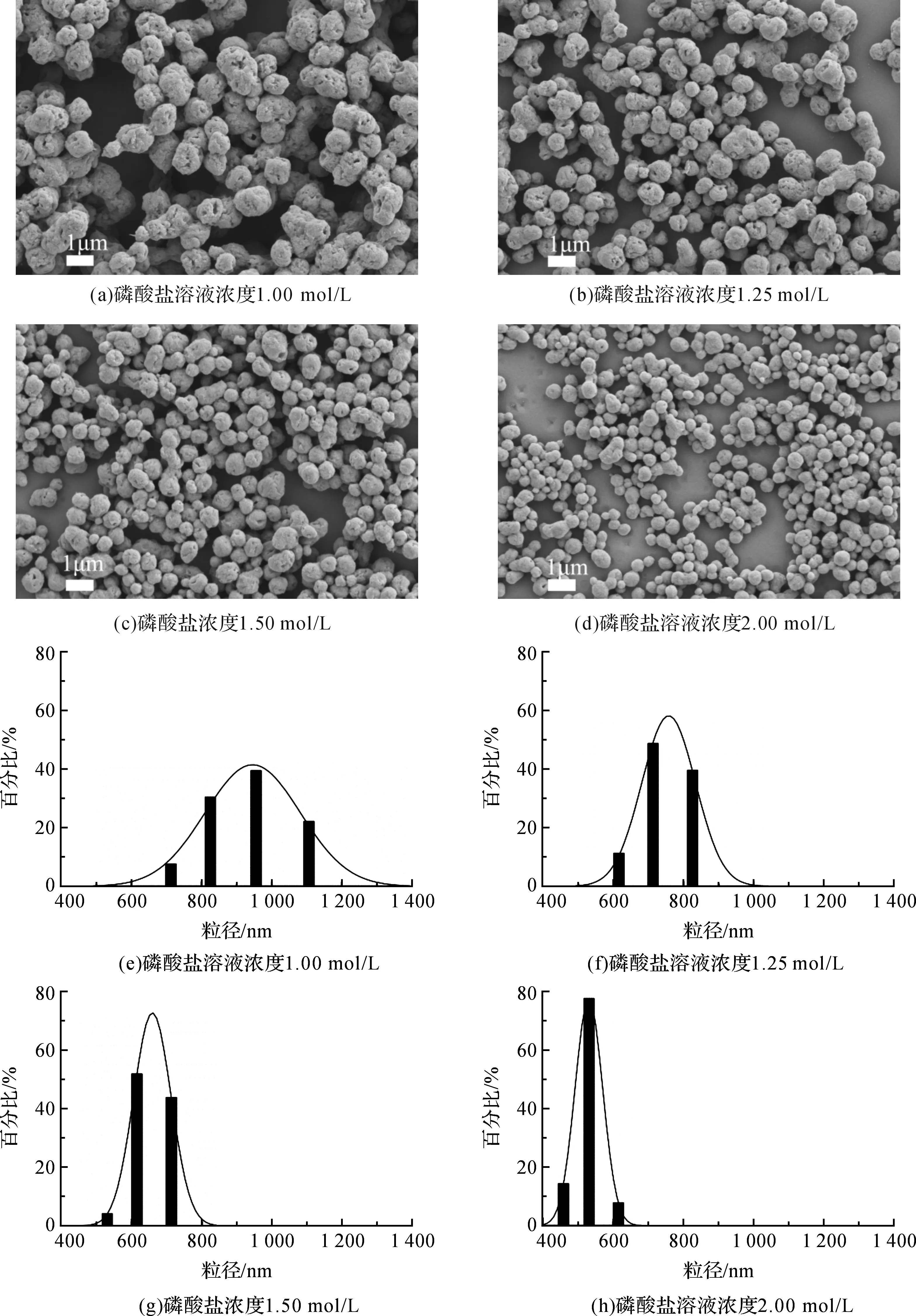
图3 不同离子强度的丝素颗粒扫描电镜照片及粒径分布

图4 不同离子强度制得的丝素颗粒的Zeta电位
2.4 SF盐析前后构象的变化
将新制的丝素蛋白溶液通过冷冻干燥,得再生丝素蛋白(regenerated silk fibroin,RSF),RSF、SFNPs的红外光谱图如图5所示。再生丝素蛋白在形成微纳米颗粒后,RSF的酰胺Ⅰ峰(C=O伸缩振动)的位置从原来的1633.22 cm-1移到了1655.14 cm-1[18],表明丝素盐析后的构象趋向于形成无规线团,说明高浓度的盐溶液不利于了丝素纤维的有序排列。SFNPs在1540.86 cm-1处的酰胺Ⅱ(N-H弯曲振动)和1239.43 cm-1处的酰胺Ⅲ(C-N伸缩振动)峰值明显增加,也说明丝素蛋白颗粒大部分为无规线团结构和少量α-螺旋结构。

图5 丝素蛋白盐析前后红外谱图
2.5 SFNPs的药物负载
将未载药的纯丝素颗粒、载药的丝素颗粒及药物阿霉素(DOX),跟溴化钾粉末研磨后进行压片,得到SFNPs、DOX、SFNPs-DOX的红外光谱图,结果如图6所示。
由图6结果可知,载药后的丝素颗粒分别在2850.32、1281.90、989.03 cm-1呈现出阿霉素的特征振动峰,表明阿霉素已经成功被丝素颗粒包覆在颗粒中。由于SFNPs呈很高的负电性,Zeta电位为-47 mV,阿霉素呈弱正电性,阿霉素通过静电吸附的方式负载于丝素颗粒上,从而使SFNPs实现对药物阿霉素的负载。

图6 载药丝素颗粒的红外光谱图
为实现载体对药物阿霉素的负载量和包封率的定量计算,通过紫外分光光度计对溶液中未包覆的阿霉素进行测定,结合标准曲线如图7所示,阿霉素的浓度与吸光度呈线性相关,方程式为Y=0.024X-0.001,曲线拟合度R2为0.99983,计算得载药量为14.08 μg/mg,包封率为93.86%。表明SFNPs将绝大部分阿霉素负载在其上,实现对抗癌药物阿霉素的高效负载。

图7 阿霉素的标准曲线
2.6 药物的pH响应释放
由于癌细胞内部环境的pH值呈弱酸性,pH为5.0的PBS模拟癌细胞中内涵体和溶酶体的微环境,pH值为6.5的PBS模拟肿瘤细胞外环境,pH值为7.4的PBS模拟体内血浆环境[19]。阿霉素是通过静电吸附的方式负载于丝素颗粒中,不同pH条件会影响其静电相互作用[20],根据环境pH值的不同实现药物的响应释放。
图8为载药丝素颗粒在不同pH值的PBS中的累积释放药物阿霉素的量随时间的关系曲线。图8结果表明,当PBS的pH为7.4时,药物释放速率最慢,在释放7 h后达平衡状态,累积释放量为25.85%。当PBS的pH为6.5时,在释放14 h后达到平衡,累积释放量为41.21%。PBS的pH为5.0时药物的释放速率在最快,释放14 h后达平衡期,药物的总释放量为68.21%。图8说明酸性条件有利于药物释放。药物在酸性条件下释放量的增加,主要是由于酸性环境削弱了阿霉素和丝素蛋白之间的静电作用,导致药物从纳米颗粒中释放出来。以上结果表明丝素制得的纳米颗粒可作为药物载体,并在弱酸性环境的肿瘤细胞内部及周围实现pH响应释放。

图8 载药丝素颗粒的体外释放曲线
3 结 论
通过研究丝素溶液的浓度、熟化温度、磷酸盐溶液浓度,得到粒径可控的多孔丝素颗粒。丝素溶液浓度越低,磷酸盐溶液浓度越高,熟化温度越高,制得的丝素颗粒粒径越小。纳米级多孔丝素颗粒对抗癌药物阿霉素的负载性能良好,药物释放速率和累积释放量随pH降低而增加,根据癌细胞内部环境的pH比正常细胞低,可实现药物的控制释放,具有可观的医用前景,有望应用于癌症治疗。
[1] Peer D, Karp J M, Hong S, et al. Nanocarriers as an emerging platform for cancer therapy[J]. Nature Nanotechnol,2007,2(12):751-760.
[2] Barratt G. Colloidal drug carriers: achievements and perspectives[J]. Cellular and Molecular Life Science,2003,60(1):21-37.
[3] Son S J, Bai X, Lee S B. Inorganic hollow nanoparticles and nanotubes in nanomedicine: Part 1. Drug/gene delivery applications[J]. Drug Discovery Today,2017,12(15/16):650-656.
[4] Xu Z P, Zeng Q H, Lu G Q, et al. Inorganic nanoparticles as carriers for efficient cellular delivery[J]. Chemical Engineering Science,2006,61(3):1027-1040.
[5] Jiang T, Li Y M, Lv Y, et al. Amphiphilic polycarbonate conjugates of doxorubicin with pH-sensitive hydrazine linker for controlled release[J]. Colloids and Surfaces B: Biointerfaces,2013,111(1):542-548.
[6] Sokolsky-papkov M, Agashi K, Olaye A, et al. Polymer carriers for drug delivery in tissue engineering[J]. Advanced Drug Delivery Reviews,2007,59(4/5):187-206.
[7] Horan R L, Antle K, Collette A L, et al. In vitro degradation of silk fibroin[J]. Biomaterials,2005,26(17):3385-3393.
[8] Chen X J, Hou D D, Wang L, et al. Antibacterial surgical silk sutures using a high-performance slow-release carrier coating system[J]. ACS Applied Materials & Interfaces,2015,7(40):22394-22403.
[9] Lovett M, Cannizzaro C, Daheron L, et al. Silk fibroin microtubes for blood vessel engineering[J]. Biomaterials,2007,28(35):5271-5279.
[10] Tao H, Kaplan D L, Omenetto F G. Silk materials-A road to sustainable high technology[J]. Advanced Materials,2012,24(21):2824-2837.
[11] Gu Z P, Xie H X, Huang C C, et al. Preparation of chitosan/silk fibroin blending membrane fixed with alginate dialdehyde for wound dressing[J]. International Journal of Biological Macromolecules,2013,58(1):121-126.
[12] Kundu J, Chung Y, Kim Y H, et al. Silk fibroin nanoparticles for cellular uptake and control release[J]. International Journal of Pharmaceutics,2010,388(1/2):242-250.
[13] Wenk E, Wandrey A J, Merkle H P, et al. Silk fibroin spheres as a platform for controlled drug delivery[J]. Journal of Controlled Release,2008,132(1):26-34.
[14] Wang S H, Xu T, Yang Y H, et al. Colloidal stability of silk fibroin nanoparticles coated with cationic polymer for effective drug delivery[J]. ACS Applied Materials & Interfaces,2015,7(38):21254-21262.
[15] Shi P J, Goh J. Self-assembled silk fibroin particles: Tunable size and appearance [J]. Powder Technology,2012,215/216(1):85-90.
[16] Zhao Z, Li Y, Xie M B. Silk Fibroin-based nanoparticles for drug delivery[J]. International Journal of Molecular Sciences,2015,16(3):4880-4903.
[17] Grover P K, Ryall R L. Critical appraisal of salting-out and its implications for chemical and biological sciences[J]. Chemical Reviews,2005,105(1):1-10.
[18] Chen X, Shao Z Z, Marinkovic N S, et al. Conformation transition kinetics of regenerated Bombyx mori silk fibroin membrane monitored by time-resolved FTIR spectroscopy[J]. Biophysical Chemistry,2001,89(1):25-34.
[19] Hu D D, Xu Z P, Hu Z Y, et al. pH-Triggered charge-reversal silk sericin-based nanoparticles for enhanced cellular uptake and doxorubicin delivery[J]. ACS Sustainable Chemistry & Engineering,2017,5(2):1638-1647.
[20] Seib F P, Kaplan D L. Doxorubicin-loaded silk films: Drug-silk interactions and in vivo performance in human orthotopic breast cancer[J]. Biomaterials,2012,33(33):8442-8450.
