中国黄淮麦区菲利普孢囊线虫淮阳和博爱致病型群体特异性SCAR标记的建立
2016-05-27代君丽李洪连
徐 姣,刘 佳,代君丽,李洪连
(河南农业大学植物保护学院/河南省粮食作物协同创新中心,河南郑州 450002)
中国黄淮麦区菲利普孢囊线虫淮阳和博爱致病型群体特异性SCAR标记的建立
徐 姣,刘 佳,代君丽,李洪连
(河南农业大学植物保护学院/河南省粮食作物协同创新中心,河南郑州 450002)
摘要:菲利普孢囊线虫(Heterodera filipjevi)是在我国黄淮麦区新发现的小麦病原线虫,其致病力更强,危害更严重,对小麦产量和质量造成潜在威胁。病原致病型鉴定对抗病品种的筛选和培育十分重要。为了建立一套简便、快速、准确的SCAR标记检测体系,以黄淮麦区5个重要禾谷孢囊线虫致病型共9个群体为材料,首先对其进行RAPD分析,然后在RAPD分析的基础上对其进行SCAR分析。结果表明,通过筛选97条随机引物,获得2个菲利普孢囊线虫淮阳和博爱致病型群体特异的RAPD标记,其中,引物S232扩增出的多态性条带大小为550 bp,引物S278扩增出的多态性条带大小为1 700 bp。其后将引物S232扩增的条带进行回收、克隆及测序,根据测序结果设计的特异性引物F232-8-1/R232-8-1仅在菲利普孢囊线虫淮阳和博爱致病型群体中扩增出大小为517 bp的特异性条带,而在小麦孢囊线虫其他致病型群体中没有扩增出该条带,说明菲利普孢囊线虫淮阳和博爱致病型群体SCAR标记成功建立,并将其命名为SC-S232。
关键词:小麦;菲利普孢囊线虫;致病型;分子检测
禾谷类作物孢囊线虫病是世界性的植物寄生线虫病害,起初认为只危害温带禾谷类作物,现已蔓延危害生长在不同温度带、各种土质的禾谷类作物[1],成为威胁小麦安全生产的一类重要病害。禾谷孢囊线虫组是个复合种群,由12个正式定名的种和几个未定名的种组成,其中禾谷孢囊线虫(Heteraderaavenae)、菲利普孢囊线虫(H.filipjevi)和麦类孢囊线虫(H.latipons)被认为是危害最严重的三个种,并且有时这三种线虫会同时存在[2-5]。禾谷孢囊线虫病于1874年首次在德国发现,现已遍布50多个国家[6]。我国于1989年在湖北天门初次发现该病[7],目前已在湖北、河南、陕西、甘肃、江苏、宁夏、山东、内蒙、天津、青海、安徽、新疆、西藏、河北、山西和北京16个省(市)发生[8-18]。该线虫病在河南省发生普遍且严重,除了南阳和信阳外,其他16个市小麦均发生该病,严重危害当地小麦生产。2010年,Peng等[19]和Li等[20]在河南省许昌市首次发现菲利普孢囊线虫,随后在该省7个地市发现该线虫种。目前,菲利普孢囊线虫的发生和分布仅在河南地区有公开报道,同时河南省也是燕麦孢囊线虫和菲利普孢囊线虫混合发生的唯一省份。
小麦孢囊线虫病是一种土传病害,在中国发生面积较广,给防治带来很大挑战。郝 瑞等[21]用甘农种衣剂Ⅲ号在小麦种植前对种子进行包衣处理,能有效减少小麦根际周围土壤中禾谷类作物孢囊线虫(Cereal cyst nematode,CCN)的数量,但是目前高效低毒杀线虫制剂的成本较高,在推广应用的过程中会受到一定的限制;Singh等[22]发现通过休耕,在CCN没有寄主的条件下,燕麦孢囊线虫(H.avenae)自发孵化造成幼虫死亡,能使其数量每年降低70%~80%,但在众多国家和地区,因受各种因素的限制,加上土地闲置会引起难以估计的经济损失,所以这种防治方式并不现实;张树武等[23]研究发现,长枝木霉分生孢子悬浮液对CCN的致死作用较强,对CCN具有生防潜力,但是现在多数小麦CCN的生防真菌还没研发成生防制剂,还未在生产上应用。当前,种植抗病品种被认为是防治CCN的有效途径。要合理利用抗病品种,认识病原线虫的种类和致病型就显得尤为重要。根据形态学特征和依靠鉴别寄主进行鉴定,不仅费时费工,而且难以鉴别和区分近似种、生理小种间的差异。
随着分子生物学技术的不断发展,应用分子标记技术鉴别线虫种类和致病型成为一种趋势。RAPD技术是由Williams等[24]和Welsh等[25]于1990年发展起来的分子标记技术,与其他技术相比,该技术具有操作简单、实验周期短、不需要知道目的基因序列、所需样品量少和引物具有普遍性等优点,目前已成功应用于植物寄生线虫属内不同种及种内群体的鉴定[26]。Caswell-Chen等[27]运用RAPD技术成功区分了甜菜孢囊线虫(H.schachtii)和十字花科孢囊线虫(H.cruciferae)。Lopez-Braiia等[28]对采集自多个国家的11个禾谷孢囊线虫群体进行了RAPD分析,成功将这11个群体分为H.avenae和Gotland strain两大种族。郑经武等[29]利用RAPD技术分析了中国农林业生产上重要的四种植物线虫的遗传差异,并获得了燕麦孢囊线虫种的特异性分子标记。刘 佳等[30]采用RAPD技术对黄淮麦区的小麦孢囊线虫进行了分析,并获得了禾谷孢囊线虫荥阳致病型群体的RAPD标记。SCAR技术最初是由RAPD技术发展而来,和RAPD标记相比较,它的引物更长并且能够和模板完全互补,这样扩增结果更加稳定,重复性更强。Meng等[31]成功地将南方根结线虫(Meloidogyneincognita)及爪哇根结线虫(M.javanica)特异的RAPD标记转化成为SCAR标记。Ou等[32]采用RAPD-SCAR标记技术得到了大豆孢囊线虫的特异性SCAR标记。Adam等[33]利用SCAR技术成功区别开了根结线虫属的7个种群。亓晓莉等[34]开发了禾谷孢囊线虫的RAPD标记,并转化为稳定的SCAR标记,所获得的SCAR标记能够对禾谷孢囊线虫进行准确灵敏的检测。
以前的大量研究采用不同的分子生物学技术对植物寄生线虫的不同种进行分子鉴定,但是很少有借助分子手段对种下不同致病型或生理小种进行鉴定的报道。2010年,Peng等[19]和Li等[20]采用形态学结合分子生物学方法,首次报道在中国引起小麦孢囊线虫病的病原线虫除了燕麦孢囊线虫外,还有菲利普孢囊线虫。通过本实验室近年的研究发现,在中国黄淮麦区存在禾谷孢囊线虫和菲利普孢囊线虫多种致病型混合侵染危害小麦的现象[35-39]。传统的致病型鉴定方法周期太长,而且结果易受主客观因素的影响。鉴于此,本研究拟采用RAPD与SCAR标记技术,以黄淮麦区已明确致病型的9个小麦孢囊线虫群体为研究对象进行研究,以期建立一套简便、快速和准确的SCAR标记检测体系,为小麦孢囊线虫病的有效防控奠定基础。
1材料与方法
1.1材 料
本研究共收集了9个地区土样,具体地理位置及各个地理位置所含有的线虫种类信息见表1。这9个小麦孢囊线虫群体可分为5个致病型,其中,禾谷孢囊线虫包括3个致病型:(1)河南荥阳致病型,(2)河北保定和河南商丘致病型,(3)河南安阳、河南清丰和河南杞县致病型;菲利普孢囊线虫包括2个致病型:(1)河南许昌致病型,(2)河南淮阳和河南博爱致病型。7月下旬到8月初,从发病CCN小麦田挖取足量小麦根际周围的土壤,过筛(20目在上,60目在下),将60目上的孢囊和有机质混合物晾掉过多水分后放到75%蔗糖溶液中充分搅拌,用纱布收集漂浮在蔗糖溶液上面的孢囊,放在清水中反复冲洗,将获得的孢囊晾干,在体视镜下用挑针慢慢的挑取孢囊,每个群体选取40个左右孢囊,进行单孢囊的扩繁,备用。
1.2方 法
1.2.1单孢囊DNA的提取
采用蛋白酶K-buffer法[24]提取单孢囊DNA,用紫外分光光度计测DNA的浓度和纯度,并稀释至50 ng·μL-1,置于-20 ℃冰箱中保存备用。
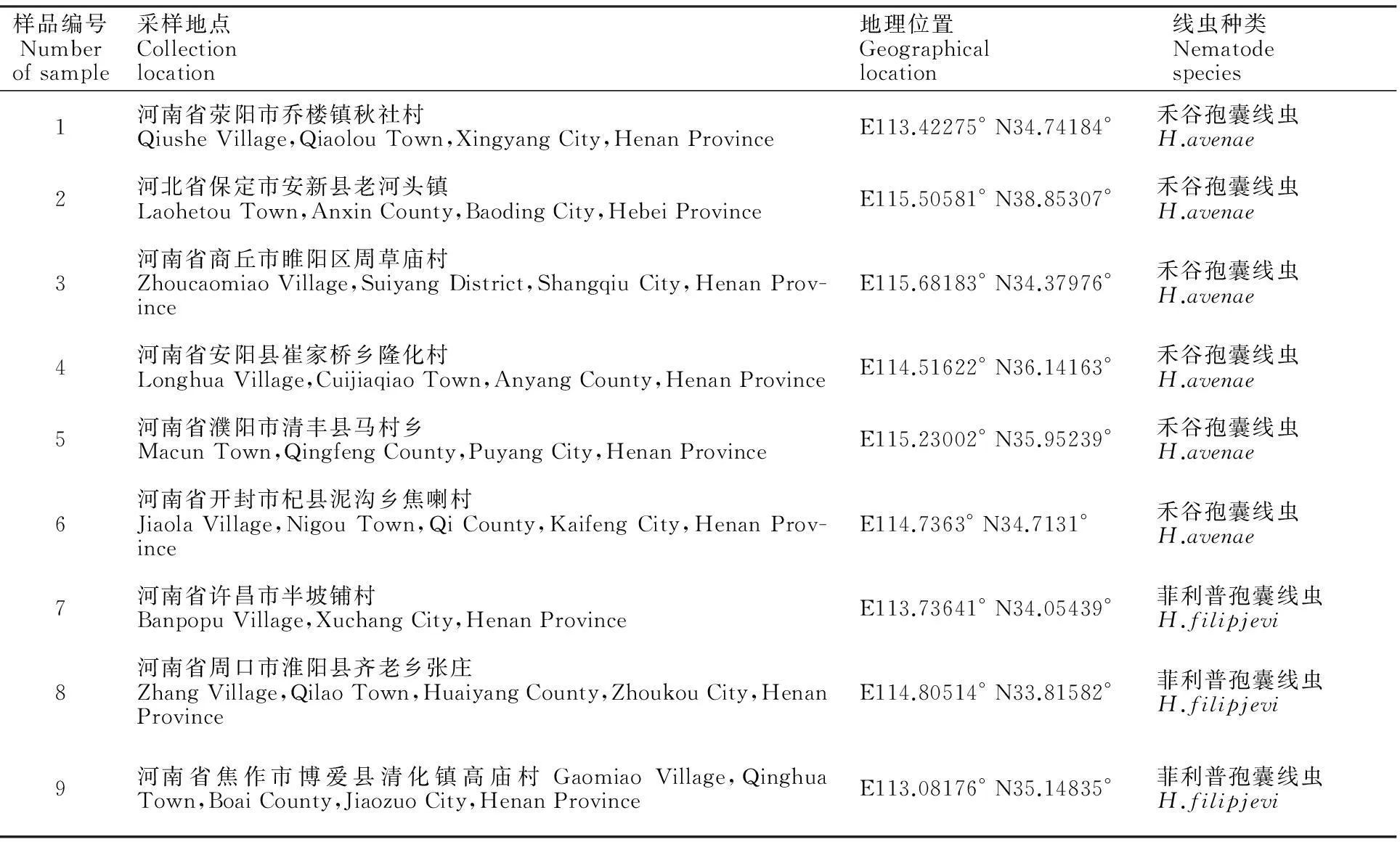
表1 采集样品的地理位置及其所含线虫种类信息表
1.2.2RAPD标记的建立
扩增所用的97条RAPD随机引物均由上海生工生物工程公司合成,2×TaqPCR Master Mix购自莱枫生物工程公司。反应体系(20 μL):2×TaqPCR Master Mix 10 μL,RAPD引物(10 μmol·L-1)1 μL,DNA 1 μL,ddH2O 8 μL。反应程序:94 ℃预变性5 min;94 ℃变性1 min,36 ℃ 退火1 min,72 ℃延伸2 min,40个循环;72 ℃延伸10 min,4 ℃保存。PCR产物用1%琼脂糖凝胶电泳检测,在EB中染色,然后用凝胶成像系统Ingenius LHR despodch记录并分析RAPD谱型。
1.2.3SCAR标记的建立
用快速型琼脂糖DNA回收试剂盒Ⅱ型(BioTeKe公司)对随机引物S232扩增的特异性RAPD条带进行切胶、回收纯化后,将纯化产物与pMD19-T载体(TaKaRa公司)连接,并转入DH5α感受态细胞(北京全式金生物技术有限公司)。经培养后,采用菌落PCR鉴定阳性克隆,并将阳性克隆委托上海生工生物工程公司测序。测序结果经比对分析,设计引物 F232-8-1/R232-8-1(F232-8-1:5′-CCACTCTATAGGATTGCCAT TG-3′; R232-8-1: 5′-CCACTTCCGTAGTTTT CTCA-3′),对孢囊线虫的DNA进行特异性扩增,反应体系(20 μL):2×TaqPCR Master Mix 10 μL,F232-8-1(5 μmol·L-1)1 μL,R232-8-1(5 μmol·L-1)1 μL,DNA 1 μL,ddH2O 7 μL。反应程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸1 min,32个循环;72 ℃延伸10 min,4 ℃保存。取5 μL PCR扩增产物按1.2.2中所述方法电泳、记录。
2结果与分析
2.1RAPD标记的建立
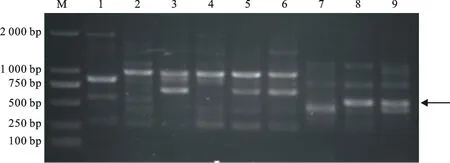
1~9分别代表荥阳、保定、商丘、安阳、清丰、杞县、许昌、淮阳和博爱小麦孢囊线虫群体;M:DL2000(TaKaRa公司);箭头所示为特异性条带。图2和图5中同
1~9 indicate cereal cyst nematode populations from Xingyang,Baoding,Shangqiu,Anyang,Qingfeng,Qixian,Xuchang,Huaiyang and Boai,respectively; M:DL2000(TaKaRa company);Arrow shows specific band.The same as in Fig.2 and Fig.5
图1随机引物S232对5个致病型9个小麦孢囊线虫群体的扩增结果
Fig.1PCR products of 5 pathotypes amplified from 9 cereal cyst nematode populations
with random primer S232 separated on ethidium bromide-stained 1% agarose gel
利用97条RAPD随机引物对黄淮麦区5个致病型共9个小麦孢囊线虫群体进行PCR扩增,每条引物至少重复扩增3次,结果发现,有90条引物在5个不同致病型中具有多态性,可扩增出条带清晰、多态性好的条带。其中,2条引物能对黄淮麦区5个致病型共9个小麦孢囊线虫群体扩增出稳定的多态性条带。引物S232(5′-ACCC CCCACT-3′)和引物S278(5′-TTCAGGGCAC-3′)扩增出了淮阳和博爱致病型群体特异性条带(图1、图2),大小分别为550 bp和1 700 bp。为消除个体的差异,随机挑取淮阳和博爱致病型群体各3个单孢囊纯系进行验证,结果(图3、图4)显示,这2个引物均能扩增出相同的淮阳和博爱致病型群体特异性条带,和前述PCR扩增结果一致,说明这两个RAPD标记确实是淮阳和博爱致病型群体的特异性分子标记。
2.2SCAR标记的建立
将随机引物S232扩增的特异性RAPD条带进行回收,克隆后送菌液到上海生工公司进行测序,测序结果显示,引物S232扩增出的淮阳和博爱群体的特异性条带大小为517 bp,Blast比对,序列覆盖率(Query coverage)在4%~14%之间,在NCBI数据库没有发现任何同源序列。
依据测序结果设计特异性引物F232-8-1/R232-8-1,对线虫DNA进行PCR扩增。结果表明,引物F232-8-1/R232-8-1可以从淮阳和博爱致病型群体中扩增出大小为517 bp的条带(图5),而黄淮麦区其他致病型群体中没有扩增出此特异性条带。说明该引物是菲利普孢囊线虫淮阳和博爱致病型群体的特异性引物,即菲利普孢囊线虫淮阳和博爱致病型群体特异性SCAR标记成功建立,并将其命名为SC-S232。
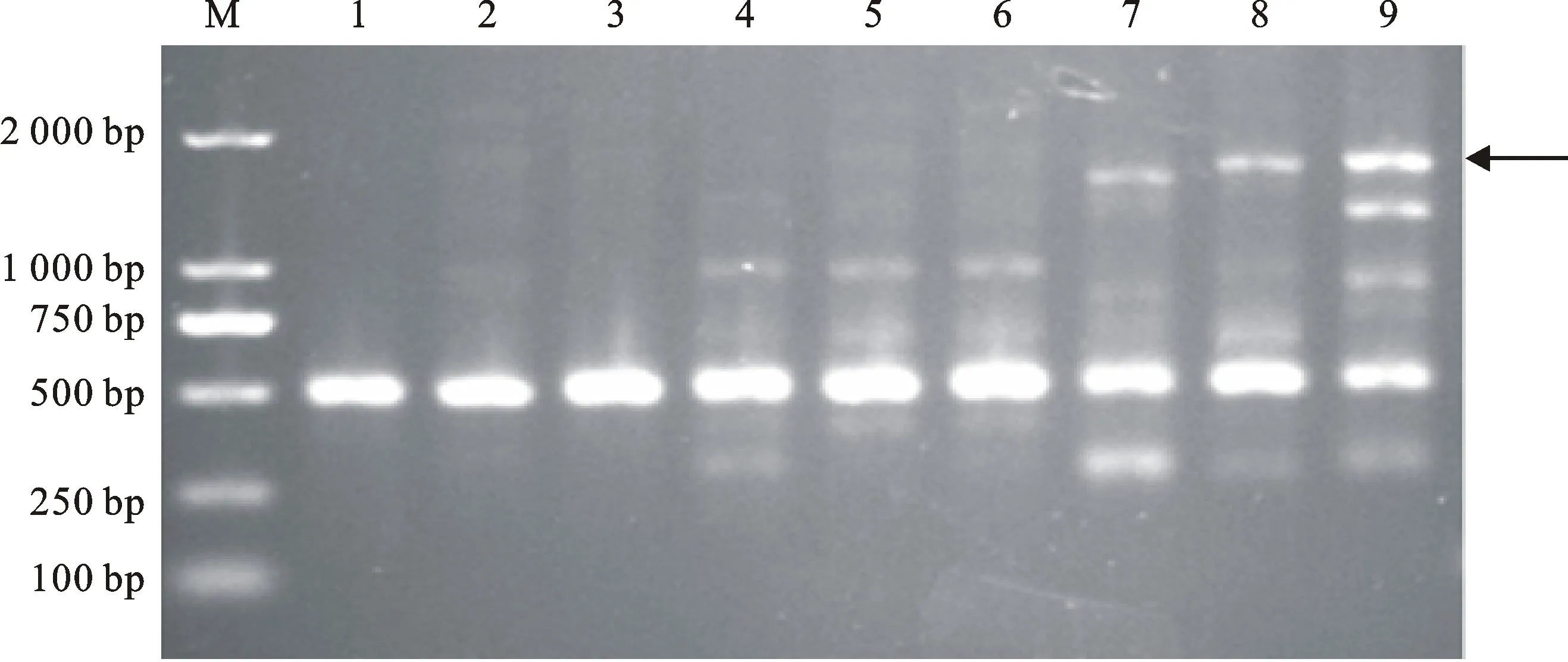
图2 随机引物S278对5个致病型9个小麦孢囊线虫群体的扩增结果
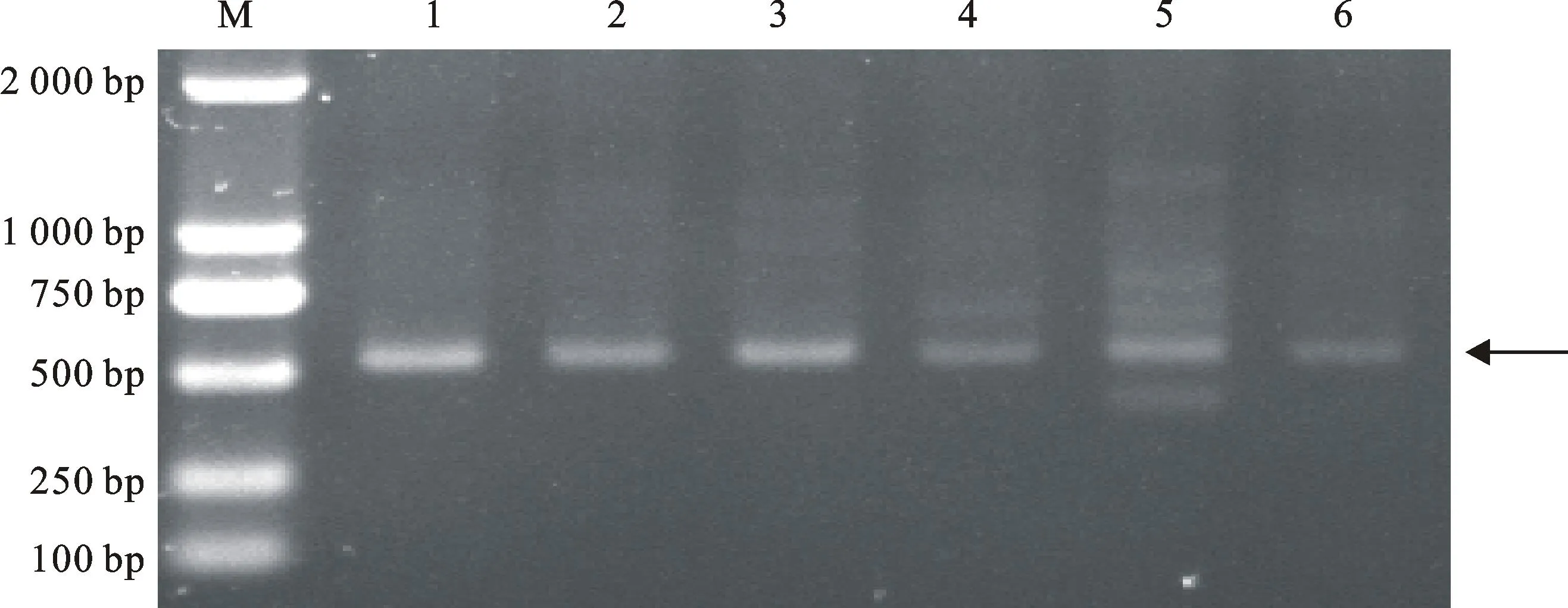
1~3: 淮阳小麦单孢囊线虫;4~6:博爱小麦单孢囊线虫;M:DL2000(TaKaRa公司);箭头所示为特异性条带。图4中同
1~3 indicate 3 cysts from pure lines of Huaiyang population; 4~6 indicate 3 cysts from pure lines of Boai population; M: DL2000(TaKaRa company);Arrow shows specific band.The same as in Fig. 4
图3随机引物S232对随机挑取的淮阳和博爱小麦孢囊线虫群体各3个单孢囊纯系的扩增结果
Fig.3PCR products of single-cyst DNA amplified with random primer S232 from the respective
three samples collected from Huaiyang,and Boai in Henan Province
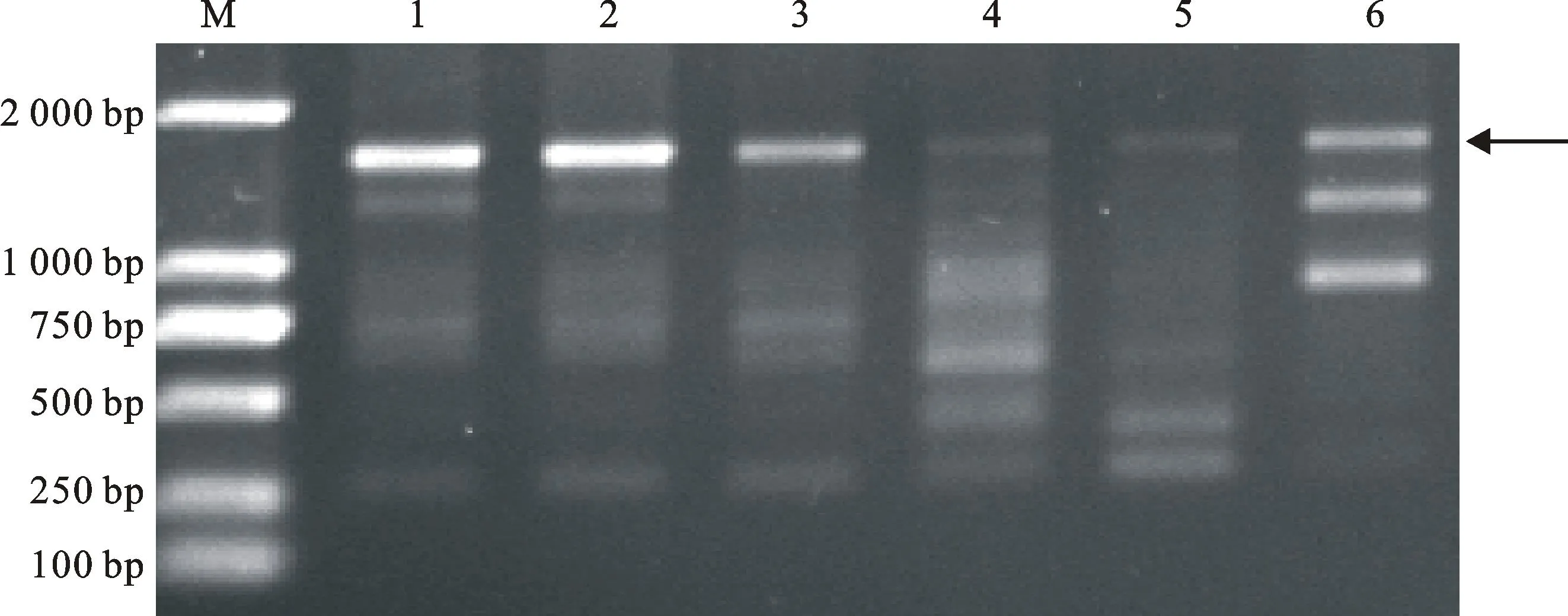
图4 随机引物S278对随机挑取的淮阳和博爱小麦孢囊线虫群体各3个单孢囊纯系的扩增结果
3讨 论
目前在我国小麦禾谷孢囊病引起的小麦危害面积已达333万hm2以上,严重地块损失率可高达70%以上,已经成为我国小麦生产中的一个重要问题[40]。本研究选取的线虫群体基本上覆盖了黄淮麦区重要的小麦孢囊线虫发生地区,建立孢囊DNA的分子检测方法,与传统鉴定方法相比,可大大缩短鉴定时间,而且使鉴定结果更加可靠,简单快捷,灵敏度高,有助于提高检测效率。
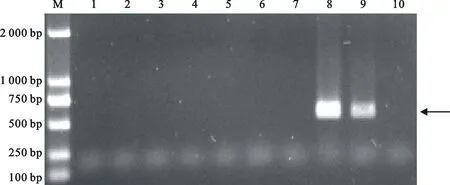
10:阴性对照Negative control
图5引物F232-8-1/R232-8-1对5个致病型9个小麦孢囊线虫群体的扩增结果
Fig.5PCR products of 5 pathotype amplified from 9 cereal cyst nematode
populations with specific marker F232-8-1/R232-8-1
RAPD技术具有丰富的多态性和易操作性,因此它适合于检测种及其以下水平的多样性,但是,RAPD技术稳定性和重复性差,需要进行大量的预实验进行RAPD反应体系和反应程序的优化,为了便于在实际运用中推广,本研究将RAPD标记转化为更稳定的SCAR标记。本研究中获得了2个菲利普孢囊线虫淮阳和博爱致病型群体相关的RAPD标记,但只有S232扩增出的RAPD标记成功转化为SCAR标记,而S278扩增出的RAPD标记没有转化成SCAR标记,分析SCAR标记转化失败的原因可能跑电泳样品间污染造成。实验中利用DNAMAN软件对S278特异性条带序列设计了5对SCAR标记引物,但依然没有特异性,推测特异性条带表现的不是其在致病型间的差异。
菲利普孢囊线虫种的分子鉴定,已有很多研究报道,多是采用不同的限制性内切酶酶切线虫的rDNA-ITS序列,来区分不同的线虫种类[41-46]。Peng等[47]开发了菲利普孢囊线虫种特异性的SCAR标记,并对所找到的SCAR标记的检测灵敏度进行了相关研究,发现所找到的SCAR标记对2龄幼虫裂解物的检测灵敏度可以达到0.125 μL,对雌成虫裂解物的检测灵敏度可达到3.9×10-3μL。Toumi等[48]根据菲利普孢囊线虫的COI基因设计引物从Heterodera属的混合群体中特异性的检测出菲利普孢囊线虫,检测灵敏度达到5条线虫。但是已有的研究报道多是针对植物寄生线虫不同种的分子检测和鉴定,很少有将研究目标对准种下生理小种或致病型的分子检测和鉴定。本实验室将通过扩大引物的筛选范围,来获得更多的致病型相关的分子标记,并通过收集更多的菲利普孢囊线虫和禾谷孢囊线虫致病型群体来检测所获得标记的特异性和有效性;另一方面还需要拓宽思路为致病型的分子检测探索出更简便快捷的技术和方法,将小麦孢囊线虫的致病型分子检测体系和传统的致病型鉴定方法相结合,建立一套完整的小麦孢囊线虫致病型检测体系,为抗病品种的选育和合理布局提供科学依据。
参考文献:
[1]Riley I T,Nicol J M,Dababat A A.Cereal cyst nematodes:status,research and outlook [C]//Proceedings of the First Workshop of the International Cereal Cyst Nematode Initiative,Antalya,Turkey,2009:21-23.
[2]Yan G P,Smiley R W.DistinguishingHeteroderafilipjeviandH.avenaeusing polymerase chain reaction restriction fragment length polymorphism and cyst morphology [J].Phytopathology,2009,100:216-224.
[3]Abidou H,El-Ahmed A,Nicol J M,etal.Occurrence and distribution of species of theHeteroderaavenaegroup in Syria and Turkey [J].NematologiaMediterranea,2005,33:195-201.
[4]Toumi F,Hassan G,Waeyenberge L,etal.Distribution of cereal cyst nematodes(Heteroderaspp.) in wheat and barley fields in northeastern regions of Syria [C]//Proceedings of the Third Workshop of the International Cereal Cyst Nematode Initiative,Adana,Turkey,2012:310.
[5]Rivoal R,Nicol J M.Past research on the cereal cyst nematode complex and future needs [C]//Cereal Cyst Nematodes:Status,Research and Outlook,Ankara,Turkey,2009:3-10.
[6]Maafi Z T,Nicol J M,Kazemi H.Cereal cyst nematodes,root rot pathogens and root lesion nematodes affecting cereal production in Iran [C]//Cereal Cyst Nematodes:Status,Research and Outlook,Ankara,Turkey,2009:51-55.
[7]陈品三,王明祖,彭德良.我国小麦禾谷孢囊线虫的发现与鉴定初报 [J].中国农业科学,1991,24(5):89-91.
Chen P S,Wang M Z,Peng D L.Preliminary report of identification on cereal cyst nematode of wheat in China [J].ScientiaAgriculturaSinica,1991,24(5):89-91.
[8]王振跃,王守正,李洪连,等.河南省小麦孢囊线虫病的初步研究 [J].华北农学报,1993,8(s):105-109.
Wang Z Y,Wang S Z,Li H L,etal.A preliminary study on wheat cyst nematode diseasa in Henan province [J].ActaAgriculturaeBoreali-Sinica,1993,8(s):105-109.
[9]赵 杰,钮緖燕,张管曲,等.陕西省中南部地区小麦禾谷孢囊线虫的发生与分布 [J].西北农业学报,2011,20(6):181-185.
Zhao J,Niu X Y,Zhang G Q,etal.Occurrence and distribution of cereal cyst nematode in central-south Shaanxi province [J].ActaAgriculturaeBoreali-occidenalisSinica,2011,20(6):181-185.
[10]叶文兴,徐炳良,彭德良,等.甘肃省小麦禾谷孢囊线虫rDNA-ITS和28S rDNA-D2/D3区序列特征及ITS-RFLP分析 [J].植物保护,2010,36(3):58-65.
Ye W X,Xu B L,Peng D L,etal.Sequence and RFLP analysis of rDNA-ITS and 28S rDNA-D2/D3 regions ofHeteroderaavenaeon wheat from Gansu province in China [J].PlantProtection,2010,36(3):58-65.
[11]王 暄,梁中伟,裴世安,等.江苏省小麦禾谷孢囊线虫群体核糖体rDNA-ITS区序列分析 [J].南京农业大学学报,2010,33(6):55-62.
Wang X,Liang Z W,Pei S A,etal.Sequences analysis of rDNA-ITS region of cereal cyst nematodes on wheat from Jiangsu province [J].JournalofNanjingAgriculturalUniversity,2010,33(6):55-62.
[12]黄文坤,叶文兴,王高峰,等.宁夏地区禾谷孢囊线虫的发生与分布 [J].华中农业大学学报,2011,30(1):74-77.
Huang W K,Ye W X,Wang G F,etal.Occurrence and distribution ofHeteroderaavenaeWollenweber in Ningxia Hui Autonomous Region [J].JournalofHuazhongAgriculturalUniversity,2011,30(1):74-77.
[13]杨远永,赵洪海,彭德良.小麦禾谷孢囊线虫在山东省的分布报道 [J].青岛农业大学学报:自然科学版,2010,27(1):17-20.
Yang Y Y,Zhao H H,Peng D L.New distribution report of cereal cyst nematode on wheat in Shandong province [J].JournalofQingdaoAgriculturalUniversity:NaturalScience,2010,27(1):17-20.
[14]陈 新,周洪友,马 玺.内蒙古中西部地区小麦禾谷孢囊线虫的发生分布 [J].植物保护,2009,35(5):114-117.
Chen X,Zhou H Y,Ma X.Distribution ofHeteroderaavenaein the middle and west regions of Inner Mongolia,China [J].PlantProtection,2009,35(5):114-117.
[15]彭德良,黄文坤,孙建华,等.我国天津发现小麦禾谷孢囊线虫 [M]//中国线虫学研究(第四卷).北京:中国农业科学技术出版社,2012:162-163.
Peng D L,Huang W K,Sun J H,etal.First Report of Cereal Cyst Nematode(Heteroderaavenae)in Tianjin,China [M]//Nematology Research in China(Vol.4).Beijing:China Agriculture Scientech Press,2012:162-163.
[16]候生英,彭德良,王爱玲,等.青海省小麦孢囊线虫病调查初报 [J].青海大学学报:自然科学版,2008,26(5):84-86.
Hou S Y,Pen D L,Wang A L,etal.Preliminary report of investigation on cereal cyst nematode of wheat in Qinghai Province [J].JournalofQinghaiUniversity:NatureScience,2008,26(5):84-86.
[17]杨传广,吴慧平,檀根甲,等.安徽省小麦孢囊线虫田间分布及危害调查 [J].植物保护,2008,34(2):107-110.
Yang C G,Wu H P,Tan G J,etal.Investigations on the distribution of and damages caused by cereal cyst nematode in Anhui [J].PlantProtection,2008,34(2):107-110.
[18]李惠霞,柳永娥,魏 庄,等.新疆和西藏发现禾谷孢囊线虫 [M]//中国线虫学研究(第四卷).北京:中国农业科学技术出版社,2012:164-165.
Li H X,Liu Y E,Wei Z,etal.The Detection ofHeteroderaavenaefrom the Cereal Field in Autonomous Regions of Tibet and Xinjiang [M]//Nematology Research in China(Vol.4).Beijing:China Agriculture Scientech Press,2012:164-165.
[19]Peng D,Ye W,Peng H,etal.First report of the cyst nematode(Heteroderafilipjevi) on wheat in Henan province,China [J].PlantDisease,2010,94(10):1262.
[20]Li H,Yuan H,Sun J,etal.First record of the cereal cyst nematodeHeteroderafilipjeviin China [J].PlantDisease,2010,94(12):1505.
[21]郝 瑞,黄文坤,刘崇俊,等.新型种衣剂防治小麦禾谷孢囊线虫病研究 [J].植物保护,2014,40(1):182-186.
Hao R,Huang W K,Liu C J,etal.Effect of seed-coatings on controlling cereal cyst nematode(Heteroderaavenae) of wheat [J].PlantProtection,2014,40(1):182-186.
[22]Singh A,Sharma A,Shoran J,etal.Heteroderaavenaeand its management on wheat in India [C]//Proceedings of the First Workshop of the International Cereal Cyst Nematode Initiative,Antalya,Turkey,2009:21-23.
[23]张树武,徐秉良,薛应钰,等.长枝木霉对小麦禾谷孢囊线虫的致死作用 [J].应用生态学报,2014,25(7):2093-2098.
Zhang S W,Xu B L,Xie H Y,etal.Lethal effects ofTrichodermalongibrachiatumonHeteroderaavenae[J].ChineseJournalofAppliedEcology,2014,25(7):2093-2098.
[24]Williams J G K,Kubelik A R,Livak K J,etal.DNA polymorphism amplified by arbitrary primers are useful as genetic marker [J].NucleicAcidsResearch,1990,8:6531-6535.
[25]Welsh J,Mcclelland M.Fingerprinting genomes using PCR with arbitrary primers [J].NucleicAcidsResearch,1990,18:7213-7218.
[26]Hashmi G,Glazer I,Gaugler R I.Molecular comparisons of entomopathoganic nematodes using randomly amplified polymorphic DNA(RAPD) makers [J].FundamentalandAppliedNematology,1996,19(4):399-406.
[27]Caswell-Chen E P,Williamson V M,Wu F F,etal.Random amplified polymorphic DNA analysis ofHeteroderacruciferaeandH.schachtiipopulations [J].JournalofNematology,1992,24(3):343-351.
[28]Lopez-Braiia I,Romero M D,Delibes A.Analysis ofHeteroderaavenaepopulations by the random amplified polymorphic DNA technique [J].Genome,1996,39(1):118-122.
[29]郑经武,许建平,陈卫良,等.四种植物线虫的RAPD比较及鉴定研究 [J].农业生物技术学报,1998,6(2):108-116.
Zheng J W,Xu J P,Chen W L,etal.Molecular comparison and identification of four plant nematodes using randomly amplified polymorphic DNA(RAPD) markers [J].JournalofAdriculturalBiotechnology,1998,6(2):108-116.
[30]刘 佳,徐 娇,代君丽,等.中国黄淮麦区燕麦孢囊线虫荥阳群体致病型相关RAPD标记的建立 [J].麦类作物学报,2013,33(6):1294-1299.
Liu J,Xu J,Dai J L,etal.RAPD markers ofHeteroderaavenaeXingyang population from Huang-huai Floodplain in China [J].JournalofTriticeaeCrops,2013,33(6):1294-1299.
[31]Meng Q P,Long H,Xu J H.PCR assays for rapid and sensitive identification of three major root-knot nematodes,Meloidogyneincognita,M.javanicaandM.arenaria[J].ActaPhytopathologicaSinica,2004,34(3):204-210.
[32]Ou S Q,Peng D L,Liu X M,etal.Identification ofHeteroderaglycinesusing PCR with sequence characterised amplified region(SCAR) primers [J].Nematology,2008,10(3):397-403.
[33]Adam M A M,Phillips M S,Blok V C.Molecular diagnostic key for identification of single juveniles of seven common and economically important species of root-knot nematode(Meloidogynespp.) [J].PlantPathology,2007,56:190-197.
[34]亓晓莉,彭德良,彭 焕,等.基于SCAR 标记的小麦禾谷孢囊线虫快速分子检测技术 [J].中国农业科学,2012,45(21):4388-4395.
Qi X L,Peng D L,Peng H,etal.Rapid molecular diagnosis based on SCAR marker system for cereal cyst nematode [J].ScientiaAgriculturaSinica,2012,45(21):4388-4395.
[35]杨卫星.河南省小麦禾谷孢囊线虫致病型及发生规律研究 [D].洛阳:河南农业大学,2008.
Yang W X.Pathotype and occurrence of cereal cyst nematode(Heteroderaavenae) [D].Luoyang:Henan Agricultural University,2008.
[36]孙君伟.黄淮麦区四个禾谷孢囊线虫群体种类和致病型鉴定及主推品种的抗性评价 [D].洛阳:河南农业大学,2010.
Sun J W.Identification of species and pathotypes from four cereal cyst nematode populitions in Huanghuai wheat plant area and evaluation of main wheat cultivars resistance to two populations [D].Luoyang:Henan Agricultural University,2010.
[37]侯兴松.豫西豫北及豫南地区4个禾谷孢囊线虫群体种类和致病型鉴定及品种抗性研究 [D].洛阳:河南农业大学,2011.
Hou X S.Identification on the species and pathotypes of four cereal cyst nematode populationa from western and northern Henan,southern Hebei and evaluation of wheat cultivars resistance to two populations [D].Luoyang:Henan Agricultural University,2011.
[38]年高磊.鲁豫皖交界地区四个CCN群体种类和致病型鉴定及品种对淮阳群体的抗性评价 [D].洛阳:河南农业大学,2011.
Nian G L.Identification of species and pathotypes of four cereal cyst nematode populations from Shandong,Henan and Anhui contiguous areas and resistance evaluation of wheat cultivars to Huaiyang populations [D].Luoyang:Henan Agricultural University,2011.
[39]张 鹏.河南中部地区三个CCN群体种类和致病型鉴定及抗性品种筛选 [D].洛阳:河南农业大学,2012.
Zhang P.Identification on the species and pathotypes of three cereal cyst nematode populations from the middle area of Henan province and screening of resistant cultivars to two populations [D].Luoyang:Henan Agricultural University,2012.
[40]李洪连.小麦禾谷孢囊线虫病 [M]//植物线虫学.北京:科学出版社,2011:155-162.
Li H L.Wheat Cyst Nematode Disease [M]//Plant Nematology.Beijing:Science Press,2011:155-162.
[41]Peng D,Nicol J M,Li H,etal.Current knowledge of cereal cyst nematode(Heteroderaavenae) on wheat in China [C]//Cereal Cyst Nematode:Status,Research and Outlook.Ankara,Turkey,2009:29-34.
[42]Bekal S,Gauthier J P,Rivoal R.Genetic diversity among a complex of cereal cyst nematode inferred from RFLP analysis of the ribosomal internal transcribed spacer region [J].Genome,1997,40:479-486.
[43]Abidou H,Valette S,Gauthier J P,etal.Molecular polymorphism and morphometrics of species of theHeteroderaavenaegroup in Syria and Turkey [J].JournalofNematology,2005,37(2):146-154.
[44]Yan G P,Smiley R W.DistinguishingHeteroderafilipjeviandH.avenaeusing polymerase chain reaction restriction fragment length polymorphism and cyst morphology [J].Phytopathology,2009,100:216-224.
[45]彭德良,叶文兴,顾晓川,等.我国首次发现菲利普孢囊线虫(Heteroderafilipjevi)危害小麦 [M]//中国线虫学研究.北京:中国农业科学技术出版社,2013:162-163.
Peng D L,Ye W X,Gu X C,etal.First Report ofHeteroderafilipjevion Wheat in China [M]//Nematology Research in China.Beijing:China Agriculture Scientech Press,2010:162-163.
[46]Yan G P,Smiley R W,Okubara P A,etal.Species-specific PCR assays for differentiatingHeteroderafilipjeviandH.avenae[J].PlantDisease,2013,97(12):1611-1619.
[47]Peng H,Qi X L,Peng D L,etal.Sensitive and direct detection ofHeteroderafilipjeviin soil and wheat roots by species-specific SCAR-PCR assays [J].PlantDisease,2013,97(10):1288-1294.
[48]Toumi F,Waeyenberge L,Viaene N,etal.Development of two species-specific primer sets to detect the cereal cyst nematodesHeteroderaavenaeandHeteroderafilipjevi[J].EuropeanJournalofPlantPathologyl,2013,136:613-624.
Development of SCAR Marker for DetectingHeteroderafilipjeviof Huaiyang and Boai Pathotype Populations from Wheat-growing Regions of the Huang-Huai-Hai Plain in China
XU Jiao,LIU Jia,DAI Junli,LI Honglian
(College of Plant Protection,Henan Agricultural University/Collaborative Innovation Center of Henan Grain Crops,Zhengzhou,Henan 450002,China)
Abstract:Heterodera filipjevi was discovered in the Huang-Huai-Hai Plain in China and is a new pathogenic nematode of wheat. It seriously threatens wheat production due to the capability of high pathogenicity. Identification of pathogenic pathotype is quite important for screening and breeding of disease-resistant wheat cultivars.In order to establish a kind of rapid,convenient,and accurate method based on SCAR markers,random amplified polymorphism DNA(RAPD) techniques was used to analyze five pathotypes,including nine cereal cyst nematode(CCN) populations. A total of 97 random primers were screened and 2 of them,S232 and S278,produced distinct bands that were specific for Huaiyang and Boai populations of H.filipjevi based on RAPD method. The two specific bands were 550 base pair(bp),and 1 700 bp in size,respectively. Subsequently,a SCAR marker SC-S232 was developed according to the RAPD marker S232. The results showed that SC-S232 marker amplifies a positive band with a size of 517 bp from the Huangyang and Boai pathotype populations of H.filipjevi,but none product from other pathotype populations of CCN in the Huang-Huai-Hai plain. This SCAR marker SC-S232 can be used to detect the Huangyang and Boai pathotype populations in this region.
Key words:Wheat; Heterodera filipjevi; Pathotype; Molecular detection
中图分类号:S512.1;S435
文献标识码:A
文章编号:1009-1041(2016)04-0523-08
通讯作者:代君丽(E-mail: daijl666@sina.com); 李洪连(E-mail: honglianli@sina.com)
基金项目:国家自然科学基金项目(31101419);国家公益性(农业)科研专项(200903040-4)
收稿日期:2015-11-08修回日期:2015-12-24
网络出版时间:2016-04-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160401.1534.038.html
第一作者E-mail:1789985160@qq.com
