榛子产紫杉醇内生真菌Penicillium aurantiogriseum中GGPP合酶基因的克隆与表达
2016-05-27刘洪伟杨艳芳李艳艳邱德有
刘洪伟, 杨艳芳, 李艳艳, 王 帅, 邱德有
( 林木遗传育种国家重点实验室, 中国林业科学研究院林业研究所, 北京 100091 )
榛子产紫杉醇内生真菌Penicillium aurantiogriseum中GGPP合酶基因的克隆与表达
刘洪伟, 杨艳芳, 李艳艳, 王帅, 邱德有*
( 林木遗传育种国家重点实验室, 中国林业科学研究院林业研究所, 北京 100091 )
摘要:牻牛儿基牻牛儿基焦磷酸合酶是产紫杉醇内生真菌紫杉醇合成下游途径中的关键步骤之一,在榛子产紫杉醇内生真菌中进行紫杉醇生物合成研究时首先要确认GGPP合酶的存在。该研究通过RT-PCR方法克隆得到了榛子产紫杉醇内生真菌Penicillium aurantiogriseum中GGPP合酶基因PaGGPPS (GenBank登录号为KM881430)的cDNA 开放阅读框 (Open reading frame, ORF)。利用生物信息学方法,我们分析了该基因的序列,并对其编码的氨基酸序列进行了预测。结果发现该基因ORF长度为1 113 bp,预计蛋白分子量为40.98 kD,等电点为6.168, 表明该蛋白呈酸性。对其进行亲疏水性分析发现肽链整体呈现为亲水性。PaGGPPS的主要二级结构元件为α-螺旋,并且包含一个异戊二烯类化合物合酶功能域。对榛子产紫杉醇内生真菌与其他物种的GGPPS进行氨基酸同源性分析,发现其与娄地青霉、曲霉菌和费氏新萨托菌的一致性较高,分别为94%、76%和76%。进化树分析表明来自动物、真菌和酵母的GGPPS聚为一类,来自植物的GGPPS聚为一类,其中榛子产紫杉醇内生真菌的GGPPS和青霉菌的进化关系最近,与植物的GGPPS的进化关系最远。对其进行基础生物信息学分析后,我们构建了原核表达载体,成功诱导其表达并得到可溶性蛋白。该研究结果为下一步深入研究GGPPS基因在内生真菌Penicillium aurantiogriseum紫杉醇合成途径中的作用及和构建高产紫杉醇基因工程菌株奠定了一定的基础。
关键词:内生真菌, GGPP合酶, 原核表达, 基因克隆, 紫杉醇
紫杉醇是Wall(1971)从短叶红豆杉(Taxusbrevifolia)中分离到的二萜,它对乳腺癌等多重癌症具显著疗效,已被广泛应用在临床上(Craag et al, 1993)。红豆杉生长缓慢,资源有限,紫杉醇含量低(占树皮干重的0.01%~0.02%),所以资源与开发的矛盾相当突出。Strobel et al(1993)从短叶红豆杉分离到产紫杉醇的内生真菌Taxomycesandreanae,并证明它能合成纳克级的紫杉醇。此后,人们陆续从西藏红豆杉、东北红豆杉等红豆杉中分离到产紫杉醇内生真菌(Metz et al, 2000;Kumaran & Hur, 2009;Sreekanth et al, 2009;Liu et al, 2009;Zhang et al, 2009),也有从内生真菌中发现其他抗癌物质(李良群等,2011)。还有从松树Wollemianobilis(Strobel et al, 1997)、榛子Corylusavellana(Hoffman et al, 1998)、落羽杉Taxodiumdistichum(Li et al, 1996)、罗汉松Podocarpusforrestii(孙端方等,2008)、香橼Citrusmedica(Kumaran et al, 2008)等植物中分离到产紫杉醇内生真菌。它们分属青霉属(Penicillium)、镰刀菌属(Fusarium)、拟盘多毛孢属(Pestalotiopsis)、树状多节孢(Noduzisporium)、链格孢菌(Alternaria)、曲霉属(Aspergillus)、黑孢霉属(Periconiasp.)、茎点霉属(Phomopsis)、瘤座菌属(Tuberculariasp.)等。这些产紫杉醇内生真菌的发现为紫杉醇的生产又提供了一条途径。在多种紫杉醇生产途径中,最佳的选择是进行植物细胞和内生真菌大规模培养,但至今植物细胞中紫杉醇产量不高且不稳定(Tabata, 2004;Pan et al, 2000)。与红豆杉培养细胞相比,内生真菌大规模培养的优势更为明显,但内生真菌紫杉醇产量还不高,仍需从优化发酵条件和改造紫杉醇合成通路等方面进一步提高(康冀川等,2013)。
红豆杉细胞紫杉醇生物合成基因已有报道(Walker & Croteau, 2001)。从FPP和IPP开始到紫杉醇是由20个蛋白所催化完成,通路第一步在GGPP合酶催化下完成。GGPP合酶即牻牛儿基牻牛儿基焦磷酸合酶(Geranylgeranyl pyrophosphate synthase, geranylgeranyl diphosphate synthase, GGPPS ),又称香叶基香叶基焦磷酸合酶(化文平等,2014)。它的主要功能为催化3分子异戊烯基焦磷酸 (Isopentenyl diphosphate, IPP ) 和1分子法尼基焦磷酸(Farnesyl diphosphate, FPP )缩合生成20碳的牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl pyrophosphate, GGPP ),可以为赤霉素类、二萜类等物质骨架结构的合成提供起始前体物(Kojima et al,2000)。目前已在多个物种中开展了该基因的克隆和功能分析(化文平等,2014;王歆等,2012)。与红豆杉相比,内生真菌紫杉醇生物合成的研究还很少。在内生真菌中,GGPP合酶作为紫杉醇合成途径下游的第一个酶,有必要最先鉴定阐明。本研究以从榛子中分离到的产紫杉醇内生真菌Penicilliumaurantiogriseum为材料,在对其基因组测序(Yang et al, 2014)得到的数据基础上,展开了该内生真菌GGPPS基因cDNA的克隆、原核表达及纯化的研究,为下一步深入研究该内生真菌GGPPS基因的作用和构建高产紫杉醇基因工程菌株提供了基础。
1材料与方法
1.1 材料
内生真菌PenicilliumaurantiogriseumNRRL 62431是由Angela Hoffman教授从美国俄勒冈州的奥罗拉市的榛子(Corylusavellana)中分离得到并赠送的。克隆载体pUC-19,及大肠杆菌DH5α和BL21(DE3)plysS均是从康为世纪购得。表达载体pET30a是由山东省果树研究所院陈新老师赠送。
1.2 真菌RNA的提取
在PDA培养基平板上接种真菌菌种,1周后从平板上挑菌接种到200 mL PDA液体培养基中,并在28 ℃摇床中200 r·min-1培养3 d,8 000 × g离心收集菌丝,液氮保存。
使用天恩泽公司的真菌RNAout试剂盒,并按照其说明书步骤提取真菌总RNA。然后使用TAKARA公司的PrimeScriptTMII 1st Strand cDNA Synthesis Kit按照其说明书进行cDNA合成。
1.3 基因全长克隆与序列分析
通过对真菌基因组(Yang et al,2014)进行分析,比对找到GGPPS基因的DNA序列,通过和其他GGPPS序列进行比较找出其ORF,并设计上游引物PaGGPPS1-1:ATGAATTCAAACCCCTTTCAAC,和下游引物PaGGPPS2-1:CTAGTGCGCATTGGAATCCGAC,交由中美泰和公司合成。使用KAPA公司的HIFI 热启动高保真酶进行扩增,PCR条件如下:95 ℃预变性 3 min; 98 ℃ 20 s,65 ℃ 15 s, 72 ℃ 1 min,共 32 个循环; 72 ℃ 10 min。
将PCR得到的片段进行胶回收,然后连接到pUC-19克隆载体上送到中美泰和公司进行测序验证。利用EditSeq软件对序列进行初步分析,之后使用在线分析软件ProtScale(http://www.expasy.ch/tools/protscale.html)和SMART (http://smart.embl-heidelberg.de/smart/set_mode.cgi?GENOMIC=1)和 SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat. pl?page /NPSA/npsa_sopma. html)对序列进行进一步分析。
1.4 同源性分析和系统进化树的构建
使用NCBI的blastx对PaGGPPS进行比对,找出同源性高的序列。用GenBank数据库进行PaGGPPS氨基酸序列搜索,找到斑马鱼(Daniorerio, NP_956329.1 )、果蝇(Drosophilamelanogaster, NP_523958.2)、小鼠(Musmusculus, NP_034412.1)、人类(Homosapiens, NP_001032354.1)、乳酸克鲁维酵母(Kluyveromyceslactis, XP_455003.1)、酿酒酵母(Saccharomycescerevisiae, NP_015256.1)、棉病囊菌(Ashbyagossypii, NP_984623.1)、稻瘟病菌(Magnaportheoryzae, XP_003718242.1)、脉孢菌(Neurosporacrassa, XP_960695.2)、青霉菌(Penicilliumroqueforti, CDM28596.1)、玉米(Zeamays, ABQ85646.1)、拟南芥(Arabidopsislyrata, XP_002884145.1)、曼地亚红豆杉(Taxus×media, AAS67008.1)和银杏(Ginkgobiloba, AAQ72786.1)14个物种的GGPPS的氨基酸序列,使用软件ClustalX和MEGA4.1对这15个GGPPS进行多序列比对并构建分子进化树。
1.5 表达引物的设计和载体构建
使用软件Primer 5分析克隆到的GGPPS基因序列的以及原核表达载体pET30a的酶切位点,分别选用KpnI和NotI两个酶切位点(下划线处标出),并设计引物,上游引物为G- pET -1-1:CGGGGTACCATGAATTCAAACCCCTTTCAAC;下游引物为G-pET-2-1:TTGCGGCCGCCTAGTGCGCATTGGAATCCGAC。
以含有GGPPS的pUC-19质粒为模板,使用KAPA公司的HIFI 热启动高保真酶进行PCR扩增,PCR条件如下:95 ℃预变性3 min; 98 ℃ 20 s,65 ℃ 15 s, 72 ℃ 1 min,共 5 个循环;98 ℃ 20 s,68 ℃ 15 s, 72 ℃ 1 min,共28个循环; 72 ℃ 10 min。
将得到的PCR产物(用Axygen公司的PCR产物回收试剂盒进行回收),和表达载体分别使用NEB公司的酶进行KpnI和NotI双酶切。酶切2 h后进行纯化,并用NEB的T4 DNA连接酶16 ℃连接6 h。转化大肠杆菌DH5α,倒置37 ℃过夜培养,菌落PCR筛选阳性菌株。将阳性菌株送中美泰和公司测序验证,并将阳性菌株扩大培养,使用Axygen质粒小提试剂盒提取质粒,进行双酶切鉴定。
1.6 重组蛋白的原核表达
将酶切鉴定的重组质粒转化到大肠杆菌BL21(DE3) plysS菌株。筛选出阳性菌株进行扩大培养,并保存部分菌株。
取新鲜菌液1 mL到50 mL LB液体培养基中,37 ℃摇床在200 r·min-1下培养3 h至菌液OD为0.5~0.6时,再调至20 ℃继续培养1 h。向菌液中加IPTG至终浓度为0.2 mmol·L-1,进行诱导表达,继续在20 ℃培养8 h。收集菌液,4 000×g离心10 min收集菌体。加入5 mL康为世纪公司的细菌蛋白提取试剂,充分混匀后500 W超声2 min裂解细菌,直至菌液清亮。12 000×g离心10 min,收集上清并进行SDS-PAGE电泳,鉴定蛋白表达是否可溶。
1.7 重组蛋白的纯化
使用康为世纪公司的Ni-Agarose His标签蛋白纯化试剂盒(可溶型蛋白)进行重组蛋白的纯化,主要步骤按照其说明书进行,在清洗杂蛋白过程中,添加一次10柱体积的50 mmol·L-1咪唑洗脱一次,后续步骤和说明书相同。最后将纯化的蛋白进行SDS-PAGE电泳进行鉴定。
2结果与分析
2.1 PaGGPPS基因的克隆和序列分析
以真菌的cDNA为模版,通过PCR得到一段1 113 bp的ORF片段(图1),并将该片段提交GenBank,得到登录号:KM881430。命名该基因为PaGGPPS。
用EditSeq软件分析发现ORF可编码370个氨基酸,预计表达蛋白分子量约为40.98 kD,预测蛋白等电点为6.168。使用在线预测软件ProtScal (Kyce & Doolittle, 1982),设定参数为默认,分析该蛋白的亲疏水性,预测结果显示其整体为亲水性蛋白。用结构域预测工具SMART (Schultz et al, 1998)对其氨基酸序列分析发现,该基因包含类异戊二烯类化合物合酶特有的一个polyprenyl_synt特征结构域。用在线软件SOPMA (Geourjon & Deléage, 1995)进行二级结构预测,结果显示该GGPPS蛋白由185个氨基酸组成的20个α- 螺旋,23个氨基酸组成的8延伸链,18个氨基酸组成的 10 个β-转角和144个氨基酸组成的20个随意卷曲构成,它们分别占50%、6.22%、4.86%和38.92%。

图 1 榛子内生真菌Penicillium aurantiogriseum NRRL 62431 GGPPS基因的PCR电泳图 M. DL 5 000 分子标记; 1. PCR产物。下同。Fig. 1 Agarose gel electrophoresis analysis of PaGGPPS gene fragment in Penicillium aurantiogriseum NRRL 62431M. DL 5 000 Marker; 1. PCR product. The same below.
2.2 同源性及系统演化分析
通过NCBI的blastx对PaGGPPS氨基酸序列在NCBI上进行同源性比对, 结果表明榛子内生真菌的PaGGPPS氨基酸序列与娄地青霉(Penicilliumroqueforti)、曲霉菌(Aspergillusclavatus)、费氏新萨托菌(Neosartoryafischeri)、丝衣霉菌(Byssochlamysspectabilis)、黄丝曲霉菌(Talaromycesstipitatus)、副球孢子菌(Paracoccidioides)、夹膜组织胞浆菌(Ajellomycescapsulatus)、巴西芽生菌(Paracoccidioidesbrasiliensis)和球孢子菌(Coccidioidesimmitis)等菌的GGPPS氨基酸序列有较高的同源性, 分别为94%、76%、76%、76%、71%、71%、71%、71%、70%。我们从NCBI上下载了一些物种的GGPPS,并用ClustalX(Thompson et al,1997) 和 MEGA 4.1 (Tamura et al, 2007) 对榛子内生真菌的和下载的PaGGPPS氨基酸序列进行多序列比对, 构建系统进化树,采用 default 参数, 自检举1 000次, 结果如图2所示。从进化树中可以看出,榛子内生真菌的GGPPS和青霉菌的进化关系最近;几种真菌的GGPPS和动物的GGPPS的进化关系比酵母的更近,而与几种植物的GGPPS的进化关系最远。

图 2 GGPPS蛋白系统进化分析 Fig. 2 Phylogenetic analysis of GGPPS proteins
2.3 表达载体pET-30a-PaGGPPS的构建及鉴定
将转化pET-30a-PaGGPPS表达载体的菌株进行PCR鉴定,鉴定结果为阳性。比对测序结果表明,PaGGPPS基因片段已成功连接到表达载体。KpnI和NotI双酶切鉴定重组质粒,重组质粒可以成功切出一个1 100 bp左右的插入片段和一个大于5 000 bp的载体片段,如图3所示。

图 3 重组质粒pET-30a-PaGGPPS的双酶切鉴定Fig. 3 Double digested identification of recombinant plasmid pET-30a-PaGGPPS
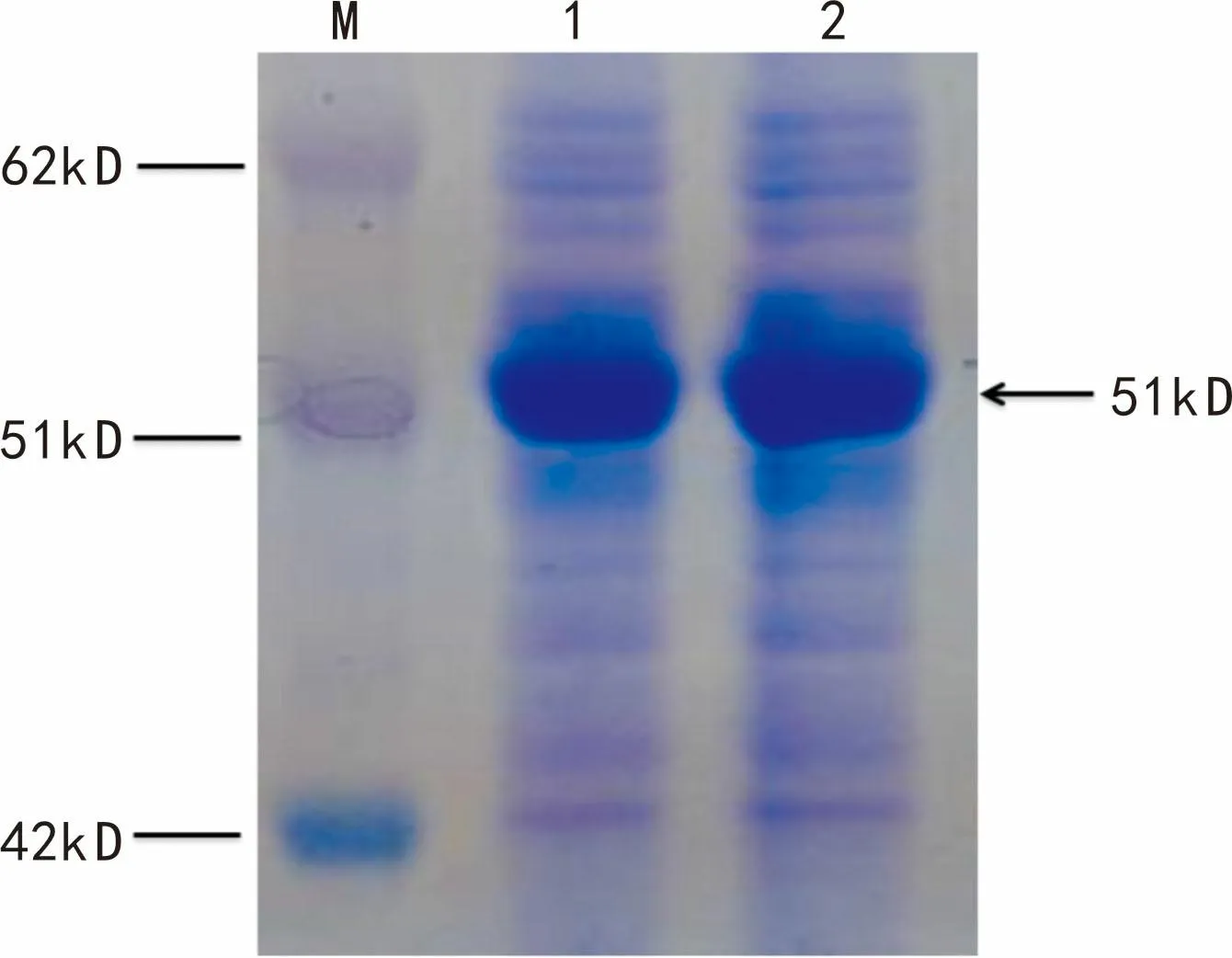
图 4 PaGGPPS 在大肠杆菌中表达 M. 蛋白分子量标准; 1. PaGGPPS重组菌裂解后上清; 2. PaGGPPS 重组菌裂解后沉淀。Fig. 4 PaGGPPS express in Escherichia coli M. Protein Marker standard; 1. Products of recombinant bacteria of PaGGPPS protein in supernatant; 2. Products of recombinant bacteria of PaGGPPS protein in precipitate.
2.4 重组蛋白的可溶性鉴定
重组菌株在20 ℃经0.2 mmol·L-1IPTG诱导表达8 h后,收集菌体并裂解,上清液进行SDS-PAGE电泳验证,结果发现重组蛋白在51 kD左右得到表达,并得到了良好的可溶性表达,如图4所示。
2.5 重组蛋白纯化结果
经试剂盒纯化后,得到了较高纯度的重组GGPPS蛋白。经SDS-PAGE检测显示,重组GGPPS蛋白纯化的效果良好,得到较高浓度的单一条带,如图5所示。
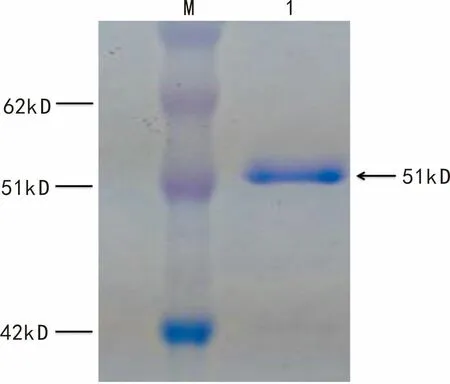
图 5 重组PaGGPPS 蛋白纯化产物Fig. 5 Purification product of PaGGPPS recombine protein
3讨论
目前已从不同的宿主植物中分离出了大量的产紫杉醇的内生真菌(马玉超等,2003),但对这些内生真菌的紫杉醇合成通路研究并不多见。GGPP是二萜类化合物合成的前体物质,而GGPPS催化IPP和FPP缩合成GGPP,是GGPP合成途径中的关键酶,在植物次生代谢中,处于代谢分支点前体的代谢方向受其调控(Croteau, 1998)。Aharoni et al(2003)和Han et al(2006)通过在拟南芥细胞中过表达GGPPS发现,拟南芥细胞中GGPP的量制约着萜类在其细胞内的合成,GGPP合成所需要的GGPPS在初级水平上对二萜类化合物的合成起着调节作用。因此,要提高内生真菌生产紫杉醇的能力,在合成通路上,最先需要研究GGPPS。本研究的GGPPS和青霉菌的进化关系最近,与其他真菌的进化关系也很近,可能是真菌类的GGPPS进化很保守;而与植物和动物的GGPPS分别属于不同的亚类,可以初步判断真菌和植物之间没有GGPPS基因的水平基因转移,植物和真菌的萜类合酶是否也是不同进化来源?榛子(或红豆杉)与其内生真菌的紫杉烷类化合物的合成能力是否分别进化得到?这些都为后续需要研究的问题。
本研究完整克隆出内生真菌PenicilliumaurantiogriseumNRRL 62431的GGPPS基因的完整ORF序列,并用生物信息学预测和分析了PaGGPPS的氨基酸序列、理化性质、疏水性/亲水性、功能结构域和二级结构,这为后面的原核表达提供了一定的理论参考依据。通过预测,PaGGPPS蛋白的等电点为6.168,在进行原核表达时,调节培养基的pH值使其和重组蛋白的等电点不同,从而可以增加表达的重组蛋白的可溶性。成功构建原核表达载体后,转化大肠杆菌进行诱导表达,通过低温诱导,成功表达出可溶性的蛋白,并通过试剂盒进行了纯化。这些工作都为下一步深入研究该内生真菌的紫杉醇合成途径中此基因的作用和构建高产紫杉醇基因工程菌株提供了一定的基础。
参考文献:
AHARONI A,GIRI AP,DEUERLEIN S,et al, 2003. Terpenoid metabolism in wild- type and transgenicArabidopsisplants [J]. Plant Cell,15(12):2 866-2 884.
CRAGG GM,SCHEPARTZ SA,SUFFNESS M,et al, 1993. The taxol supply crisis. New NCI policies for handling the large-scale production of novel natural product anticancer and anti-HIV agents [J]. J Nat Prod,56(10):1 657-1 668.
GEOURJON C,DELéAGE G, 1995. SOPMA: Significant improvement in protein secondary structure prediction by consensus prediction from multiple alignments [J]. Comp Appl Biosci,11(6): 681-684.
HAN JL,LIU BY,YE HC,et al, 2006. Effects of overexpression of the endogenous famesyl diphosphate synthase on the artemisinin content inArtemisiaannuaL. [J]. J Integr Plant Biol,48(4):482-487.
HEFNER J,KETCHUM RE,CROTEAU R, 1998. Cloning and functional expression of a cDNA encoding geranylgeranyl diphosphate synthase fromTaxuscanadensisand assessment of the role of this prenyltransferase in cells induced for taxol production [J]. Areh Biochem Biophys,360(1):62-74.
HOFFMAN,A,KHAN W,WORAPONG J,et al, 1998. Using High performance liquid chromatogram phy-thermospray mass spectrometry to identify useful metabolites in plant extracts [J]. Spectroscopy,13:22-32.
HUA WP,SONG SH,ZHI Y,et al, 2014. Cloning and expression analysis of theSmGGPPS3 gene fromSalviamiltiorrhiza[J]. Plant Sci J,32(1):50-57. [化文平,宋双红,智媛,等, 2014. 丹参SmGGPPS3基因的克隆及表达分析 [J]. 植物科学学报,32(1):50-57.]
KANG JC,SUN JR,WEN TC,et al, 2011. Recent research advances on endophytic fungi producing taxol [J]. Mycosystema,30(2):168-179. [康冀川,孙靳瑞,文庭池,等. 2011. 内生真菌产紫杉醇研究的回顾与展望 [J]. 菌物学报,30(2):168-179.]
KOJIMA N,SITTHITHAWORN W,VIROONCHATAPAN E,et al, 2000. Geranylgeranyl diphosphate synthase fromScopariadulcisandCrotonsublyratus. cDNA cloning,functional expression,and conversion to farnesyl diphosphate synthase [J]. Chem Pharm Bull(Tokyo),48(7):1 101-1 103.
KUMARAN RS,HUR BK, 2009. Screening of species of the endophytic fungusPhomopsisfor the production of the anticancer drug taxol [J]. Biotechnol Appl Biochem,54(1):21-30.
KUMARAN RS,MUTHUMARY J,HUR BK, 2008. Taxol fromPhyllostictacitricarpa,a leaf spot fungus of the angiospermCitrusmedica[J]. J Biosci Bioeng,106(1):103-106.
KYCE J, DOOLITTLE RF, 1982. A simple method for displaying the hydropathic character of a protein [J]. J Mol Biol,157(1): 105-132.
LI JY,STROBEL G,SIDHU R,et al, 1996. Endophytic taxol-producing fungi from bald cypress,Taxodiumdistichum[J]. Microbiology,142(8):2 223-2 226.
LI LQ,YANG YG,ZENG Y,et al, 2011. Chemical constituents of endophyteTalaromycessp. T1BF fromTaxusyunnanensis[J]. Guihaia,31(5):699-701. [李良群,杨艳光,曾英,等, 2011. 云南红豆杉内生真菌Talaromycessp.T1BF的化学成分研究 [J]. 广西植物,31(5):699-701.]
LIU K,DING X,DENG B,et al, 2009. Isolation and characterization of endophytic taxol-producing fungi fromTaxuschinensis[J]. J Ind Microbiol Biotechnol,36(9):1 171-1 177.
MA YC,ZHAO K,WANG SW,et al, 2003. Biological diversity of taxol producing endophytic fungi [J]. J Fung Res,1(1):28-32. [马玉超,赵凯,王世伟,等, 2003. 产紫杉醇(Taxol)内生真菌的生物多样性 [J]. 菌物研究,1(1):28-32.]
METZ AM,HADDAD A,WORAPONG J,et al, 2000. Induction of the sexual stage ofPestalotiopsismicrospora,a taxol-producing fungus [J]. Microbiology,146(8): 2 079-2 089.
PAN Z,WANG H,ZHONG J, 2000. Scale-up study on suspension cultures ofTaxuschinensiscells for production of taxane diterpene [J]. Enzyme Microb Technol,27(9):714-723.SCHULTZ J,MILPETZ F,BORK P,et al, 1998. SMART,a simple modular architecture research tool: identification of signaling domains [J]. Proc Natl Acad Sci,USA,95(11):5 857-5 864.
SREEKANTH D,SYED A,SARKAR S,et al, 2009. Production,purification and characterization of taxol and 10DAB III from a new endophytic fungusGliocladiumsp. isolated from the Indian yew tree,Taxusbaccata[J].J Microbiol Biotechnol,19(11):1 342-1 347.
STIERLE A ,STROBEL G,STIERLE D, 1993. Taxol and taxane production byTaxomycesandreanae,an endophytic fungus ofpacificyew[J] . Science,260(5105) : 214-216.
STROBEL GA,HESS WM,LI JY,et al, 1997.Pestalotiopsisguepinii,a Taxol-producing Endophyte of theWollemiPine,Wollemianobilis[J]. Austr J Bot,45(6):1 073-1 082.
SUN RF, RAN XQ, WANG JF, 2008. Isolation and identification of a taxol-producing endophytic fungus fromPodocrapus[J]. Acta Microbiol Sin, 48(5):589-595. [孙端方, 冉雪琴, 王嘉福, 2008. 一株产紫杉醇罗汉松内生真菌的分离和鉴定 [J]. 微生物学报, 48(5):589-595.]
(Continueonpage506)(Continuefrompage461)
TABATA H, 2004. Paclitaxel production by plant-cell-culture technology [J]. Adv Biochem Engin Biotechnol, 87:1-23.
TAMURA K, DUDLEY J, NEI M,et al, 2007. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Mol Biol Evol, 24(8): 1 596-1 599.
THOMPSON JD, GIBSON TJ, PLEWNIAK F,et al, 1998. Multiple sequence alignment with Clustal X [J]. Trends Biochem Sci, (23): 403-405.
WALKER K, CROTEAU R, 2001. Taxol biosynthetic genes [J]. Phytochemistry, 58(1):1-7.
WANG X, XIAO Y, LIU D, et al, 2012. Cloning the cDNA fragment ofGGPPSgene fromTaxuscuspidate[J]. J Nat Sci Heilongjiang Univ, 29(4):536-540. [王歆, 肖野, 刘丹, 等, 2012. 东北红豆杉细胞GGPPS基因cDNA的克隆 [J]. 黑龙江大学自然科学学报, 29(4):536-540.]
WANI MC,TAYLOR HL, WALL ME, et al, 1971. Plant antitumor agents. VI. The isolation and structure of taxol, a novel antileukemic and antitumor agent fromTaxusbrevifolia[J]. J Am Chem Soc, 93(9):2 325-2 327.
YANG YF, ZHAO HN,BARRERO RA, et al, 2014. Genome sequencing and analysis of the paclitaxel-producing endophytic fungusPenicilliumaurantiogriseumNRRL 62431 [J]. BMC Genomics, 15:69.
ZHANG P, ZHOU PP, YU LJ, 2009. An endophytic taxol-producing fungus fromTaxusmedia,CladosporiumcladosporioidesMD2 [J]. Curr Microbiol, 59(3):227-232.
Cloning and expression of the GGPP synthase gene from the paclitaxel-producing endophytic fungus
(Penicilliumaurantiogriseum) inCorylusavellanaLIUHong-Wei,YANGYan-Fang,LIYan-Yan,WANGShuai,QIUDe-You*
( State Key Laboratory of Tree Genetics and Breeding, Research Institute of Forestry,Chinese Academy of Forestry,Beijing100091,China)
Abstract:Geranylgeranyl diphosphate synthase is one of the key enzymes in taxol synthesis pathway in paclitaxel-producing endophytic fungus. To study taxol synthesis in paclitaxel-producing endophytic fungus, we need to identify the existence of GGPP synthase in the first place. With RT-PCR method, we cloned the ORF fragment of PaGGPPS (GenBank accession number: KM881430) from the paclitaxel-producing endophytic fungus Penicillium aurantiogriseum in Corylus avellana. The bioinformatics methods were employed to analyze and predict the composition of nucleic acid and amino acid sequence of this gene. The results showed that the length of ORF was 1 113 bp, the molecular weight of the protein was 40.98 kD, and the theoretical isoelectric point was 6.168, which suggested that PaGGPPS protein was acidic. The hydrophilicity analysis found that PaGGPPS was a hydrophilic protien. The α-helix was the dominant secondary structure constructional element of the protein which contained one tpolyprenyl_synt function domain. The identity alignment of GGPPS nucleic acid sequences of taxol producing endophytic fungi in hazelnut and other species showed that the identity were highest between Penicillium roqueforti, Aspergillus clavatus and Neosartorya fischeri, respectively 94%, 76% and 76%. The homologous alignment of Amino acids showed that GGPPS genes were divided into two groups. The GGPPS genes from animal, fungal and yeast were clustered in one group, the GGPPS genes from plant were in the other group. The homologous alignment of nucleic acid sequences showed that the homologous were the highest between GGPPSs in paclitaxel-producing endophytic fungus (Penicillium aurantiogriseum) in Corylus avellana and in Penicillium roqueforti, and GGPPSs in paclitaxel-producing endophytic fungus and plant have the longest distance in the phylogenetic tree. After the bioinformatics analysis, we constructed a pET30a prokaryotic expression vector of PaGGPPS. The protein of PaGGPPS was successfully expressed in the soluble state in Escherichia coli. All the experiments we had done can provide some information for the further research.
Key words:endophytic fungus(Penicillium aurantiogriseum), GGPP synthase, prokaryotic expression, gene cloning, taxol
中图分类号:Q943.2
文献标识码:A
文章编号:1000-3142(2016)04-0456-06
作者简介:刘洪伟(1987- ),男,山东日照人,在读博士,主要从事紫杉醇相关分子生物学方面的研究,(E-mail)lhwei1987@126.com。 *通讯作者: 邱德有,博士,研究员,主要从事次生代谢方面的研究,(E-mail)qiudy@caf.ac.cn。
基金项目:中央级公益性科研院所基本科研业务费专项(RIF2014-01,CAFYBB2012-042)[Supported by the Basic Research Fund for Non-profit Research Institutes at the Central Levels(RIF2014-01,CAFYBB2012-042)]。
*收稿日期:2014-10-09修回日期: 2014-12-03
DOI:10.11931/guihaia.gxzw201410011
刘洪伟,杨艳芳,李艳艳,等. 榛子产紫杉醇内生真菌Penicilliumaurantiogriseum中GGPP合酶基因的克隆与表达[J]. 广西植物, 2016, 36(4):456-461
LIU HW,YANG YF,LI YY,et al. Cloning and expression of the GGPP synthase gene from the paclitaxel-producing endophytic fungus (Penicilliumaurantiogriseum) inCorylusavellana[J]. Guihaia, 2016, 36(4):456-461
