烟草多酚氧化酶基因的克隆与序列分析
2016-05-26蔡传斌吴玉俊吴拥军
蔡传斌,吴玉俊,曹 宁,龚 露,吴拥军
(贵州大学 农业生物工程研究院,生命科学学院,山地植物资源保护与种质创新省部共建教育部重点实验室,贵州 贵阳 550025)
烟草多酚氧化酶基因的克隆与序列分析
蔡传斌,吴玉俊,曹宁,龚露,吴拥军*
(贵州大学 农业生物工程研究院,生命科学学院,山地植物资源保护与种质创新省部共建教育部重点实验室,贵州 贵阳 550025)
摘要:多酚氧化酶(PPO)在高等植物中广泛存在,其利用分子氧催化氧化酚类物质为醌,对植物的抗虫和抗病起着一定的作用,同时它介导的酶促反应也是烤制中烟草褐变的主要原因。本文采用RT-PCR,成功地从野生烟草(Nicotiana tabacum)叶片中克隆出了PPO cDNA序列。序列分析表明,烟草PPO基因ORF长为1773 bp,编码590个氨基酸,基因登陆号为KC540916,烟草与其他物种PPO的核苷酸序列与氨基酸序列同源性达80%以上,并包含两个高度保守的铜离子结合区域。烟草PPO基因的克隆为烟草的抗性研究和褐化反应的控制研究提供了良好的理论基础。
关键词:烟草;多酚氧化酶;基因克隆;序列分析
多酚氧化酶((Polyphenoloxidase,PPO)是一类广泛存在于自然界,由核基因编码的金属氧化酶[1]。多酚氧化酶的特征是能利用分子氧催化酚类物质成为对应的醌,广义上的多酚氧化酶包括单酚单氧化酶(酪氨酸酶tyrosinase,EC.1.14.18.1)、双酚氧化酶(儿茶酚氧化酶catecholoxidse,EC.1.10.3.2)和漆酶(laccase,EC.1.10.3.1) 三大类,现在研究中所提及的多酚氧化酶主要指儿茶酚氧化酶和漆酶的统称。
酚类物质作为烟草的一种次生代谢产物,是烟草重要的香气和吃味前体物,对成品烟叶的质量有着重要影响,是衡量烟草品质的重要指标。作为决定酚类物质去向的关键酶,在烟草的调制过程中,PPO介导棕色化反应,将绿原酸、芸香苷等酚类物质氧化为黑褐色的醌类物质,使烟叶从黄色转变为不同程度的褐色[2]。Johnson等[3]研究表明,如果烟叶颜色完全变为褐色,多酚类物质就会减少85%。不仅会降低烟叶内致香物质的含量,还会直接影响成品烟叶的外观质量,使烟叶品质下降[4]。此外,PPO介导的棕色化反应还会使叶片变薄变轻,弹性变差,燃烧力变弱,降低烟叶的可用性直到其失去使用价值[5]。但是PPO在高等植物的生长过程却起着重要的抗病保护作用。其保护机制主要包括:(1)PPO的产物醌具有毒性,可直接发挥抗病作用;(2)通过产物醌共价结合氨基酸对昆虫和病原体形成抗营养机制[6];(3) 产物醌的次生反应生成的黑色素沉积形成痂,封闭受到感染的组织,防止感染扩散[7];(4)产物醌促使腺毛状体分泌粘性物质并聚集在表皮形成一道物理防御。
本文利用GenBank数据库中NicotianabenthamianapolyphenoloxidasemRNA(Accession:HQ245096)序列设计了一对引物,成功的从野生烟草叶片中克隆出了PPO基因,希望通过研究PPO的超标达或反义抑制,达到提高烟草抗虫性和品质的目的。
1材料与方法
1.1材料与试剂
野生型烟草(Nicotiana tabacum)幼苗新鲜叶片组织。RNA提取试剂盒购于北京天根生化科技有限公司;PrimeScriptTMOneStepRT-PCRKitVer.2、rTaq酶、dNTPs、10×PCRBuffer、T4DNA连接酶、DNAMaker、pGEM-T载体购于宝生物工程大连有限公司;E.Z.N.A.TMGelExtractionKit、E.Z.N.A.TMPlasmidMiniKitI购于美国Omega公司。
C1000TMThermalCyclerPCR仪、UniversalHoodII凝胶成像分析仪:Bio-Rad公司;1-15SartotiusSigma离心机:美国Sigma公司;DYY-7C电泳仪:北京市六一仪器厂。
1.2引物的设计与合成
根据GenBank数据库中NicotianabenthamianapolyphenoloxidasemRNA(Accession:HQ245096)序列,应用DNAstar软件设计特异性引物,上游引物序列:5’-ATGGCTTCTTCTTCTACGTTACC3’,下游引物序列为:5’-TTAACAATCGACAAGCTTAATCTC-3’,由宝生物工程大连有限公司合成,预扩增片段长度在1800bp左右。
1.3总RNA提取
取新鲜的烟草叶片100mg,液氮迅速研磨,利用北京天根生化科技有限公司RNA提取试剂盒提取总RNA,于-80℃保存。将提取的总RNA经琼脂糖凝胶电泳检测,选择质量较高,结构完整的RNA为模板进行目的基因的反转录扩增。
1.4RT-PCR扩增目的片断
以烟草总RNA为模板,采用PrimeScriptTMOneStepRT-PCRKitVer.2试剂盒一步法直接扩增目的片段,RT-PRC体系为50μl,10mM上下游引物各2μl,2×1StepBuffer25μl,PrimeScript1StepEnzymeMix2μl,RNA模板小于1μg;反应程序为50℃反转录30min,95℃ 预变性2min;然后95℃变性30s,50℃退火30s,72℃延伸90s,循环30次;最后72℃延伸10min。
1.5PPO基因的克隆与测序
回收纯化RP-PRC产物,连接到pGEM-T载体,转化到E.coliDH5α感受态细胞。进行菌落PCR与质粒PCR验证后,选取阳性菌液于宝生物工程大连有限公司测序。
1.6烟草PPO序列分析
利用NCBI数据库对PPO基因的核苷酸序列和氨基酸序列进行同源性分析,利用DNAStar7.1、MEGA5、ClustalX1.81软件分析氨基酸保守结构域并绘制遗传进化树。
2结果与分析
2.1烟草PPO基因的RT-PCR扩增
RT-PCR产物通过1.2%琼脂糖凝胶电泳,染色后经UniversalHoodⅡ凝胶成像分析仪分析记录实验结果。结果如图1所示,RT-PCR扩增了出一条符合大小约1800bp的预期片断。
2.2质粒的重组与转化
重组子菌落PCR与质粒PCR验证结果如图2所示,菌落PCR在约1800bp处出现特异性条带,与RT-PCR扩增目的DNA片断条带大小相符,即获得了阳性重组菌落。将阳性重组菌落接种到液体培养基中培养,提取质粒,进行质粒PCR验证,质粒PCR获得一条大小在1800bp左右的条带,与RT-PCR和菌落PCR结果一致,证明目的基因已连接到pGEM-T质粒上并已转化成功。将提取的质粒送往生物公司测序。
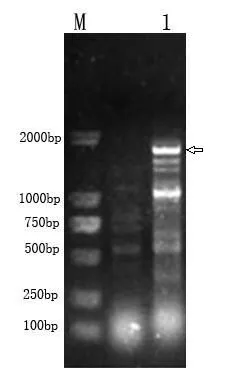
图1 烟草PPO基因的RT-PCR扩增
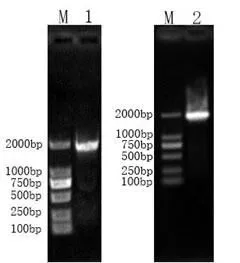
图2 菌落PCR与质粒PCR鉴定
2.3烟草PPO基因的同源性及系统发育分析
测序结果表明,烟草PPO基因的大小为1773 bp,碱基组成:A 27.58%、G 21.94%、T 27.41%、C 23.07%,(G+C)%为45.01%,开放阅读框1773 bp,共编码590个氨基酸,起始密码子和终止密码子分别位于序列两端。将基因序列提交至美国国家生物技术信息中心(National Center of Bio-technology Information,NCBI),获得登录号KC540916。
将克隆得到的基因序列和推测的蛋白质序列在NCBI数据库中进行同源性分析,结果表明与NicotianabenthamianaPPO核苷酸序列高度同源,达到99%以上。在茄科植物中进行同源性比对,发现与茄子(Solanummelongena)、番茄(Solanumlycopersicum)同源性最高,都达到81%以上,与其它科的物种比对时,发现与柿同源性达81%,与紫花苜蓿(Medicagotruncatula)同源性达75%,与橄榄(Oleaeuropaea)的同源性达74%;氨基酸序列与茄子、番茄、马铃薯(Solanumtuberosum)和柿同源性都在80%以上;结构域分析发现,烟草PPO基因含有3段保守结构域,包括漆酶中心结构域(211氨基酸残基),多酚氧化酶中间域(71氨基酸残基)和一个高度保守的C末端模体(PPO1_KFDV,132氨基酸残基)。
利用PROSITE数据库将克隆得到的序列进行蛋白质活性位点分析,发现烟草PPO基因存在着CuA和CuB,氨基酸序列为[HfswlFFpFHRwyLyfyE]和[DPlFYshHanvD]。在与其他物种的PPO进行多序列比对时(图3)发现,CuA与CuB高度同源,其中作为Cu配体的组氨酸高度保守,并且在CuA与CuB的前后出现了一段较为保守的氨基酸序列,推测可能是对CuA与CuB的三维结构的形成起着维持和支撑的作用。
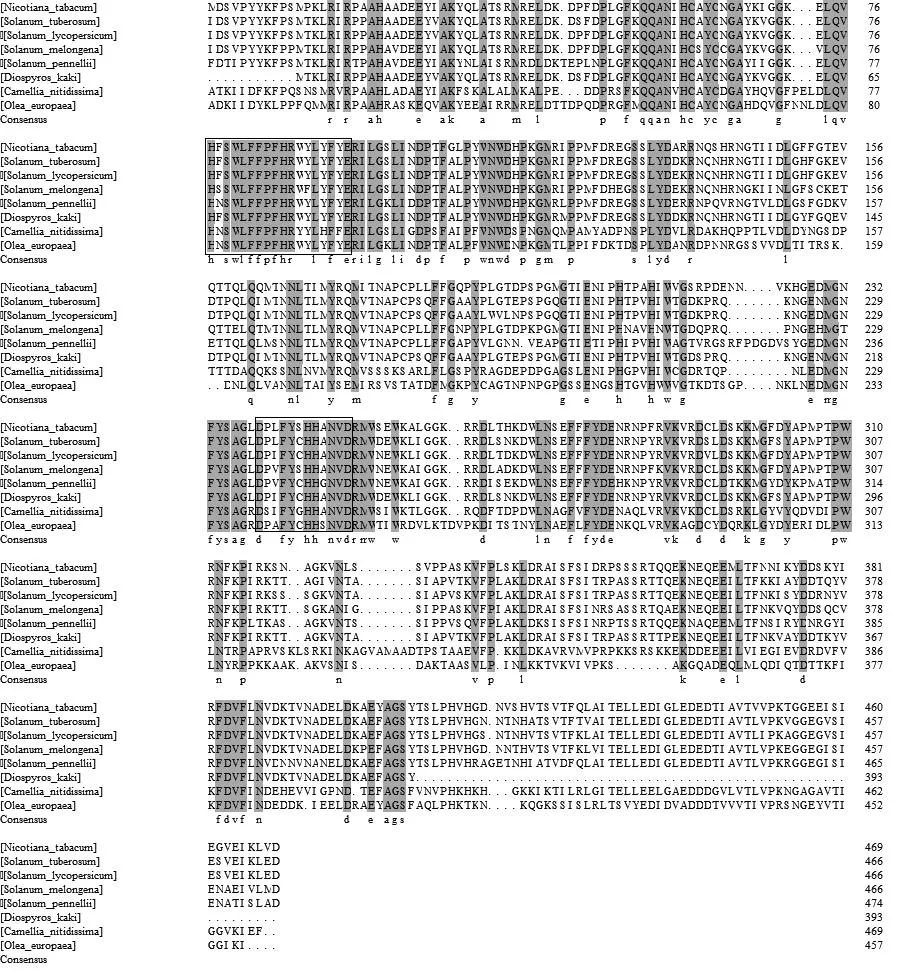
图3 烟草与其他物种的氨基酸多序列比对
利用MegAlign软件对烟草(Nicotianatabacum)、茄子(Solanummelongena)、西红柿(L.esculentum,Solanumlycopersicum)、马铃薯(Solanumtuberosum)、柿(Diospyroskaki)、橄榄(Oleaeuropaea)、棉花(Gossypiumhirsutum)、紫花苜蓿(Medicagosativa)、欧洲大叶杨(Populustrichocarpa)、蚕豆(V.faba)和克莱门柚(Citrusclementina)的PPO氨基酸序列进行多序列同源比对并构建系统发育树(图4),结果表明PPO基因不同的科、属之间呈现高度的保守性, 发育树基本上与生物物种进化树一致。此外,分析发现柿PPO氨基酸序列与茄科植物高度同源,推测两者可能存在相似的进化机制。
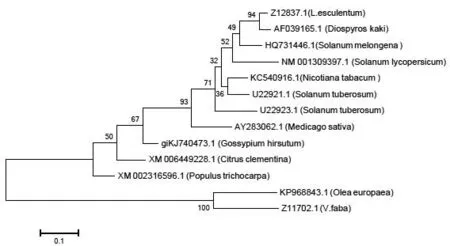
图4 烟草多酚氧化酶基因氨基酸序列进化树
2.4烟草PPO三级结构预测分析
使用SWISS-MODEL[8]对烟草PPO氨基酸序列进行蛋白质三维建模(图5),对比其数据库中的模型发现,烟草PPO与Polyphenol oxidase模型和Catechol oxidase模型同源性最高,分别达到51.64%和52.37%。烟草PPO的三维模型显示,CuA和CuB均处于蛋白分子的中心α-螺旋堆叠区域,作为Cu配体的两个组氨酸残基在空间上紧密相连。
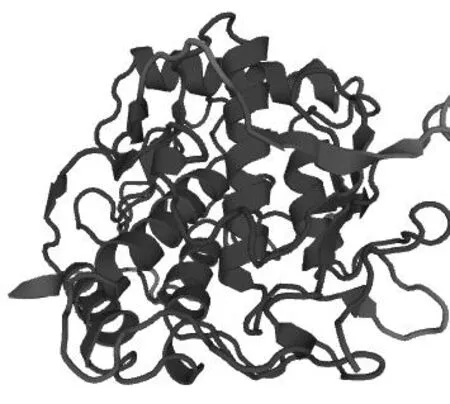
图5 烟草PPO蛋白质三维结构
3结论与讨论
大多数植物PPO有多个编码基因,如番茄就存在5个PPO编码基因[9],呈现出家族性。而Maria Helena[10]发现烟草的花PPO基因只在花的发育过程中特异性表达,在其他组织中不会表达。将克隆得到的烟草叶片PPO基因比对花PPO基因,发现其同源性在99%以上,烟草中的PPO基因是否也呈现出相似的家族性还待进一步研究证明。
漆酶家族通常存在两个Cu结合的保守区域(CuA和CuB),CuA含有两个保守的组氨酸残基,定位在N末端,CuB含有一个保守的组氨酸残基,是漆酶的活性中心位点[11]。这种Cu结合区域在节肢动物与软体动物的血蓝蛋白中也同样存在,并被证明是分子氧的转运载体[12-13]。一般来说高等植物的PPO都含有CuA和CuB,部分植物除这两个Cu结合域之外还含有CuC[14],CuA、CuB和CuC作为PPO的活性区域在不同的物种间都保持着高度的保守性,但在烟草和茄科的大部分植物的PPO中并未发现CuC,推测可能是在进化过程中舍弃了该域。
PPO在植物的生长过程中起到的抗性防御作用现在已被大多数研究者所肯定,其介导的褐化反应是高等植物重要的非特异性免疫防线之一,但是在一些经济作物中却影响着产品的质量。在烟草中,PPO对烟草的烤制以及卷烟工业中的加工甚至贮藏都有着重要的影响[15]。现阶段主要是通过控制PPO的活性来抑制烟草烤制过程中的棕色反应。包括调节温度、pH、添加化学抑制剂等,但是这些手段不仅提高成本,而且对烟草质量造成一定影响,目前较为成功的是利用烟垛密封降氧抑制酶促棕色化反应的发生[16],但是这对现有的烟草烤制工艺是一个重大挑战。烟草PPO基因的克隆为烟草的抗性研究和褐化反应的控制研究提供了良好的理论基础。通过转基因的形式来调节烟草叶片PPO抑制和表达,实现烟草抗性和质量的统一还待进一步研究。
参考文献
[1]Alfred M. Mayer. Polyphenol oxidase in plants-resent proress[J]. Phytochemistry, 1987, 26(1): 11-20.
[2]Gopalam A, Gopalaehari N C. Biochemical changes in leaf pigments and chemical constituents during flue-curing of tobacco[J]. Nicotine Tob Res, 1979, 5(2):113-117.
[3]Zucker M, Stinson H T. The role of chlorogenic acid and plastid pigments in the browning of variegated tobacco leaves[J]. Tobacco Science, 1960, 151(24):229-233.
[4]Court W A, Hendel J G. Influence of removing lower leaves and topping height on agronomic and chemical characteristics of flue-cured tobacco[J]. Tobacco Science, 1989, 69(3):15-17.
[5]Zucker M, Ahren J F. Quantitive assay quantitative assay of cholrogenic acid and its pattern of distribution within tobacco leaves [J]. Plant Phys, 1958, 33(4):246-249.
[6]Duffey S, Felton G. Enzymatic antinutritive defenses of the tomato plant against insects.[C]//ACS Symposium series American Chemical Society, 1991,166-197.
[7]Zawistowski J, Biliaderis CG,Eskin NAM. Polyphenol oxidase.In:Robinson DS,Skin NAME (eds). Oxidative Enzymes in Foods[M]. London:Elsevier Science Publishers, 1991.
[8]Guex N, Peitsch M C, Schwede T. Automated comparative protein structure modeling with SWISS-MODEL and Swiss-PdbViewer: A historical perspective[J]. Electrophoresis, 2009, 30(1):162-173.
[9]Newman SM, Eannetta NT, Yu H, et al. Organization of the tomato polyphenol oxidase gene family[J]. Plant Mol Biol, 1993, 21(6):1035-105.
[10]Maria Helena S.Goldman,Jef Seurinck, Mozart Marins, Gustavo H. Goldman, Celestina Mariani. A tobacco flower-specific gene encodes a polyphenol oxidase[J]. Plant Molecular Biology, 1998, 36(3):479-485.
[11]Jackman M.P, Hajnal A, Lerch K. Albino mutants of Streptomyces glaucescens tyrosinase[J]. Biochem. J, 1991, 274(3):707-713.
[12]Linzen B. Blue blood: structure and evolution of hemocyanin[J]. Naturwissenschaften, 1989, 229(4713):206-211.
[13]Lang W.H, van Holde K.E. Cloning and sequencing of Octopus dofleini hemocyanin cDNA: derived sequences of functional units Ode and Odf[J]. Proceeding of the National Academy of Sciences,1991, 88(1):244-248.
[14]R.W. Joy, M. Sugiyama, H. Fukuda, A. Komamine. Cloning and characterization of polyphenol oxidase cDNAs of Phytolacca americana[J]. Plant Physiol, 1995, 107:1083-1089.
[15]李玉娥,尹启生,宋纪真,等. 烟草酶促棕色化反应及调控技术研究进展[J]. 中国烟草科学,2008,29(6):71-77.
[16]范坚强,宋纪真,赖成连,等. 密封降氧抑制醇化过程中烟片颜色转深试验[J]. 烟草科技,2005(12):3-6.
Cloning and Sequence Analysis of Polyphenol Oxidase Gene fromNicotianatabacum
CAI Chuan-bin, WU Yu-jun, CAO Ning, GONG Lu, WU Yong-jun*
(Key Laboratory of Plant Resource Conservation and Germplasm Innovation in Mountainous Region (Ministry of Education), Institute of Agro-bioengineering, College of Life Science, Guizhou University, Guiyang, Guizhou 550025, China)
Abstract:Polyphenol oxidases(PPO), catalyzing the oxygen-dependent oxidation ofphenols to quinines,areubiquitous among higher plantspecies, and assumedto beinvolved in plant defense against pests and pathogens.It had been proved to be the primary response for the deleterious browning of flue-cured tobacco. Nicotiana tabacum PPO gene had been successfully cloned by RT-PCR methodology. Sequence analysis indicated that the lengthof open reading frameof Nicotiana tabacum PPOgene was 1773bp, encoding 590 amino acids, which achieved the GenBankaccession numberNo.KC540916. Being blasted with NCBI Database, the PPO gene identities between Nicotiana tabacum and the relatives were higher than 80% both in nucleotide and amino sequences. Two copper-binding conserved domains were predicted. The cloning and sequence analysis of Nicotiana tabacum PPO gene could bring new clues for further explorations of tobacco plant-pest interactions and browning reaction.
Keywords:Nicotiana tabacum; Polyphenol Oxidase; Cloning; Sequence analysis
文章编号:1008-0457(2016)01-0057-05国际DOI编码:15958/j.cnki.sdnyswxb.2016.01.012
中图分类号:Q751
文献标识码:A
*通讯作者:吴拥军(1971-),男,博士,教授,硕士生导师,主要研究方向:植物分子生物学研究;E-mall:wyjbio@163.com。
基金项目:国家自然科学基金“转CHIFN-y烟草抗虫机制”(31071755/C1408);烟草行业重点实验室开放课题计划“Ch1FN-y调控烟草腺毛发育机制研究”(中烟办[2014])。
收稿日期:2016-01-18;修回日期:2016-02-05
