适于悬浮培养的半夏疏松愈伤组织诱导及增殖技术
2016-05-26刘贵贤张明生李小兰胡珊珊韦红边高晓峰
刘贵贤, 张明生, 李小兰, 胡珊珊,韦红边,高晓峰
(贵州大学 生命科学学院 贵州 贵阳 550025;山地植物资源保护与种质创新省部共建教育部重点实验室, 贵州 贵阳 550025)
适于悬浮培养的半夏疏松愈伤组织诱导及增殖技术
刘贵贤, 张明生*, 李小兰, 胡珊珊,韦红边,高晓峰
(贵州大学 生命科学学院 贵州 贵阳 550025;山地植物资源保护与种质创新省部共建教育部重点实验室, 贵州 贵阳 550025)
摘要:用半夏叶片或叶柄作外植体,通过调节植物生长调节物质的种类、浓度及培养条件,以获得适于悬浮培养的半夏疏松愈伤组织。结果表明,添加2,4-D较NAA诱导的愈伤组织疏松,将叶片接种于MS + 2,4-D 1.0 mg/L + 6-BA 1.5 mg/L + 蔗糖30 g/L + 琼脂6 g/L或叶柄接种于MS + 2,4-D 1.0 mg/L + 6-BA 1.0 mg/L + 蔗糖30 g/L+琼脂6 g/L上诱导出的愈伤组织长势较好且疏松,诱导率分别达到100%和95.6%,愈伤组织鲜重分别为0.932 g和0.622 g。将上述愈伤组织以MS + 2,4-D 2.0 mg/L + 6-BA 1.0 mg/L + 蔗糖30 g/L + 琼脂6 g/L培养基连续继代3次,便获得适于建立细胞悬浮培养体系的疏松愈伤组织,从而为半夏人工种子生产必须的同步化高质量人工种胚的培养提供可靠材料。
关键词:半夏;愈伤组织;悬浮培养;植物生长调节物质
半夏为天南星科多年生草本植物,是我国传统重要中药材之一。具有燥热化痰、降逆止呕等功效[1]。最新研究发现,半夏对于抗生育、降血脂以及冠心病的治疗等均具有一定的疗效[2-3]。由于近年来对野生半夏的掠夺性挖采以及环境因素的变化,致使其自然资源锐减,市场供需矛盾突出。人工种植是解决半夏市场需求的主要途径,但长期采用块茎繁殖导致病害严重[4]、种质退化[5-7]、产量下降[8-9]等一系列问题。利用组织培养的方法培育半夏种苗、获取无病毒植株、筛选优良种质等已有不少研究[10-13]。同时,半夏人工种子技术已成为近年来研究的热点[14-19],但半夏人工种子生产中人工种胚同步化及其分散的关键技术至今依然未能突破,其根本原因在于半夏疏松愈伤组织诱导较难,以至难以通过悬浮培养获得单细胞或微细胞团,故不能实现人工种胚的同步化,更谈不上人工种子的产业化。本研究通过对植物生长调节物质的种类、浓度及培养条件的筛选,建立了易于分散、增殖快速的半夏疏松愈伤组织培养体系,为获得均一分散、高度同步化的半夏人工种胚提供优质材料,从而为实现半夏人工种子规模化生产提供了可靠的技术保障,为半夏药材产业化发展奠定了良好的基础。
1材料与方法
1.1实验材料
半夏Pinelliaternate(Thunb.) Breit.由贵州省赫章县半夏药材基地提供。
1.2研究方法
外植体处理:将半夏块茎去皮后流水冲洗2 h,经75%的酒精消毒45 s,无菌水冲洗3~5次,再用0.1%升汞消毒8 min,无菌水冲洗3~5次,无菌滤纸吸干表面水分,接种于添加6-BA 1.0 mg/L和IBA 0.1 mg/L的MS培养基上诱导无菌苗。选择苗龄15 d的健壮幼苗,分别切取叶片(0.5 cm × 0.5 cm)、叶柄顶端或叶柄基部(0.5 cm)作为外植体,备用。
愈伤组织诱导:分别以叶片、叶柄顶端或叶柄基部作为外植体,接种于添加不同种类及浓度的植物生长调节物质的MS培养基上(表1)。其中,DB代表2,4-D与6-BA组合,NB代表NAA和6-BA组合。每个处理接种5瓶,每瓶接种3个外植体,重复3次。定期统计愈伤组织诱导率及鲜重,同时考查愈伤组织的质地。同时,接种后每隔3 d随机抽5瓶称量愈伤组织鲜重,以时间为横坐标、愈伤组织鲜重为纵坐标,制作愈伤组织生长曲线。
愈伤组织增殖:选取初代培养中相对疏松的愈伤组织进行继代增殖培养。以诱导培养基为基础,调整2,4-D和6-BA两因素水平(表2),共6个处理,每个处理5瓶,每瓶接种1 g愈伤组织,重复3次,30 d后称量愈伤组织鲜重。
培养条件:培养基pH 5.8,培养温度为(25±1)℃,光照强度1500~2000 lx,光照时间12 h/d。
数据处理:运用DPS v 7.05和SPSS 20.0对实验结果进行统计学分析。
2结果与分析
2.1植物生长调节物质对半夏愈伤组织诱导的影响
不同植物生长调节物质对半夏愈伤组织的诱导率影响不大,但对愈伤组织鲜重及质地却有显著影响(表1和图1)。外植体接种7 d后,开始出现灰白色愈伤组织,继续培养,观察到DB组合诱导的愈伤组织逐渐转为黄色或淡黄色,质地较为疏松,无明显分化现象;而NB组合诱导的愈伤组织逐渐转为淡绿色进而变为绿色,质地紧密,并出现分化现象。DB组合诱导的愈伤组织增殖速率稍慢于NB组合,但其所诱导的愈伤组织疏松程度均高于NB组合,且较适合于后续继代培养,故DB组合诱导产生的疏松愈伤组织可作为悬浮培养获得同步化高质量人工种胚的材料;而NB组合所诱导的愈伤组织质地紧密、呈绿色,更适于分化形成无菌苗。从表1可以看出,DB组合中的处理4和处理7的愈伤组织鲜重分别达到0.622 g和0.932 g,明显高于其余处理。就诱导率而言,DB组合除叶柄基部外,其余均达到100%;从形成愈伤组织的量上看,叶柄顶端最差(图1 A~C),叶柄基部较好(图1 D~F),叶片形成愈伤组织最多(图1 G~I),极差分析(表1)也证明了这一结果。在NB组合中,叶柄顶端形成愈伤组织有根的分化(图1 J),叶柄基部和叶片形成的愈伤组织有芽的分化(图1 K和图1 L),且三者均形成质地紧密的愈伤组织。
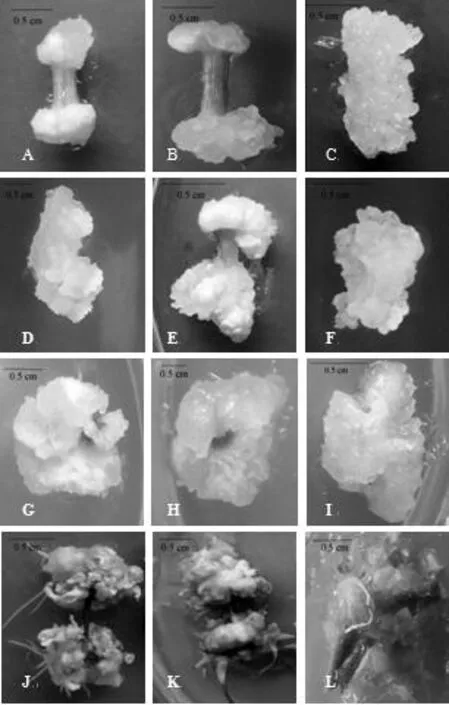
A~C: 叶柄顶端形成的愈伤组织(A: 2,4-D 1.0 mg/L + 6-BA 0.5 mg/L; B: 2,4-D 1.5 mg/L +6-BA 1.0 mg/L; C: 2,4-D 2.0 mg/L + 6-BA 1.5 mg/L; ); D~F: 叶柄基部形成的愈伤组织(D: 2,4-D 1.0 mg/L + 6-BA 1.0 mg/L; E: 2,4-D 1.5 mg/L + 6-BA 1.5 mg/L;F: 2,4-D 2.0 mg/L + 6-BA 0.5 mg/L; );G~I: 叶片形成的愈伤组织(G: 2,4-D 1.0 mg/L + 6-BA 1.5 mg/L; H: 2,4-D 1.5 mg/L + 6-BA 0.5 mg/L; I: 2,4-D 2.0 mg/L + 6-BA 1.5 mg/L;);J~L: NB组合处理(J:叶柄顶端形成的愈伤组织;K:叶柄基部形成的愈伤组织;L:叶片形成的愈伤组织)。基本培养基均为MS+ 蔗糖 30 g/L + 琼脂 6 g/L.
图1不同生长调节物质对愈伤组织诱导的效果
Fig.1Induction effects of different plant
growth regulators oncallus
2.2愈伤组织继代培养时间的确定
以生长健壮、幼嫩的半夏叶片作外植体,切成0.5 cm × 0.5 cm的小块接种于MS + 2,4-D 1.0 mg/L + 6-BA 1.5 mg/L + 蔗糖30 g/L + 琼脂6 g/L培养基上,定期观测愈伤组织的诱导和生长情况。从图2可以看出,半夏叶片愈伤组织鲜重的增长表现出慢-快-慢的变化,呈S型曲线。前18 d愈伤组织鲜重增长缓慢,第18~36 d时增长快速,36 d后增长逐渐减慢。由于第27~30 d时愈伤组织增殖最快、疏松程度最高,故此阶段为愈伤组织继代培养的最佳时间。
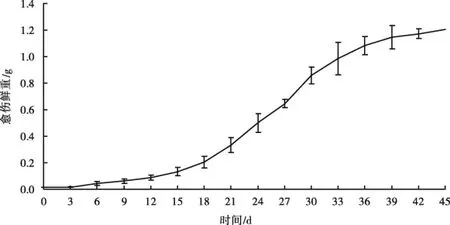
图2 半夏愈伤组织初代培养生长曲线Fig.2 Growth curve of callus primary culture
2.3半夏疏松愈伤组织增殖的条件及悬浮培养取材时间的确定
不同植物生长调节物质对半夏愈伤组织的增殖率、分化程度及质地均有不同程度的影响。从表2可以看出,处理4增殖率(以鲜重表示)极显著高于处理1、2、3、5,呈黄色疏松状;处理6次之,呈淡黄色疏松状。随着继代次数的增加,处理4愈伤组织逐渐表现出分化现象,而处理6愈伤组织的疏松程度逐渐增大。处理6愈伤组织连续继代3次后变为增殖极快、颜色淡黄、光泽度好、质地十分疏松的团块,易于分散为几个细胞聚集的小颗粒,这是作为悬浮培养获得同步化高质量人工种胚的好材料。
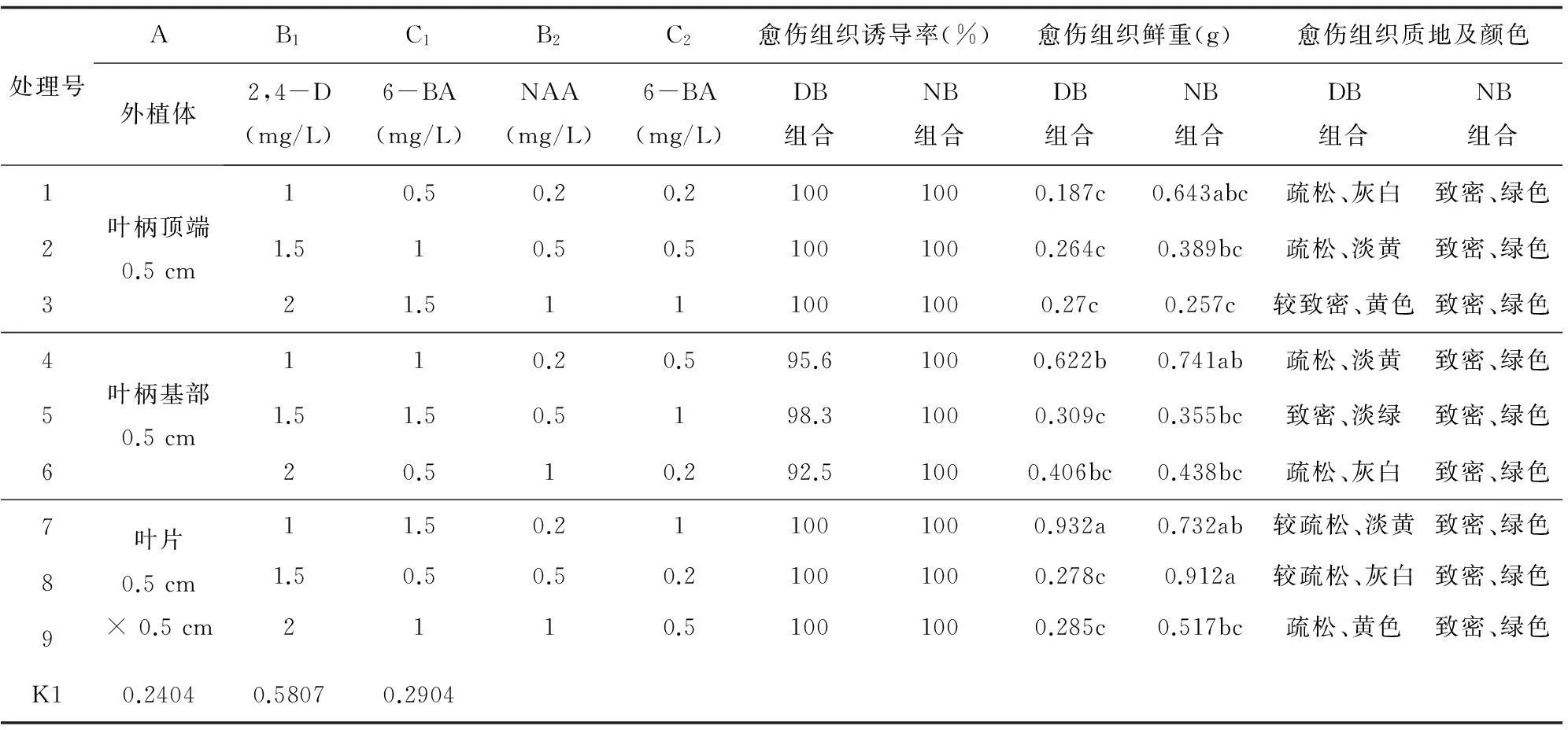
表1 植物生长调节物质对半夏愈伤组织诱导的影响
续表1
处理号AB1C1B2C2愈伤组织诱导率(%)愈伤组织鲜重(g)愈伤组织质地及颜色外植体2,4-D(mg/L)6-BA(mg/L)NAA(mg/L)6-BA(mg/L)DB组合NB组合DB组合NB组合DB组合NB组合K20.44570.28380.3903K30.49840.32010.5038R0.2580.29690.2133
注:表中不同小写字母表示有显著差异(P<0.05)。
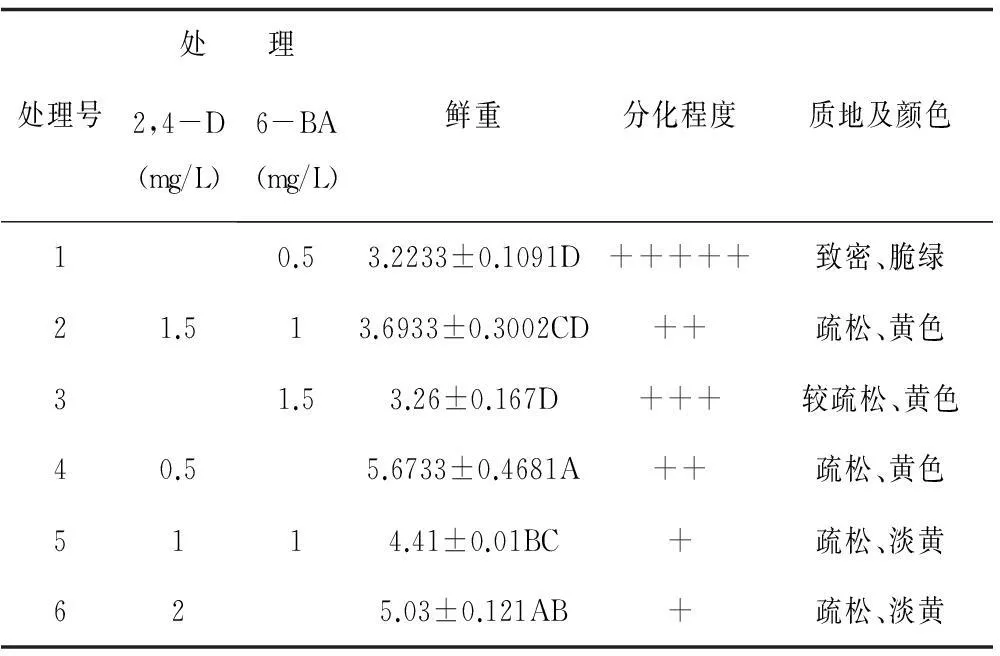
表2 不同植物生长调节物质对半夏愈伤组织增殖的影响
注:表中不同大写字母表示差异极显著(P<0.01);“+”号数目表明愈伤组织分化程度。
3结论与讨论
人工种子技术的出现为半夏规模化生产和种质提纯复壮带来了希望,而人工种胚同步化培养是该项技术的核心,也是关系到人工种子规模化生产能否实现的关键环节。但迄今为止,半夏人工种胚同步化技术问题仍未能解决,原因在于半夏愈伤组织质地较为致密,很难通过液体悬浮培养得以均一分散,致使愈伤组织分化产生的小块茎(人工种胚)紧紧连接在一起,制作人工种子时须通过手工剥离而难以实现自动化高效生产。
本研究以半夏叶片或叶柄作外植体诱导产生愈伤组织,再通过调节培养基的生长调节物质配比及筛选愈伤组织继代的适宜时期以获得易于分散的疏松愈伤组织,最后在对疏松愈伤组织增殖速率和均一分散程度考查的基础上确定悬浮培养的取材时间,从而为成功建立半夏同步化高质量人工种胚培养技术必不可少的悬浮细胞系提供了保障,为实现半夏人工种子产业化奠定了技术基础。
参考文献
[1]国家药典委员会. 中华人民共和国药典(2015年版一部)[M]. 北京: 化学工业出版社, 2015.
[2]Zhang X T, Cai Y J, Wang L J,etal. Optimization of processing technology of RhizomaPinelliaPraeparatum and its anti-tumor effect[J].AfricanHealthSciences, 2015, 15(1): 101-106.
[3]Yu H L, Zhao T F, Wu H,etal.Pinelliaternatalectin exerts a pro-inflammatory effect on macrophages by inducing the release of pro-inflammatory cytokines, the activation of the nuclear factor-κB signaling pathway and the overproduction of reactive oxygen species[J].InternationalJournalofMolecularMedicine, 2015, 36(4): 1127-1135.
[4]Hu X F, Fang Q L, Li S X,etal. Isolation and characterization of endophytic and rhizosphere bacterial antagonists of soft rot pathogen fromPinelliaternata[J].FEMSMicrobiologyLetters, 2009, 295(1): 10-16.
[5]马小军, 李西文, 杜鹃, 等. 加权打分法定量评价半夏种质资源的研究[J].中国中药杂志, 2006, 31(12): 975-977.
[6]章艳玲, 李关荣, 位运粮. 中药半夏的研究进展[J]. 中国农学通报, 2007, 23(7):163-167.
[7]杨旻, 陈科力. 半夏种质资源遗传多样性的SPAP分析[J]. 中国中药杂志, 2011, 36(3): 334-337.
[8]郑永敏. 半夏产量的影响因素[J]. 现代农业科学, 2008, 15(3):17-18.
[9]李花, 张明生, 彭斯文, 等. 半夏不同种植模式的经济效益分析[J]. 世界科学技术——中医药现代化, 2009, 11(4): 566-569.
[10]毛子成, 彭正松. 半夏快速繁殖体系的研究进展[J]. 中国中药杂志, 2003, 28(3): 193-195.
[11]陈亮, 许鸿源, 周凤钰, 等. 不同NAA和N6-BA浓度配比对半夏组织培养的生物效应[J]. 种子, 2008, 27(8):30-33.
[12]彭向前, 张文会. 半夏的分生组织培养与快速繁殖技术研究[J]. 井冈山大学学报, 2011, 32(2): 42-49.
[13]陶米林, 刘清波, 黄红梅. 半夏组织培养体系的建立[J]. 北方园艺, 2013(4): 113-117.
[14]何奕昆, 朱长甫, 何孟元, 等. 半夏小块茎的形态发生及人工种子制作[J]. 作物学报, 1997, 23(4): 482-487.
[15]薛建平, 张爱民, 盛玮, 等. 半夏人工种子贮藏技术的研究[J]. 中国中药杂志, 2005, 30(33): 1820-1823.
[16]张明生, 李花. 半夏人工种子制作技术及其萌发研究[J]. 种子, 2009, 28(11): 4-6,10.
[17]程力辉, 漆燕玲, 李玉萍. 半夏人工种子种皮基质配比对萌发率的影响[J]. 安徽农业科学, 2009, 37(14): 6433-6434, 6482.
[18]王宏霞, 蔡子平, 漆燕玲, 等. 不同包埋基质对半夏人工种子萌发率的影响[J]. 中国种业, 2011(6):59-60.
[19]申起飞, 张明生, 李立青, 等. 生长调节物质对半夏人工种胚形成的影响[J]. 山地农业生物学报, 2014, 33(3): 33-36.
Induction andmultiplication of loose callus ofPinelliaternata[Alismatales: Araceae} suitable for suspension culture
LIUGui-xian,ZHANGMing-sheng*,LIXiao-lan,HUShan-shan,WEIHong-bian,GAOXiao-feng
(CollegeofLifeSciencesGuizhouUniversity,Guiyang,Guizhou550025,China;KeyLaboratoryofPlantResourcesConservationandGermplasmInnovationinMountainousRegion(MinistryofEducation),Guiyang,Guizhou550025,China)
Abstract:Using Pinellia ternata leaf or petiole as explants to obtain loose callus suitable for suspension culture by adjusting the concentrations of different plant growth regulators and the culture conditions. The results showed that the callus was looser in the media containing 2,4-D than that containing NAA. The induced callus grew better and looser when leaves were inoculated on the medium made of MS + 2,4-D 1.0 mg/L + 6-BA 1.5 mg/L + sucrose 30 g/L + agar 6 g/L, or petioles were inoculated on the medium consisted of MS + 2,4-D 1.0 mg/L + 6-BA 1.0 mg/L + sucrose 30 g/L-1+ agar 6 g/L. The induction rates were 100% and 95.6%, respectively, and the callus fresh weights were 0.932 g and 0.622 g, respectively. After these calluses were continuously cultured three more times in the medium of MS + 2,4-D 2.0 mg/L + 6-BA 1.0 mg/L + sucrose 30 g/L + agar 6 g/L, the loose calluses were suitable for establishing cell suspension culture system. These loose calluses become the reliable materials for the necessary synchronization of artificial seeds for high quality production of artificial embryo culture of Pinellia ternata.
Key words:Pinellia ternata; callus; suspension culture; plant growth regulator
文章编号:1008-0457(2016)01-0082-04国际DOI编码:15958/j.cnki.sdnyswxb.2016.01.018
中图分类号:Q945.5
文献标识码:A
*通讯作者:张明生,博士,教授,博士生导师,主要研究方向:植物生理生化与生物技术研究;E-mail: mszhang@guz.edu.cn。
基金项目:贵州省高层次创新型人才培养计划(黔科合人才[2015]4031号);贵州省中药现代化科技产业研究开发专项项目(黔科合中药字[2011]5065号)。
收稿日期:2015-12-12;修回日期:2016-01-25
