水杨酸对打顶后烟草根系钾吸收的调控作用研究
2016-05-26赵杰宏母应春
杨 亚,赵杰宏,姜 骁,母应春,苏 伟*
(1.贵州大学 生命科学学院,贵州 贵阳 550025;2.贵州省烟草科学研究院烟草行业分子遗传重点实验室,贵州 贵阳 550081)
水杨酸对打顶后烟草根系钾吸收的调控作用研究
杨亚1,赵杰宏2,姜骁1,母应春1,苏伟1*
(1.贵州大学 生命科学学院,贵州 贵阳 550025;2.贵州省烟草科学研究院烟草行业分子遗传重点实验室,贵州 贵阳 550081)
摘要:为探索打顶后烟草根系钾素的分配和转移规律,试验研究了打顶及施用不同浓度水杨酸对根系钾吸收及钾运输相关基因表达水平的影响。结果发现,打顶减少烟草根系对钾的吸收,而打顶同时施加水杨酸会影响根系吸收钾,其中5 μmol/L的水杨酸能提高打顶后根系钾吸收,而施加较高浓度水杨酸则效果相反。另外,各处理前后根中钾运输基因“NTORK1/HAK1”表达比值差异和根系钾吸收能力差异基本一致,可能受水杨酸的调控,可用作打顶后烟草钾素的分配和转移的间接评价指标。
关键词:烟草;钾;打顶;水杨酸
引言
水杨酸(salicylic acid,SA),即邻羟基苯甲酸,是植物体内广泛存在的小分子酚类化合物。水杨酸可提高植物对胁迫的抗性,如能够诱导烟草抵抗野火病[1],在弱光[2]、低温[3]、金属Cu[4]等胁迫下也发挥显著作用。在拟南芥中,水杨酸能抑制盐胁迫导致的钾外流[5]。钾作为植物最重要的大量元素之一,是60多种酶的活化剂,参与植物体内渗透压的维持、同化产物的运输,同时还促进光合作用[6-7]。钾可提高烟叶燃烧性、减少烟气中总粒相物和焦油含量[8-9]。钾在根部的分配和转移是由钾离子通道和载体介导,拟南芥中几个钾通道基因已被鉴定,其中AKT1与AtKC1一起参与根毛钾的吸收[10-12]。烟草钾通道基因NKT1、NtKC1和钾吸收转运体NtHAK1也已被克隆,而NTORK1则是烟草主要的钾外流通道基因[13-14]。打顶是烟叶生产中一项重要的农艺措施,可以减少营养消耗,促进上部叶生长,提高烟叶产量和质量。但打顶会导致烟株钾流失[15],因而,减少打顶等造成烟株钾离子的重分配和流失一直是人们关注的焦点。通过施加能调节根系钾吸收的植物生长调节剂,并研究其机理,将为改善烟株养分利用、提高烟株钾含量提供依据。
对于快递包装回收,国家有关部门制定了一个时间表。2017年,国家十部门联合发布的《关于协同推进快递业绿色包装工作的指导意见》明确,到2020年,可降解的绿色包装材料应用比例将提高到50%,基本淘汰重金属等特殊物质超标的包装物料,基本建成专门的快递包装物回收体系。主要快递品牌协议客户电子运单使用率达到90%以上,平均每件快递包装耗材减少10%以上,推广使用中转箱、笼车等设备,编织袋和胶带使用量进一步减少。基本建立快递业包装治理体系。2019年1月1日实施的《电商法》中第五十二条规定,快递物流服务提供者应当按照规定使用环保包装材料,实现包装材料的减量化和再利用。
1材料与方法
1.1材料、试剂和培养液
烟草品种为 K326(Nicotianatabacumcv. K326);水杨酸(SA)购自Sigma。植物总RNA提取试剂盒购自天根;PrimeScriptTMⅡ1st Strand cDNA反转录试剂盒、SYBR Premix DimerEraserTM均购自Takara。
Hoagland基础营养液:1.2 mmol/L KNO3;0.8 mmol/L Ca(NO3)2;0.2 mmol/L NH4H2PO4;0.2 mmol/L MgSO4;50 μmol/L KCl;12.5 μmol/L H3BO3;1 μmol/L MnSO4;1 μmol/L ZnSO4;0.5 μmol/L CuSO4;10 μmol/L Fe-EDTA;0.1 μmol/L H2MoO4。
建筑信息模型是一切BIM工作的源泉,数据和信息是一切施工管理工作的基础,有“模型”才有数据和信息(见图2~图7)。
1.3总RNA提取及反转录
1.2烟草水培及水杨酸处理
由图1可见,烟草打顶后,钾离子的浓度在30 min时达到一个峰值,随后随时间的增加而逐渐下降,但打顶处理后培养液的钾离子浓度始终高于不打顶处理的浓度。不同浓度SA对根系钾有不同的效果。打顶加50 μmol/L SA处理的培养液钾离子浓度高于打顶处理(除了30 min),且随着时间变化先降低后升高,在3 d左右达到一个峰值;对于打顶加10 μmol/L SA和打顶加5 μmol/L SA处理,培养液中钾离子浓度随时间增加而逐渐降低,但打顶加10 μmol/L SA处理的钾离子浓度高于打顶处理的浓度(除30 min外),而打顶加5 μmol/L SA处理的钾离子浓度在30 min以后一直处于打顶和不打顶处理之间。这表明,打顶会降低烟草根系钾吸收,低浓度SA(5 μmol/L )处理能够促进打顶后根系对钾的吸收,而较高浓度的SA(50 μmol/L )效果相反,甚至导致钾流失。
Hoagland低钾营养液:在基础营养液中,分别用0.6 mmol/L Ca(NO3)2和50 μmol/L CaCl2替换1.2 mmol/L KNO3和50 μmol/L KCl。钾浓度用KCl调节。
2.3NTORK1/HAK1表达与根系钾吸收的相关分析
(2)评价内容多维化。职业标准的项目比重表包括理论知识和技能两个方面。比重表反映了各项工作内容在培训考核中所占的比例。国际商法课程考核应基于职业标准的项目权重,对学生的理论知识、技能操作、基本素质和外语水平进行全面考核。如,根据《报关员国家职业标准(试行)》,理论知识和技能操作各占50%。在100分的理论知识中,职业道德和基础知识占15%,报关英语占5%,其他专业知识占80%。由于职业标准是考虑职业需要,而非考虑高等院校的不同特点而制定,鉴于高职教育的特殊性,在实际课程考核评价中,技能操作所占的比重还可以大大提高。
对钾运输基因NTORK1(AB196792)、HAK1(DQ841950)和NtKC1(AB196791)进行实时荧光定量分析,定量PCR引物见表1。以烟草β2-ACTIN(AB158612)为内参基因。以cDNA为模板,按照SYBR Premix DimerEraserTM(Toyobo,Japan)说明书操作,在ABI Stepone Plus(Applied Bio-systems,美国)上进行反应。PCR体系为:10 μL SYBR Premix DimerEraserTM,0.4 μL ROX Reference Dye,2 μL cDNA(<100 ng),10 μmol/L上下游引物各0.6 μL,ddH2O补足20 μL。反应程序为 95℃ 60 s;40个循环(95℃ 5 s,60℃ 30 s,72℃ 30 s)。反应结束后分析荧光值变化曲线和融解曲线。设样本和内参各3个重复,采用ΔΔCt相对定量法分析数据,即目的基因相对表达量=2-ΔΔCt。
其中,ΔΔCt=(实验组ΔCt)-(对照组ΔCt),实验组ΔCt=(实验组目的基因Ct)-(实验组内参基因Ct),对照组ΔCt=(对照组目的基因Ct)-(对照组内参基因Ct),2-ΔΔCt表示的是实验组目的基因的表达相对于对照组的变化倍数。

表1 实时荧光定量PCR引物
2结果与分析
2.1水杨酸对打顶后烟草根外钾离子的影响
分别对30 min、3 h和3 d时不打顶、打顶加5 μmol/L SA和打顶三种处理烟草的根和叶进行取样,并提取RNA反转录成cDNA进行实时荧光定量PCR分析。由图2可知,PCR产物电泳为单带且位置大小正确,HAK1、NtKC1和NTORK1三个基因的熔解曲线都为单峰曲线,实验条件符合定量PCR需要(图2A和2B)。
烟草种子播种于盛有烟草专用育苗基质和蛭石(5∶2)混合的漂浮盘中,生长至5片真叶时,选取生长均匀一致的烟苗在自来水中轻缓洗净根部,然后移入10升装有1/4 Hoagland基础营养液的培养盆中连续通气培养,每3 d更换1次营养液。待烟苗缓苗后选取烟叶正常生长且均匀一致的烟苗移至内径为7.5 cm,高为7 cm的塑料杯中,每杯1株,用Hoagland低钾营养液通气水培,供钾水平为0.1 mmol/L。烟苗长至六叶一心时,在低钾水培条件下,设置如下5个处理:不打顶,打顶,打顶加5 μmol/L SA,打顶加10 μmol/L SA,打顶加50 μmol/L SA。其中SA均加入低钾营养液中,打顶为去掉顶部一叶一心。并在0 min,10 min,20 min,30 min,1 h,3 h,7 h,1 d,3 d,5 d时间段取出培养液,用火焰光度法检测培养液中的钾含量。试验重复3次。

图1 不同处理下培养液钾离子浓度的变化
2.2打顶对钾运输基因表达的影响
乌江风情廊道是乌江流域旅游资源聚集区,具有资源禀赋品级高、质量优、分布广、密度大等特点,具有良好的利用开发条件,有利于文化旅游产业集群化发展。
1.4钾通道基因表达水平分析
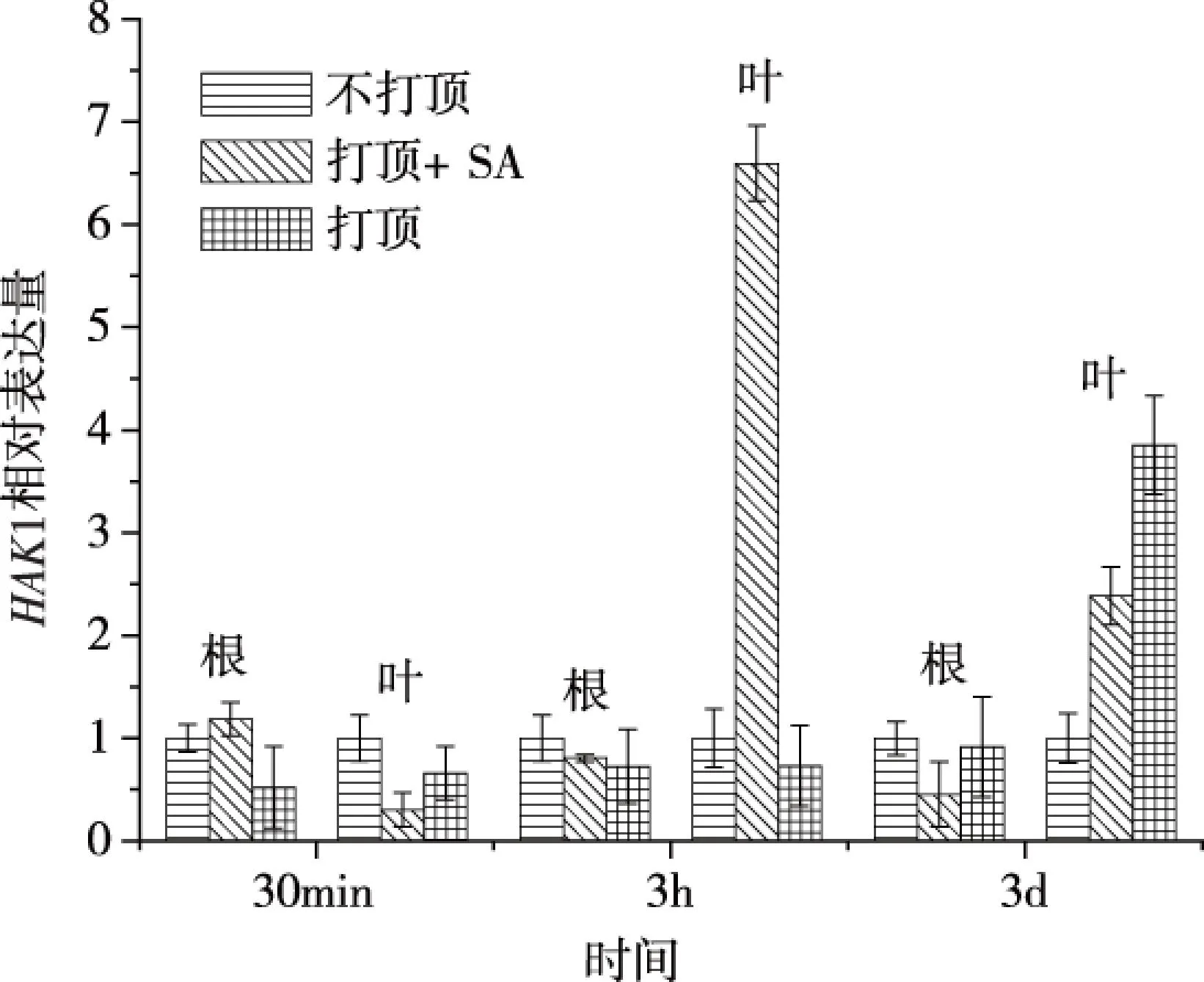
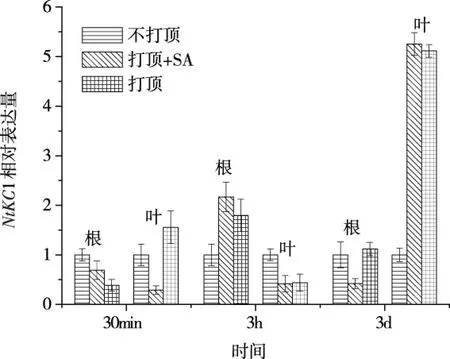
以不打顶作为对照,比较HAK1、NTORK1和NtKC1的相对表达水平(图3A、B和C)。由图3可知,HAK1在叶中表达比较高,且打顶加SA在3 h表达最高,但HAK1在根中的变化平稳;NTORK1在3 h表达量相对比较高;NtKC1在根和叶的表达量分别在3 h和3 d相对较高。但作为根系主要的吸钾基因(HAK1)和排钾基因(NTORK1),其表达随时间变化趋势如何关联根系钾吸收变化,仍需进一步研究。

图2 各钾运输基因定量条件
(A)

(B)
(C)
对各处理烟株的根和叶分别进行取样,在液氮中速冻后,采用天根总RNA提取试剂盒方法提取烟草总RNA,然后以Oligo(dT)为引物,按照宝生物cDNA合成试剂盒的操作说明合成cDNA第1链。
3) 0—2状态转换。能造成该转换的情况有一种:2个通道中任意1个通道发生非共因失效下的FDU,其概率为
为了进一步了解打顶和SA处理后根系钾变化趋势与“NTORK1/HAK1”变化趋势的关系,分析了不同处理下根和叶中“NTORK1/HAK1”表达水平比值随时间的变化(图4)。根中打顶和打顶加5 μmol/L SA两种处理导致“NTORK1/HAK1”表达水平比值上升,与相应处理中根系钾吸收低于不打顶处理的结果一致,而烟叶中“NTORK1/HAK1”比值的变化趋势与根系相反。这说明,根系 “NTORK1/HAK1”的比值变化可以在一定程度上说明根系钾吸收的差异,但是低浓度SA在促进打顶后烟草根系对钾的吸收过程中,是调节了NTORK1还是HAK1并未清楚,还需进一步研究。
异步协作模式类似图1维基百科的“引用—改进”模式:设计师公开发布方案供其他人引用,同时可以引用任何公开发布的方案进行修改和提交新方案。考虑到产品设计的实际情况,该模式允许用户引用任何一款设计方案,而不一定是最新一轮方案。

(A)

(B)
3结论与讨论
烟草打顶后植株体内物质的变化近年来一直是研究热点。代晓燕等[16]报道打顶能够降低烟叶内IAA、ABA、GA3和ZR的含量,刺激根中IAA、ABA、GA3和ZR含量的增加。邹焱等[17]证明打顶对烟株中GA3、ABA和IAA含量均有较大的影响,能增加烟叶和根中GA3和ABA含量,而明显降低IAA含量。Fu等[18]表明打顶增加了烟草根部生长素的浓度。这表明打顶会引起烟株内源激素的变化,打破内源激素的平衡。郑宪滨等[15]研究表明打顶后烟草钾会重新分配和转移,钾会外排。减少打顶造成钾素的分配和转移是我们一直关注的重点。洪丽芳等[19]采用86Rb标记示踪原子法研究了烤烟打顶伤口添加NAA后烟草中钾元素的再循环再分配情况,结果表明打顶伤口涂抹NAA后有利于钾在叶片的积累,NAA参与钾运输的调控过程。陈迪文[20]研究表明打顶会导致烟叶中钾含量下降,喷施调节剂后有利于钾在烟叶中的累积,使烟叶的钾含量得到提升。Jayakannan等[5]发现在拟南芥中,SA能抑制钾通道GORK在盐胁迫下导致的钾外流。因此通过施加植物生长调节剂,并研究根外钾对改善烟叶质量有很大的理论和应用价值。本研究结果发现,打顶降低根系钾吸收,施加5 μmol/L SA能提高打顶后烟草根系对钾的吸收,而较高浓度的SA(10 μmol/L和50 μmol/L)效果相反。
激素对钾运输的调控作用一直受人们关注。Gaymard等[21]报道了SKOR的表达受脱落酸(ABA)的抑制。Becker等[22]研究表明脱落酸(ABA)诱导保卫细胞质膜去极化和GORK表达,GORK介导的钾离子流出也受诱导。Coskun等[23]指出在低钾浓度0.1 mmol/L下,钾是通过钾通道介导外流。Sano等[14]研究表明5.4 μmol/L NAA可使细胞分裂,且诱导NTORK1的表达。Armengaud等[24]提出钾缺乏时茉莉酸(JA)生物合成酶,脂氧合酶等酶的转录水平显著增加。Philippar等[25]表明生长素通过增加钾离子通道密度诱导了玉米ZMK1基因的表达。这些研究结果都表明生长素参与了钾离子缺乏响应以及钾离子摄取。在本实验中通过对钾运输基因NtKC1、HAK1和NTORK1实时定量分析,发现根系中“NTORK1/HAK1”比值与根对钾吸收能力的差异基本一致,这可推测SA可能是通过“NTORK1 和HAK1”的表达比来调节根系钾吸收,但是其他钾运输通道参与作用的方式和水平,以及SA在调节烟草根系钾吸收的过程中是调节了NTORK1还是HAK1并未清楚,还需进一步研究。
综上所述,本文研究了水杨酸对打顶后烟草根系钾吸收的调控作用,其结果表明,烟草打顶可降低烟草根系钾吸收,而打顶同时施加水杨酸可以改变根系吸收钾的能力。当施加SA浓度为5 μmol/L时,能够提高根系对钾的吸收,而较高浓度的SA(10 μmol/L和50 μmol/L)效果相反。在打顶加5 μmol/L SA和打顶两个处理中,HAK1和NTORK1基因的表达水平变化趋势基本一致,且在处理前后根和叶中钾运输基因“NTORK1/HAK1”比值的变化趋势和根系钾吸收的趋势基本一致,尤其是根系中“NTORK1/HAK1”的比值。这说明,打顶导致根系钾吸收减少,这个过程受SA的调控,并且可以由根系中“NTORK1/HAK1”的比值变化初步表征。
参 考 文 献:
[1]王振国,肖鹏,陈秋双,等. 水杨酸对烟草野火病的抑制效果及其对烟株的生物学效应[J]. 中国烟草学报,2013,19(5): 67-71.
[2]Hui Wang, Cuoshun Liu, Fei Yun,etal. Effects of Salicylic Acid on Photosynthesis and Chlorophyll Flourescence Characteristic of Fluecured Tobacco Leaf in Subdued Light[J]. Agricultural Science & Technology, 2014, 15(1): 33-38.
[3]邓世媛,陈建军,罗福命,等. 外源水杨酸对低温胁迫下烤烟抗氧化代谢的影响[J]. 烟草科技, 2012(2): 71-74.
[4]徐根娣,葛淑芳,章艺,等. 外源水杨酸对Cu胁迫下水培烟草生长及营养元素吸收利用的影响[J]. 作物学报,2015,41(6): 956-962.
[5]Jayakannan M, Bose J, Babourina O,etal. Salicylic acid improves salinity tolerance in Arabidopsis by restoring membrane potential and preventing salt-induced K+loss via a GORK channel[J].JournalofExperimentalBotany, 2013, 64(8): 2255-2268.
[6]Véry A A, Sentenac H. Molecular mechanisms and regulation of K+transport in higher plants[J].AnnualReviewofPlantBiology, 2003, 54(1): 575-603.
[7]Xu J, Li H D, Chen L Q,etal. A protein kinase, interacting with two calcineurin B-like proteins, regulates K+transporter AKT1 in Arabidopsis[J].Cell, 2006, 125(7): 1347-1360.
[8]彭斌,金征宇,翁昔阳,等. 碳酸钾对卷烟主流烟气焦油、烟碱、游离烟碱、pH值及劲头的影响[J]. 烟草科技,2007(7): 8-10.
[9]许萍,宁敏,杨承华. 添加有机酸钾对卷烟焦油量等的影响[J]. 合肥工业大学学报(自然科学版),1999,22(3): 89-93.
[10]Hirsch R E, Lewis B D, Spalding E P,etal. A role for the AKT1 potassium channel in plant nutrition[J].Science, 1998, 280: 918-921.
[11]Pilot G, Gaymard F, Mouline K,etal. Regulated expression of Arabidopsis Shaker K+channel genes involved in K+uptake and distribution in the plant[J].PlantMolBiol, 2003(51): 773-787.
[12]Reintanz B, Szyroki A, Ivashikina N,etal. AtKC1, a silent Arabidopsis potassium channel alpha-subunit modulates root hair K+influx[J].Science, 2002(99): 4079-4084.
[13]鲁黎明,杨铁钊. K326烟草钾转运体基因NtHAK1的克隆及表达模式分析[J]. 核农学报,2011,25(3): 469-476.
[14]Sano T, Kutsuna N, Becker D,etal. Outward-rectifying K+channel activities regulate cell elongation and cell division of tobacco BY-2 cells[J].ThePlantJournal, 2009, 57(1): 55-64.
[15]郑宪滨,曹一平,张福锁,等. 不同供钾水平下烤烟体内钾的循环、累积和分配[J]. 植物营养与肥料学报,2000,6(2): 166-172.
[16]代晓燕,苏以荣,陈风雷,等. 顶端调控措施对烤烟生长、内源激素及氮钾累积的影响[J]. 植物生理科学,2008,24(8): 234-240.
[17]邹焱,苏以荣. 打顶及施用植物生长调节剂对烟草内源激素的影响[J]. 烟草科技,2008(10): 50-53.
[18]Fu Y P, Guo H X, Cheng Z P,etal. NtNAC-R1, a novel NAC transcription factor gene in tobacco roots, responds to mechanical damage of shoot meristem[J].PlantPhysiologyandBiochemistry, 2013(69): 74-81.
[19]洪丽芳,付利波,苏帆,等. 生长素对烟株中钾的分配和积累的影响[J]. 作物学报,2003,29(3): 457-461.
[20]陈迪文. 利用离子通道调节物质提升烟草钾含量的研究初探[D]. 湖北: 华中农业大学,2010.
[21]Gaymard F, Pilot G, Lacombe B,etal. Identification and disruption of a plant shaker-like outward channel involved in K+release into the xylem sap[J].Cell, 1998, 94(5): 647-655.
[22]Becker D, Hoth S, Achea P,etal. Regulation of the ABA-sensitive Arabidopsis potassium channel gene GORK in response to water stress[J].FEBSLetters, 2003, 554(1): 119-126.
[23]Coskun D, Britto D T, Kronzucker H J. Regulation and mechanism of potassium release from barley roots: an in planta42K+analysis[J].NewPhytologist, 2010, 188(4): 1028-1038.
[24]Armengaud P, Breitling R, Amtmann A. The potassium-dependent transcriptome of Arabidopsis reveals a prominent role of jasmonic acid in nutrient signaling[J].PlantPhysiology, 2004, 136(1): 2556-2576.
[25]Philippar K, Büchsenschütz K, Edwards D,etal. The auxin-induced K+channel geneZmk1 in maize functions in coleoptile growth and is required for embryo development[J].PlantMolecularBiology, 2006, 61(4): 757-768.
The effect of salicylic acid regulation after topping on potassium absorption by tobacco roots
YANGYa1,ZHAOJie-hong2,JIANGXiao1,MUYing-chun1,SUWei1*
(1.CollegeofLifeScience,GuizhouUniversity,Guiyang,Guizhou550025,China; 2.KeyLaboratoryofMolecularGeneticsofCNTC,GuizhouAcademyofTobaccoScience,Guiyang,Guizhou550081,China)
Abstract:In order to understand the potassiumdistribution and transfer in tobacco roots after topping, the effect of topping alone and toppingtogether withdifferent concentrations of salicylic acid regulation on expression of the genes related to potassium absorption and transfer by tobacco roots was studied. Topping alone of tobacco decreased the potassium absorption in root, while topping together with applying salicylic acid could affect the trend of potassium absorption in roots.Application of 5 μmol/L of salicylic acid increased potassium absorption.However, higher concentrations of salicylic acid resulted in the opposite effects, i.e. reducing the potassium absorption. In addition, there was similarity between the ratio of the genes "NTORK1/HAK1" and the difference of ability of potassium absorption in tobacco roots, indicating that the expression of NTORK and HAK1 may be regulated by salicylic acid,which can be used as an indirect index for potassiumdistribution and transfer in root after topping.
Keywords:Tobacco; Potassium; Topping; Salicylic acid
文章编号:1008-0457(2016)01-0045-06国际DOI编码:15958/j.cnki.sdnyswxb.2016.01.010
中图分类号:S572
文献标识码:A
通讯作者:苏伟(1974-),男,博士,副教授,主要研究方向:应用生物技术研究;E-mail:suwei1886@163.com。
基金项目:中国烟草总公司科技重大专项项目(110201401007(JY-07));贵州省农业攻关科技计划(黔科合NY[2013]3020号);贵州省科技厅农业攻关项目(黔科合NY[2013]3052号)。
收稿日期:2016-01-06;修回日期:2016-02-08
