金钗石斛花芽蛋白质提取及其双向电泳体系优化
2016-05-25尹丽梅叶庆生
叶 婕, 尹丽梅, 叶庆生
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广州 510631)
金钗石斛花芽蛋白质提取及其双向电泳体系优化
叶婕, 尹丽梅, 叶庆生*
(华南师范大学生命科学学院,广东省植物发育生物工程重点实验室,广州 510631)
摘要:通过对蛋白质提取方法、水化方式、等点聚焦程序、IPG胶条选择等方面的优化,建立金钗石斛花芽蛋白质双向电泳体系.结果表明,采用酚抽提法提取蛋白,样品与水化液1∶40复溶;被动水化,等点聚焦程序B2;选用24 cm pH 3~10NL 胶条和12% 的凝胶;采用考马斯亮蓝G-250染色,获得了可识别1 422个蛋白质斑点的双向电泳图谱,且重复性好、分辨率高,为进一步开展金钗石斛花芽在蛋白质组学水平上的分析提供了技术支持.
关键词:石斛; 花芽; 蛋白质组学; 双向电泳
金钗石斛(Dendrobiumnobile)为石斛属多年生附生草本植物,是观赏花卉,也是软茎类(nobile type)观赏春石斛最重要的育种亲本[1]以及研究春石斛的模式植物,还是名贵的药用植物,具有滋阴清热、生津益胃、润肺止咳和明目强身等功效.关于金钗石斛的研究多集中在其生理、快繁和药理方面[2-4].庄军平等[5]构建了金钗石斛花芽cDNA表达文库,闻真珍等[6]初步揭示细胞分裂素对其开花的影响及分子机理,为研究金钗石斛的开花机理奠定了基础.
蛋白质组学技术是从整体上研究生物细胞或组织内全部蛋白质的组成和相互作用规律的一门技术.双向凝胶电泳技术(Two-dimensional electrophoresis, 2-DE)已被广泛应用于蛋白质组学研究中. 通过蛋白质组学的方法比较分析不同条件下不同植物材料花芽蛋白表达[7-10],寻找与成花相关的蛋白,结合生理形态等方面,对研究植物成花机理具有重要的理论意义. 目前国内对于石斛双向电泳的研究报道较少,董婧等[7]构建了石斛叶片蛋白质双向电泳体系,对样品制备、上样量、PAGE胶浓度、染色方法进行了优化,最终得到的蛋白斑点数约为613个.有关文献表明,目前葡萄果实[8]能鉴定到445个蛋白,早酥梨花芽[9]鉴定到约900个蛋白点,水稻谷粒[10]中鉴定到1 100多个蛋白点. 得到了与特定生理过程相关的蛋白,但得到的蛋白点都偏少.目前尚未有金钗石斛花芽的蛋白质组学报道.本研究旨对金钗石斛花芽蛋白质的提取、水化方式、等点聚焦程序、IPG胶条选择等方面进行优化探索,为深入研究金钗石斛花芽蛋白质组学奠定基础.
1材料与方法
1.1植物材料
金钗石斛(Dendrobiumnobile),选取华南师范大学国兰研究中心栽培2年的健壮、无病虫害的金钗石斛成熟苗.在花芽长度为2 cm时取材,样品液氮速冻后放入-80 ℃冰箱保存备用.
1.2蛋白提取采用2种方法
1.2.1Tris-HCl缓冲液提取法对DAFNY-YELIN等[11]的方法改良,采用Tris-HCl缓冲液[0.1 mol/L Tris-HCl(pH 8.0),质量分数为5%蔗糖和2%十二烷基硫酸钠(SDS),体积分数为5%β-巯基乙醇(β-ME)]提取,离心速度为18 000 r/min.
1.2.2酚抽提法在CARPENTIER等[12]方法的基础上进行改良.取1.2 g 金钗石斛花芽在液氮中研磨成粉,加酚抽提液(0.7 mol/L蔗糖,0.1 mmol/L KCl,50 mmol/L EDTA,0.5 mol/L Tris-base,30 mmol/L HCl,用前加2%β-ME)和Tris-饱和酚,4 ℃下21 956 r/min离心30 min,取上层酚相;下层水相加水-饱和酚,4 ℃下21 956 r/min离心30 min,再取上层酚相.合并2次酚相加预冷的0.1 mol/L 醋酸铵/甲醇,并在-20 ℃放置过夜.取过夜混合液4 ℃下27 316 r/min离心30 min,弃上清;沉淀加冷丙酮(含0.07%β-ME)洗涤,-20 ℃下放置30 min,4 ℃下25 464 r/min离心30 min,弃上清;沉淀加 80% 冷丙酮(含0.07%β-ME)洗涤,-20 ℃下放置30 min,4 ℃下25 464 r/min离心30 min,弃上清液.沉淀转移至 1.5 mL离心管内,冷丙酮(含0.07%β-ME)洗涤2次,真空抽滤,-80 ℃保存备用.
1.3蛋白水化方式
Tris-HCl缓冲液提取法得到的干粉,按照1∶30比例加入水化液[8 mol/L尿素,2 mol/L硫脲,质量分数为4% 3-(3-(胱酞胺基丙基)二甲氨基)丙磺酸盐(CHAPS)和1%二硫苏糖醇(DTT),0.5%,1 mmol/L苯甲基磺酰氟PMSF].其中DTT和胶条缓冲液PMSF在使用前加入,IPG buffer在胶条水化时加入.以上含干粉的水化液在30 ℃水浴1 h,4 ℃下16 100 r/min离心40 min.酚抽提法得到的干粉,按照1∶40比例加入水化液,30 ℃水浴1 h,4 ℃下16 100 r/min离心40 min.蛋白定量使用BRADFORD法[13]. 目前蛋白的双向电泳过程中的水化方式主要有2种.
1.3.1主动水化胶条两端加上比较低的电压,促进样品进胶,一般电压设置为50 V.
1.3.2被动水化胶条两端不加电压,一般在室温20 ℃左右均可选择被动水化.
1.4双向电泳
胶条(购自Bio-Rad(USA)公司)的选择分别从长度(7、17、24 cm)、pH范围、线性(linear, L)或非线性(nonlinear, NL)等方面进行考虑.pH 3~10胶条容易估计蛋白的等电点, pH 3~10NL胶条能得到pH在5~7之间较高的分辨率.4种不同的第一向等电聚焦[IEF,isoelectric focusing (GE, USA)]程序基本参照Bio-Rad (USA)提供的操作手册,对具体聚焦程序稍作改良(表1).IEF结束之后,均用水将胶条上附着的矿物油清洗干净,进行胶条平衡.在平衡缓冲液Ⅰ[6 mol/L尿素,50 mmol/L Tris-HCl (pH 8.8),质量分数为30%甘油、2%SDS,1% DTT]中平衡15 min后,在平衡缓冲液Ⅱ[6 mol/L尿素,50 mmol/L Tris-HCl (pH 8.8),质量分数为30%甘油、2%SDS,2.5%IAA]中平衡15 min.2步平衡后,取出胶条后进行第二向SDS-PAGE电泳[14].SDS-PAGE采用12%的分离胶.

表1 等电聚焦程序
注:*VH为等点聚焦S5阶段的设定单位,伏时
1.5凝胶固定染色与图谱分析
凝胶水洗2次,每次 15 min,水平摇床震荡;倒掉水后倒入固定液(甲醇40%、乙酸10%,水溶解混匀)固定2 h,水平摇床震荡;倒掉固定液,水洗凝胶2次,水平摇床震荡,每次15 min;倒掉水后倒入染色液(0.12%考马斯亮兰G-250,10%硫酸铵,10%正磷酸,20%甲醇)染色17 h,水平摇床震荡,然后用双蒸水清洗至背景为无色.脱色后的凝胶用Image Scanner Ⅲ图像扫描系统(GE Healthcare, USA)扫描.获得的图谱用PDquest 7.4(Bio-Rad,USA)进行图谱分析.
2结果与讨论
2.1蛋白质样品制备方法的选择及优化
图1表明,酚抽提法和改良的Tris-HCl缓冲液提取法获得的蛋白点数分别为125个和139个. 酚抽提法获得的蛋白得率较高、溶解性较好(表2);改良的Tris-HCl缓冲液提取液得到的样品干粉含较多杂质,呈灰色粉末状,溶解性较差.从双向电泳图谱来看,条纹的出现导致2-DE图谱分辨率降低,蛋白点检测难度增加[15],酚抽提法得到的图谱分辨率较高.因此,在后续的实验中均采用酚抽提法制备样品.

图1 2种方法提取所获金钗石斛花芽总蛋白的双向电泳图谱(7 cm,pH 3~10 NL胶条, a、b为局部放大图)
Figure 1Representative 2-DE protein maps of totalD.nobileflower bud proteins by two extraction methods (7 cm pH 3~10 NL gradient IPG strip); a and b are enlargements of the framed parts in A and B, respectively.
表22种提取方法效果
Table 2Comparison of 2-DE maps from two different extraction methods

项目改良的Tris-HCl缓冲液提取法酚抽提法样品干粉灰色粉末状白纸状蛋白得率/%0.4~0.51.0~2.0蛋白溶解性较差较好蛋白点质量有一定程度横纵纹较为规范,圆形或椭圆形图谱背景较深较浅条纹干扰略多较少电流高低
提取植物材料蛋白的方法主要有TCA/丙酮法、Tris-HCl法和酚抽提法等.金钗石斛花芽中含有大量石斛多糖等,影响蛋白样品制备及后续电泳过程.采用酚抽提法能有效去除金钗石斛花芽材料中的多糖、离子及核酸[16],获得较高蛋白产量,减少条纹干扰,与欧高政等[17]采用酚抽提法提取龙眼花芽蛋白的研究一致.
2.2水化方式的选择
对金钗石斛花芽蛋白采用主动水化(图2A)所得到的图谱pI在5.0,大小在66 200 u左右的蛋白点未分开,且部分蛋白点出现纵向拖尾现象, PDquest 7.4软件分析得到661个蛋白点;而被动水化(图2B)得到的电泳图谱背景相对干净,酸性端大分子量的蛋白点分离效果比主动水化好,纵向条纹较少,所得到的蛋白点较清晰、形状规则,蛋白点达775个.
低电压下主动水化可促进样品中盐分的去除,利于大分子量蛋白进入胶条,但会造成部分小分子量蛋白的损失[18].被动水化能确保小分子量蛋白在第一向胶条中得到良好的分离.

A为主动水化,B为被动水化;a、b为局部放大图
Figure 2Representative 2-DE protein maps of total proteins ofD.nobileflower bud by two different hydration methods.(17 cm pH 3~10 NL gradient IPG strip)
2.3等电聚焦程序优化
对金钗石斛花芽蛋白采用IEF程序B1聚焦,聚焦电流偏高,达不到预设电压10 000 V; 2-DE图谱(图3A)背景深,整体上蛋白点未分开,纵向条纹明显且出现横向拖尾,可能与等点聚焦不充分有关[19].采用IEF程序B2聚焦, 样品的除盐效果优于IEF程序B1, 聚焦电流介于15~20 uA/ strip之间, 聚焦电压达到设定值10 000 V得到的2-DE图谱(图3B)背景干净,蛋白点清晰基本无拖尾现象,蛋白点形状规则,呈圆形或椭圆形.PDquest 7.4软件分析结果表明,采用IEF程序B1和IEF程序B2,分别得到了164和443个蛋白点. 要获得高质量的电泳图谱,关键是IEF分离效果.闫伟丽等[20]对等点聚焦参数进行了优化.本实验通过渐进式升压的方式,延长除盐时间,为搭建盐桥提高了IEF的质量.
2.4IPG胶条选择
比较了4种胶条的等电聚焦结果:17 cm pH 5~8胶条(图4A),可能其pH 范围较窄,胶条pH范围以外的 pH>8 碱性端,以及pH<5 的酸性端蛋白点重叠成较大蛋白带;17 cm pH 3~10或pH 3~10 NL胶条(图4B、C),虽然蛋白酸性端和碱性端被分开,但大部分蛋白集中在pH 4~9 之间,分辨率较差;24 cm pH 3~10 NL胶条(图4D)上酸性和碱性端蛋白很好分离,中性蛋白均匀分布,形状规则.分析表明,17 cm pH 5~8胶条、17 cm pH 3~10胶条、17 cm pH 3~10 NL胶条、24 cm pH 3~10 NL胶条所得到的蛋白点数分别为767、443、775、1 254个. IPG胶条的选择与材料中蛋白分布、目的蛋白性质等相关.总体上看,24 cm pH 3~10 NL胶条图谱清晰,蛋白点数目增加,分离效果优于其它胶条.
2.5双向电泳的重复性
对金钗石斛花芽总蛋白质的2次平行实验用24 cm pH 3~10 NL胶条分离. PDquest 7.4(Bio-Rad, USA) 软件进行蛋白质点检测及匹配分析(图5A、B),分别检测到约1 422和1 320个蛋白点,匹配率到达92.8%.利用 PDquest 7.4软件分析,大部分点重叠呈现黄色(图5C),显示重复性好. 重复性是整个蛋白质组学技术中一个重要的环节,从蛋白点的分离效果、蛋白点的数量、凝胶的背景等几个方面来看,本研究所得的双向电泳图谱重复性及稳定性均好.

A:IEF程序B1;B:IEF程序B2;a、b为局部放大图.
图3不同IEF程序所获金钗石斛花芽总蛋白的双向电泳图谱(17 cm, pH 3~10 NL胶条)
Figure 3Representative 2-DE protein maps of totalD.nobileflower bud proteins by two different IEF procedures (17 cm pH 3~10 gradient IPG strip)
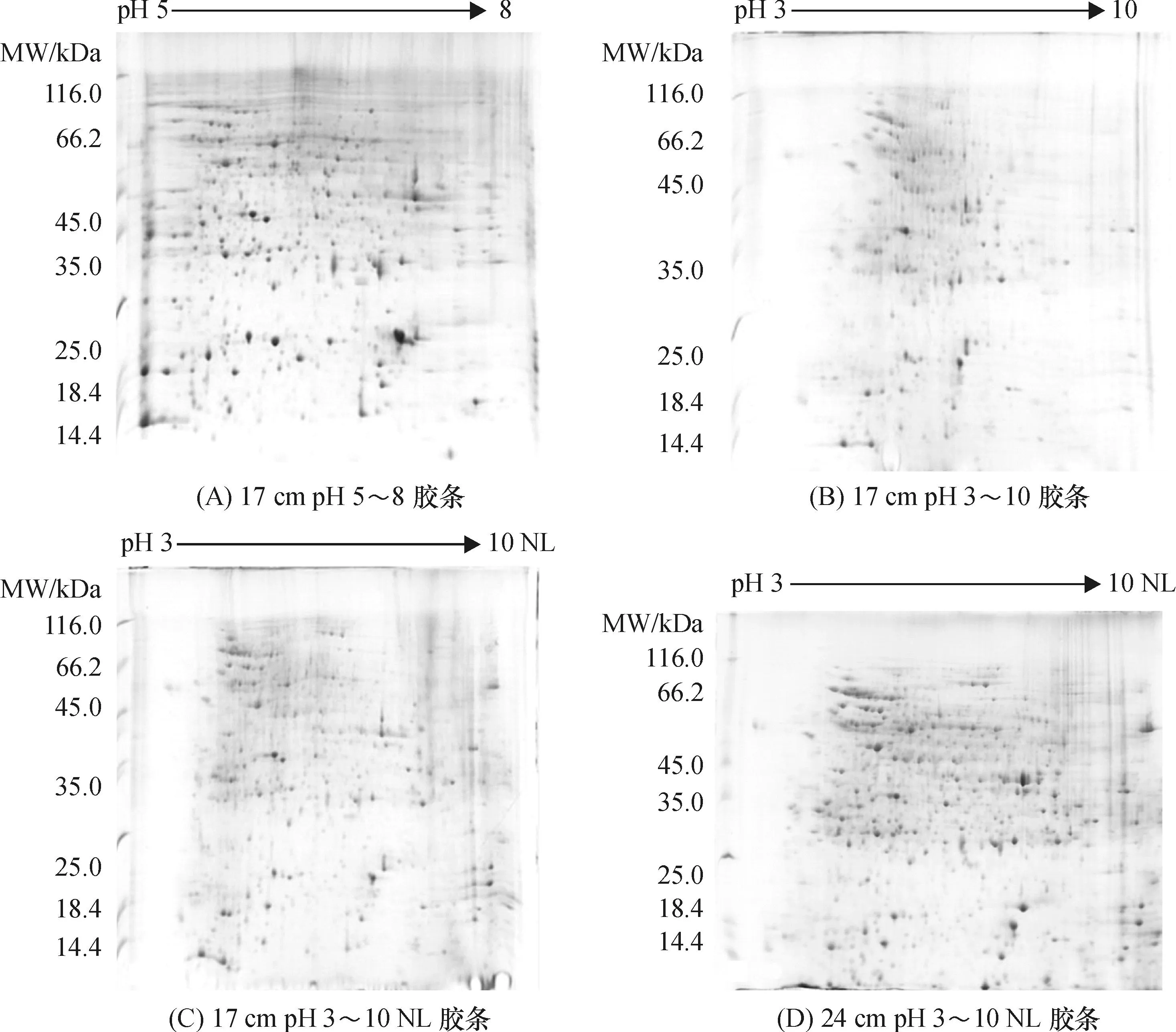
图4 4种不同胶条所获金钗石斛花芽总蛋白的双向电泳图谱

A和B分别为2次平行实验的2-DE图谱;C为利用PDquest 7.4 软件对图A、B以不同荧光(红色,绿色)显示并进行重叠(24 cm, pH 3~10 NL胶条)
图5金钗石斛花芽蛋白两次2-DE平行实验
Figure 5Comparative analyses of two 2-DE experimental maps of theD.nobileflower bud proteins
3结论
笔者以金钗石斛花芽为实验材料,建立了适用于金钗石斛花芽蛋白分析的双向电泳体系:酚抽提法,样品与水化液1∶40复溶;被动水化,IEF程序B2,选用24 cm pH 3~10NL 胶条和12% 的凝胶分离蛋白;考马斯亮蓝G-250染色,得到了背景清晰、1 422个蛋白斑点且分辨率高的双向电泳图谱,为金钗石斛花芽在蛋白质组学水平上的后续分析提供了技术支持.
参考文献:
[1]陈庭, 叶庆生, 刘伟. 金钗石斛类原球茎诱导及增殖的正交试验[J]. 华南农业大学学报, 2005, 26(3): 60.
CHEN T, YE Q S, LIU W, et al. The orthogonal test of induction and proliferation ofDendrobiumnobileprotocrom-like bodies (PLBs)[J]. Journal of South China Agricultural University, 2005, 26(3): 60.
[2]漆小雪, 韦霄, 陈宗游, 等. 不同肥料对金钗石斛生物学性状、SPAD值和石斛碱含量的影响[J]. 北方园艺, 2014(5): 143-146.
QI X X, WEI X, CHEN Z Y,et al. Effect of the different manure on biological characteristics, SPAD value and Dendrobium Alkali contents ofDendrobiumnobileLindl[J].Northern Horticulture, 2014(5): 143-146.
[3]李静婷, 牛磊, 侯玉杰. 金钗石斛的快速繁殖研究[J]. 湖北农业科学, 2014, 53(9): 2181-2183.
LI J T, NIU L, HOU Y J. The rapid propagation ofDendrobiumnobideLindl[J].Hubei Agricultural Sciences, 2014, 53(9): 2181-2183.
[4]张晓敏, 孙志蓉, 陈龙, 等. 金钗石斛的化学成分和药理作用研究进展[J]. 中国现代应用药学, 2014, 31(7): 895-899.
ZHANG X M, SUN Z R, CHEN L, et al. Advances of studies on chemical constituents and pharmacological effect ofDendrobiumNobile[J]. Chinese Journal of Modern Applied Pharmacy, 2014, 31(7): 895-899.
[5]庄军平, 黄胜琴, 潘舒群, 等.金钗石斛花芽cDNA表达文库的构建及鉴定[J]. 园艺学报, 2006, 33(4): 895-897.
ZHUANG J P, HUANG S Q, PAN S Q, et al. Construction and identification of a cDNA expression library fromDendrobiumnobile[J]. Acta Horticulturae Sinica, 2006, 33(4): 895-897.
[6]闻真珍, 刘运权, 林首恒, 等. 细胞分裂素对金钗石斛开花及其VRN1-like 基因表达的影响[J]. 华南师范大学学报(自然科学版), 2013, 45(4): 109-114.
WEN Z Z, LIU Y Q, LIN S H, et al. Cloning and Expression Analysis of aVRN1-likeGene fromDendrobiumNobile[J]. Journal of South China Normal University (Natural Sciene Edition), 2013, 45(4): 109-114.
[7]董婧, 应奇才, 王慧中. 石斛叶片蛋白质双向电泳技术体系的建立及优化[J]. 浙江农业学报, 2009, 21(3): 230-233.
DONG J, YING Q C, WANG H Z. Establishment and optimization of two-dimensional electrophoresis for proteomicanalysis of dendrobium[J]. Acta Agriculturae Zhejiangensis, 2009, 21(3):230-233.
[8]YUAN X, WU Z M, LI H, et al. Biochemical and proteomic analysis of ‘Kyoho’ grape (Vitislabruscana) berries during cold storage[J]. Postharvest Biology and Technology, 2014, 88:82.
[9]LIU X T, ZHAI R, FENG W T, et al. Proteomic analysis of ‘Zaosu’ pear (PyrusbretschneideriRehd.) and its early-maturing bud sport[J]. Plant Science, 2014, 224:123.
[10]LIAO J L, ZHOU H W, ZHANG H Y, et al. Comparative proteomic analysis of differentially expressed proteins in the early milky stage of rice grains during high temperature stress[J]. Journal of Experimental Botany, 2014, 65(2): 657.
[11]DAFNY-YELIN M, GUTERMAN I, MENDA N, et al. Flower proteome: changes in protein spectrum during the advanced stages of rose petal development[J]. Planta, 2005, 222(1): 38.
[12]CARPENTIER S C, WITTERS E, LAUKENS K, et al. Preparation of protein extracts from recalcitrant plant tissues: an evaluation of different methods for two-dimensional gel electrophoresis analysis[J]. Proteomics, 2005, 5(10): 2499.
[13]BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72:249.
[14]郭尧君. 蛋白质电泳实验技术[M].2版. 北京:科学出版社, 2005: 206-207.
[15]占志勇, 黄建建, 汪阳东,等. 双向电泳在植物蛋白质组中的应用及影响因素分析[J]. 南方林业科学, 2015, 43(2): 1-5.
ZHAN Z Y, HUANG J J, WANG Y D, et al. Application of two-dimensional gel electrophoresis in plant proteomics and its influence factors analysis[J]. South China Forestry Science, 2015, 43(2): 1-5.
[16]WU X L, GONG F P, WANG W. Protein extraction from plant tissues for 2DE and its application in proteomic analysis[J]. Proteomics, 2014, 14(6): 645-658.
[17]欧高政, 陈清西. ‘四季蜜’龙眼花芽总蛋白质提取方法及双向电泳体系的优化[J]. 热带作物学报, 2014, 35(6): 1095-1101.
OU G Z, CHEN Q X. Method of total protein isolation from floral buds of Longan (DimocarpuslonganLour. Cv Sijimi) and optimization of two-dimensional electrophoresis system[J]. Chinese Journal of Tropical Crops, 2014, 35(6): 1095-1101.
[18]朱雅卿,韩剑众,王彦波. 猪骨骼肌双向电泳样品制备及等电聚焦方法研究[J]. 中国食品学报, 2009, 9(3): 99-104.
ZHU Y Q, HAN J Z, WANG Y B. Studies on sample preparation of 2-DE and IEF method of pig skeletal muscle[J]. Journal of Chinese Institute of Food Science and Technology, 2009, 9(3): 99~104.
[19]刘健平, 陈国华, 陈本美, 等. 蛋白质组双向电泳实验中一些常见失误的分析[J]. 生命科学研究, 2003, 7(2): 177-180.
LIU J P, CHEN G H,CHEN B M, et al. Analysis of troubles in 2-dimensional gels electrophoresis of proteomic studies[J]. Life Science Research, 2003, 7(2): 177-180.
[20]闫伟丽, 钟俐, 王贤磊, 等.甜瓜叶片蛋白的提取和双向电泳体系的优化[J]. 中国农学通报, 2014, 30(19):105-110.
YAN W L, ZHONG L, WANG X L, et al. The extraction and optimization of two-dimensional electrophoresis for leaf protein of melon[J]. Chinese Agricultural Science Bulletin, 2014, 30(19):105-110.
【中文责编:成文英文责编:李海航】
Optimization of Protein Extraction and Two-Dimensional Electrophoresis of theDendrobiumnobile. Flower Bud
YE Jie, YIN Limei, YE Qingsheng*
(Guangdong Provincial Key Laboratory of Biotechnology for Plant Development, School of Life Sciences,South China Normal University, Guangzhou 510631, China)
Abstract:To establish the two-dimensional gel electrophoresis system of Dendrobium nobile flower bud proteins and gain a higher reproducibility and resolution, the proteins of D. nobile flower bud were extracted by optimized phenol method. The sample was passively rehydrated by dissolving in 40-fold (w/v) rehydration solution. Isoelectric focusing was performed in Program B2, using 24 cm pH 3-10NL gradient IPG strip and 12% SDS-PAGE. The gel was stained with Coomassie brilliant blue G-250. By this modified method, the 2-D electrophoretic maps of the D. nobile flower bud proteins showed 1 422 protein spots, with high repeatability and high resolution. This work provides a good method for proteomic analysis of D. nobile flower buds.
Key words:Dendrobium; flower bud; proteomics; 2-D electrophoresis
中图分类号:Q946.1; S682.31
文献标志码:A
文章编号:1000-5463(2016)02-0067-07
*通讯作者:叶庆生,教授,Email: ye-lab@scnu.edu.cn.
基金项目:广东省自然科学基金重点项目(10251063101000013)
收稿日期:2015-05-07《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
