餐饮垃圾制备乙醇的同步糖化发酵研究
2016-05-25黄清媚康小龙肖文娟李晶博林蒋海刘泽寰
黄清媚,康小龙,黄 清,肖文娟,李晶博,林蒋海,刘泽寰
(暨南大学生命科学技术学院,广东 广州 510632)
餐饮垃圾制备乙醇的同步糖化发酵研究
黄清媚,康小龙,黄 清,肖文娟,李晶博,林蒋海,刘泽寰
(暨南大学生命科学技术学院,广东 广州 510632)
为建立一种针对餐饮垃圾的同步糖化发酵技术,进一步提高乙醇的产率,以期早日实现工业化,通过将单酶以两两组合或三个混合的方式筛选最优酶组合,结果显示终酶活力120 U/g的糖化酶与300 U/g的异淀粉酶之间的协同作用最好,葡萄糖产量达130.29 g/L。利用酿酒酵母CICC 1346、终酶活力为120 U/g的糖化酶和300 U/g的异淀粉酶对餐饮垃圾进行了同步糖化发酵(SSF)和分步糖化发酵(SHF),结果显示SSF和SHF的乙醇产量分别为49.48 g/L和45.89 g/L,糖醇转化率分别为91.7%和77.1%。SSF与SHF相比存在操作简单、发酵时间短和乙醇产率高的优势,已具备了工业化应用的价值。
餐饮垃圾;异淀粉酶;SSF;SHF;乙醇
餐饮垃圾是指来自酒店、餐厅、食堂等含有高水分含量、高有机物含量和高盐的特殊有机垃圾[1]。我国目前每年产生的餐饮垃圾数量惊人,据不完全统计,已超过6 000万t/a[2]。而餐饮垃圾本身对环境和食物链存在显性危害,因此餐饮垃圾的处理至关重要。利用餐饮垃圾生产乙醇是餐饮垃圾处理的新的研究方向,近年来虽然取得了一定的进展,但在发酵工艺模式、发酵周期、乙醇产率等方面还有待改进。此外,由于2006年起我国政府已限制用粮食来生产酒精[3],所以建立成熟、高效的利用非粮食原料——餐饮垃圾生产乙醇的技术就显得十分必要了。
由于菌种酿酒酵母本身是不具备淀粉降解能力的,而是需要将淀粉降解为葡萄糖后(此步骤称为糖化),才能被酵母发酵成为乙醇,因此糖化步骤和方式是影响乙醇生产的决定性因素。餐饮垃圾分为纤维素类和淀粉类,两类均可以通过酶解发酵制备燃料乙醇[4]。纤维素类餐饮垃圾的酶解研究相对成熟,如于红艳等[5]采用纤维素酶和糖化酶酶解餐饮垃圾;曹媛媛等[6]采用淀粉酶、糖化酶、蛋白酶和纤维素酶酶解餐饮垃圾;刘伟伟等[7]采用液化酶、糖化酶、纤维素酶和脂肪酶酶解餐饮垃圾;黄智等[8]采用纤维素酶、漆酶和α-淀粉酶酶解餐饮垃圾。目前淀粉类餐饮垃圾主要是采用α-淀粉酶[9]或液化酶[4]与糖化酶共同酶解餐饮垃圾,未有报道异淀粉酶与糖化酶共同酶解餐饮垃圾。
目前工业上生产乙醇主要采用分步糖化发酵(Separate Hydrolysis and Fermentation,SHF)和同步糖化发酵法(Simultaneous Saccharification and Fermentation, SSF),SHF的特点是先糖化后发酵,而SSF的特点是边糖化边发酵[10]。相对来说SSF具有操作简单、效率高、自动化程度高等优势,因此本文着重探讨建立一种较为先进的利用餐饮垃圾制备乙醇的同步糖化发酵技术。同时,由于餐饮垃圾中的营养成分复杂、淀粉来源复杂,不像传统粮食发酵那样背景清晰,所以本文进行了一系列的探索工作,以期进一步提高糖化效率和乙醇产率,为早日打通利用餐饮垃圾生产乙醇的工业化之路打好基础。
1 材料和方法
1.1 餐饮垃圾的预处理
餐饮垃圾取样于广州市某高校食堂。餐饮垃圾经过除杂之后,直接由粉碎机粉碎成小块。经121 ℃灭菌20 min后于-20 ℃保存备用。其主要成分和基本特性如表1所示。
1.2 菌株以及其培养条件
所用菌株为酿酒酵母CICC 1346,购买于中国工业微生物菌种保藏管理中心(CICC)。该菌种是一株乙醇工业发酵用酵母,乙醇产量高,有良好的乙醇和高糖耐受能力,可在YPD(w=1%酵母提取物,w=2%蛋白胨,w=2%葡萄糖)中培养。菌株和YPD以1∶50的比例于30 ℃,200 r/min活化24 h,再转接培养12 h,用YP将菌株的A600均调至0.5~0.6之间,可作为发酵的酒母使用。

表1 餐饮垃圾的特征Table 1 Characteristics of food waste
1.3 酶
用于催化餐饮垃圾发生水解反应的酶包括α-淀粉酶、糖化酶和异淀粉酶。α-淀粉酶(芽孢杆菌)和糖化酶(黑曲霉变异菌株)购买于上海阿拉丁试剂有限公司,异淀粉酶(产气气杆菌)购买于武汉诺辉医药化工有限公司。3种酶的最佳反应温度分别为:50~70,55~60,50 ~55 ℃。3种酶的最优pH分别为:5.5~7.5,3.5~4.5,5.6~7.0。3种酶的酶活活性分别为:3 700、100 000、20 000 U/g。
1.4 餐饮垃圾的酶水解
1.4.1 不同酶活力的3种单酶对餐饮垃圾水解的影响 所有酶解实验均于50 mL圆底发酵瓶中操作。每瓶称取8 g餐饮垃圾,121 ℃灭菌20 min。利用不同终酶活力的α-淀粉酶(8,10,12 U/g)、糖化酶(100,120,140 U/g)和异淀粉酶(200,300,400 U/g)分别水解餐饮垃圾。为了预防染菌,加入60 μg/μL的制霉菌素和80 μg/μL的四环素。选用pH 4.8柠檬酸缓冲液调平每瓶体积。酶解实验于pH 4.8,50 ℃,200 r/min中反应72 h。酶活指数的计算公式:酶活指数=还原糖的产量/底物淀粉的总量[9]。
1.4.2 混合酶对餐饮垃圾水解的影响 根据最优糖化率和经济效益来考虑,选出最佳酶活力的α-淀粉酶、糖化酶和异淀粉酶。3种单酶以两两组合或3个组合的方式混合利用,分别用于餐饮垃圾的酶解。为了预防染菌,也加入60 μg/μL的制霉菌素和80 μg/μL的四环素。酶解实验于pH 4.8,50 ℃,200 r/min中反应72 h。
1.5 餐饮垃圾的SHF和SSF
将最佳酶组合用于餐饮垃圾的进一步分步糖化发酵和同步糖化发酵实验。8 g餐饮垃圾121 ℃灭菌20 min备用。分步糖化发酵中,先加入最优酶组合,于pH 4.8,50 ℃,200 r/min中糖化24 h,再加入w=10%的A600=0.5~0.6的酒母,于30 ℃,200 r/min中发酵餐饮48 h。同步糖化发酵中,同时加入最优酶组合和酒母,于30 ℃,200 r/min中糖化发酵餐饮垃圾36 h。
乙醇转化率的计算公式:
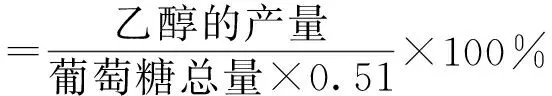
1.6 分析方法
实验均做两个平行,显示数据为平均值± 标准方差(SD)。根据标准方法测定分析餐饮的pH,干物质和粗蛋白。依据标准干燥法在105 ℃干燥至恒质量测定餐饮含水量[11]。用Somogyi-Nelson法测定测定总糖含量[12],用Soxhlet法测定脂肪含量[13]。在酶水解和发酵产酒精的过程中,收集餐饮垃圾混合物上清检测葡萄糖和乙醇的含量。葡萄糖和乙醇含量由液相色谱仪来检测分析。统计分析使用PASW 18软件使用的统计数据单向方差分析和邓肯多个范围测试。结果95%置信interval被认为具有统计学意义(P< 0.05)[14]。
2 结果和讨论
2.1 不同酶活力的3种单酶对餐饮垃圾水解的影响
餐饮垃圾中碳水化合物由各种多糖和单糖组成,比如淀粉、纤维素、葡萄糖等等,来自大米的淀粉占很大的比例,所以对淀粉酶的选择极为重要。本文将不同酶活力的3种单酶分别酶解餐饮垃圾,图1显示10 U/g的淀粉酶酶解餐饮垃圾的酶活指数最高。 图2显示300 U/g异淀粉酶酶解餐饮垃圾的酶活指数最高。图3显示120 U/g糖化酶酶解餐饮垃圾的酶活指数最高。综合3种酶分别酶解餐饮垃圾的结果,从经济效益和酶活效率角度考虑,选择10 U/g α-淀粉酶、300 U/g异淀粉酶和120 U/g糖化酶做后续的组合酶酶解实验。

图1 3种不同酶活力α-淀粉酶于72 h内酶解餐饮垃圾的葡萄糖和还原糖产量(空心代表还原糖质量浓度,实心代表葡萄糖质量浓度)Fig.1 Glucose (filled diagram) and reducing sugar (open diagram) production of three concentrations of α-amylase on the enzymatic hydrolysis of food waste after 72 h
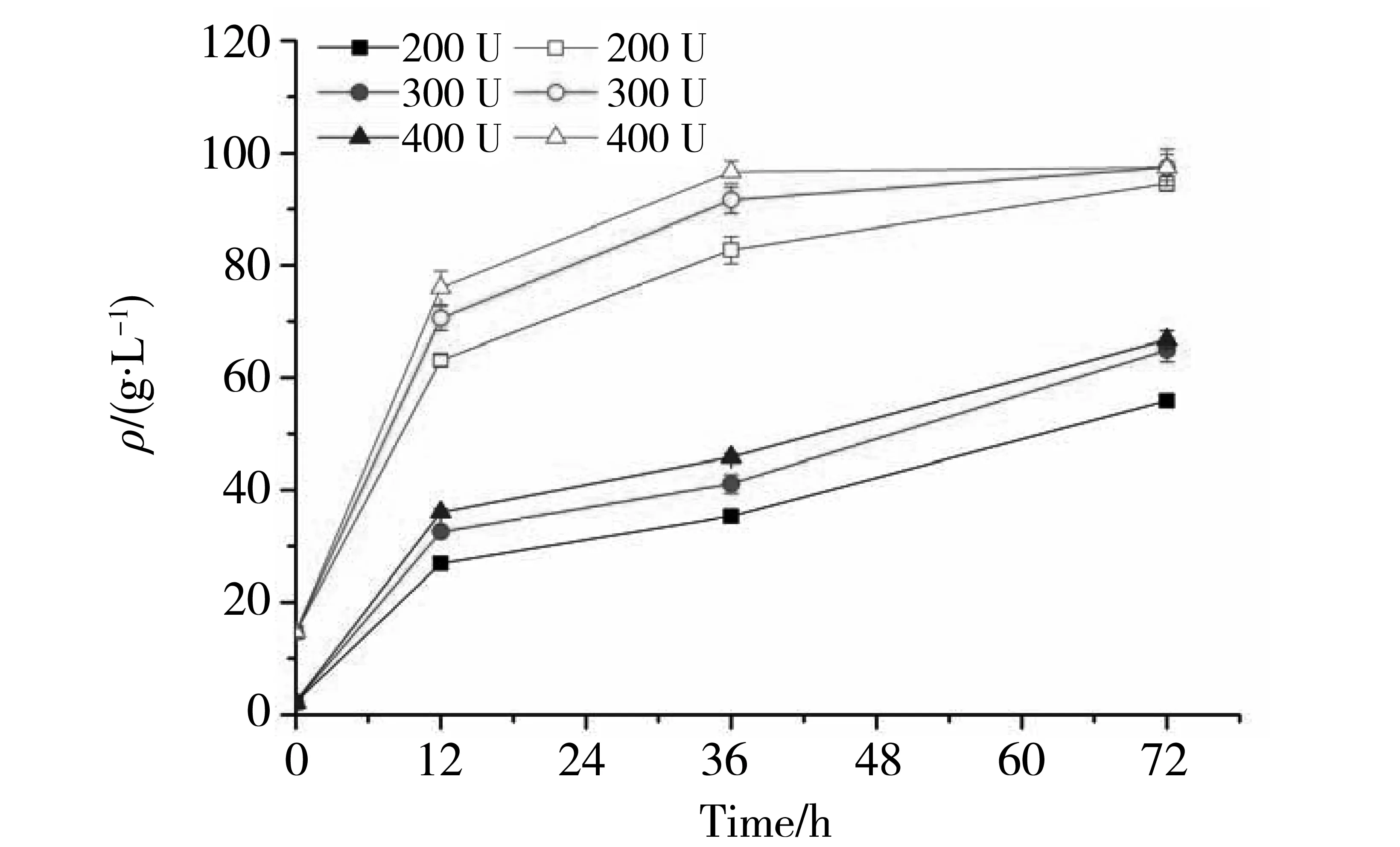
图2 3种不同酶活力异淀粉酶于72 h内酶解餐饮垃圾的葡萄糖和还原糖产量 (空心代表还原糖质量浓度,实心代表葡萄糖质量浓度)Fig.2 Glucose (filled diagram) and reducing sugar (open diagram) production of three concentrations of isoamylase on the enzymatic hydrolysis of food waste after 72 h
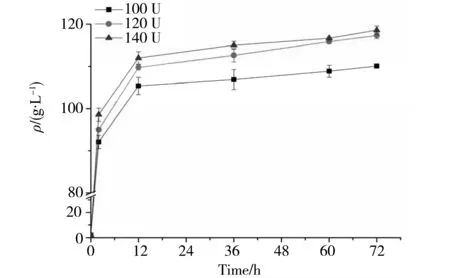
图3 3种不同酶活力糖化酶于72 h内酶解餐饮垃圾的葡萄糖产量Fig.3 Glucose production of three concentrations of glucoamylase on the enzymatic hydrolysis of food waste after 72 h
2.2 混合酶对餐饮垃圾酶解的影响
根据3种酶的作用机制,将3种单酶以两两组合或3个组合的方式混合作用,能提高酶切的效率和葡萄糖产量。实验中共构建了4种酶组合方式酶解餐饮垃圾(见表2)。对比分析图4得知:10 U/g α-淀粉酶在酶组合中不起作用。α-淀粉酶在酶组合中不起作用的原因有两点:① 餐饮垃圾的预处理问题为主要问题[15-16]。所用餐饮垃圾经过机械粉碎和两次高温灭菌,淀粉可能经过机械以及高温的作用,直链淀粉大部分断裂,α-淀粉酶的作用不明显。② 多方面的抑制作用。餐饮垃圾成分复杂,也包括多种化学抑制因子,如糠醛、有机酸等[17-18],由于α-淀粉酶的酶活力相对比较低,受抑制作用相对较明显。此外,实验结果显示,120 U/g糖化酶酶解产生的葡萄糖最高产量为115.69 g/L,B的葡萄糖最高产量为130.29 g/L,D的葡萄糖最高产量为126.82 g/L,证明异淀粉酶和糖化酶存在正协同作用。对比组合A和D,异淀粉酶的加入将葡萄糖产量提升了10%。支链淀粉在淀粉结构中起到很强的固定作用,支链淀粉的断裂更有利于淀粉的水解。综合显示B为最优酶组合。

表2 3种酶的组合方式Table 2 Combined modes of three enzymes

图4 各种酶组合在72 h内酶解餐饮垃圾的葡萄糖产量Fig.4 Glucose production of various mixtures of enzymes on the enzymatic hydrolysis of food waste after 72 h
2.3 餐饮垃圾的SHF和SSF对比研究
利用酿酒酵母CICC 1346作为菌种,采用上述最优酶组合进行进一步发酵研究,结果如图5所示。SHF最高的乙醇产量为 45.89 g/L,糖醇转化率达到77.1%;SSF最高乙醇产量为49.48 g/L,糖醇转化率达到91.7%。对比可知,SSF在发酵效率和乙醇产量上比SHF有明显优势。
与同类研究对比可以发现,颜守保等[9]用终酶活力10 U/g α-淀粉酶、120 U/g 糖化酶和酿酒酵母H058菌株对餐饮垃圾进行分步糖化发酵,糖醇转化率达到91.5%,与本文基本相当,但在其它方面存在许多不足之处。其一,其实验采用在餐饮垃圾中以1∶1比例添加水的办法来提高糖化效率,虽然添加水能提高酶和底物的接触机会,但无形中大大降低了产物含量,对后续的乙醇蒸馏脱水极为不利。其二,其实验采用分步糖化发酵,糖化后还要离心取上清做后续的乙醇发酵,操作复杂、物料损失大,也不利于工业应用。另外,其发酵时间过长,需要60 h。本研究采用了同步糖化发酵,因此在操作、发酵周期、能耗等方面均具有明显的优势。Jae Hyung Kim等[19]用碳水化合物降解酶(含有阿拉伯糖苷酶、纤维素酶、β-葡萄糖苷酶、半纤维素酶和木聚糖酶)和酿酒酵母直接对餐饮垃圾进行SHF和SSF发酵,结果显示SHF和SSF的乙醇产率分别为68.85和37.4 g/L,糖醇转化率分别为100%和74%,与本文的结果正好相反。原因可能是因为韩国的餐饮垃圾中蔬菜类含量占了有机物的50%,含有大量的纤维素、半纤维素等较淀粉更难以降解的多糖分子,因此在SHF中可不受时间限制,最终被碳水化合物降解酶充分降解而获得很高的糖化率;而在SSF中,由于糖化和发酵同步进行,纤维素、半纤维素等降解得比淀粉慢,导致糖化速度跟不上发酵速度,从而限制了整体的发酵效率[20]。可见餐饮垃圾的成分区别对发酵效率有很大的影响,要获得高效的SSF,就一定要充分考虑餐饮垃圾的地域性差异。

图5 CICC 1346组合300 U/g异淀粉酶+120 U/g糖化酶以SHF和SSF的方式糖化发酵餐饮垃圾的葡萄糖消耗量和乙醇产量(实心代表葡萄糖消耗量,空心代表乙醇产量)Fig.5 Glucose consumption of glucose (filled diagram) and ethanol production (open diagram) in SHF and SSF by the combination of CICC1346 and 300 U/g isoamylase + 120 U/g glucoamylase
3 结 论
由上述实验结果可知,利用餐饮垃圾进行乙醇发酵完全不同于传统的淀粉乙醇发酵,在传统发酵中,α-淀粉酶是必不可少的,而异淀粉酶是不必须的。造成这种差异的最主要因素可能是因为餐饮垃圾中的淀粉与传统工业发酵用的淀粉不同,首先餐饮垃圾中的淀粉由于经过了烹饪、灭菌等多道步骤,淀粉已大都降解为糊精,α-淀粉酶的重要性随之减弱;其次,广州等南方地区的主食多为稻米,支链淀粉含量高,因此加入支链淀粉酶后,降解作用明显,由此也提示我们利用餐饮垃圾发酵乙醇,还要针对地方的饮食特色进行调整,才能获得最佳的发酵效果。本文最终获得了针对广州地区餐饮垃圾生产乙醇的SSF方案,发酵周期仅为24 h,酒精产量为49.48 g/L,糖醇转化率达到91.7%,已具有工业化应用价值。
[1] YAN S, LI J, CHEN X, et al. Enzymatical hydrolysis of food waste and ethanol production from the hydrolysate [J]. Renewable Energy, 2011, 36(4), 1259-1265.
[2] 方龙,刘泽寰. 一种能降解利用餐厨垃圾的基因重组酵母构建及应用研究[D]. 2014.
[3] YAN S, WANG P, ZHAI Z, et al. Fuel ethanol production from concentrated food waste hydrolysates in immobilized cell reactors by Saccharomyces cerevisiae H058 [J]. Journal of Chemical Technology & Biotechnology, 2011, 86(5): 731-738.
[4] 曹铭. 餐厨废弃物糖化发酵炼制燃料乙醇研究 [D]. 2013.
[5] 于红艳,曹树勇,奚立民, 等. 餐厨垃圾制备燃料乙醇酶促反应条件的研究 [J]. 可再生能源,2009, 27(6): 46-49.
[6] 曹媛媛,李俊,陈祥松, 等. 餐厨废弃物资源化利用初探 [C]. 安徽新能源技术创新与产业发展博士科技论坛论文集, 2010.
[7] 刘伟伟,姚建铭,陈祥松, 等. 餐厨废弃物复合酶解预处理条件优化 [J]. 安徽农业大学学报, 2016, 43(1): 123-127.
[8] 黄智,梁秋萍,宿城远, 等. 复合酶水解餐厨垃圾研究 [J]. 广西师范大学学报(自然科学版), 2014, 32(2): 111-116.
[9] YAN S, YAO J, YAO L, et al. Fed batch enzymatic saccharification of food waste improves the sugar concentration in the hydrolysates and eventually the ethanol fermentation by Saccharomyces cerevisiae H058 [J]. Brazilian Archives of Biology and Technology, 2012, 52(2): 183-192.
[10] WRIAWAN F, CHENG C, KAO W, et al. Cellulosic ethanol production performance with SSF and SHF processes using immobilized Zymomonas mobilis [J]. Applied Energy, 2012, 4(100): 19-26.
[11] GILCREAS F W. Standard methods for the examination of water and waste water [J]. American Journal of Public Health and the Nations Health, 1966, 56(3): 387-388.
[12] SOMOGYI M. Notes on Sugar Determination [J]. Journal of Biological Chemistry, 1951, 195(1): 19-23.
[13] BERNAL J L, NOZAL M J, JIMéNEZ J J. Use of a high-pressure Soxhlet extractor for the determination of organochlorine residues by gas chromatography [J]. Chromatographia, 1992, 34(9): 468-474.
[14] LI J, ZHOU P, LIU H, et al. Ethanol production from xylan-removed sugarcane bagasse using low loading of commercial cellulase [J]. Bioresource Technology, 2014, 163: 390-394.
[15] CEKMECELIOGLU D, UNCU O N. Kinetic modeling of enzymatic hydrolysis of pretreated kitchen wastes for enhancing bioethanol production [J]. Waste Management, 2013, 33(3):735-739.
[16] PIETRZAK W, KAWA-RYGIELSKA J. Ethanol fermentation of waste bread using granular starch hydrolyzing enzyme: Effect of raw material pretreatment [J]. Fuel, 2014, 134:250-256.
[17] WANG X Q, WANG Q H, LIU Y Y, et al. Kinetics and thermodynamics of glucoamylase inhibition by lactate during fermentable sugar production from food waste [J]. Journal of Chemical Technology & Biotechnology, 2010, 85(5):687-692.
[18] CHEUNG H N, HUANG G H, YU H. Microbial-growth inhibition during composting of food waste: effects of organic acids [J]. Bioresource Technology, 2010, 101(15), 5925-5934.
[19] KIM J H, LEE J C, PAK D. Feasibility of producing ethanol from food waste [J]. Waste Management, 2011, 31(9): 2121-2125.
[20] PHILIPPIDIS G P, HATZIS C. Biochemical engineering analysis of critical process factors in the biomass-to-ethanol technology [J]. Biotechnology Progress, 1997, 13(3): 222-231.
Simultaneous saccharification and fermentation from food waste to ethanol
HUANG Qingmei, KANG Xiaolong, HUANG Qing, XIAO Wenjuan, LI Jingbo, LIN Jianghai, LIU Zehuan
(College of Life Science and Technology, Jinan University, Guangzhou 510632,China)
The purpose of study is to establish a method to improve the ethanol output by saccharification and fermentation of food waste in an order to realize the industrialization in the future. By the way of combining two or three kinds of enzymes to obtain an optimization, it was shown that positive synergism effect was observed between glucoamylase (120 U/g) and isoamylase (300 U/g), and the glucose concentration in the hydrolysate reached 130.29 g/L. Simultaneous saccharification and fermentation (SSF) and separate hydrolysis and fermentation (SHF) of food waste have been conducted usingSaccharomycescerevisiaeCICC 1346 and 120 U/g of glucoamylase and 300 U/g of isoamylase. The yields of ethanol in SSF and SHF were 49.48 and 45.89 g/L, and the conversion rates from glucose to ethanol were 91.7% and 77.1%, respectively. Compared to the SHF process, the SSF one was easier to operate and showed shorter fermentation period but higher ethanol production rate, which makes it more suitable for industrial application.
food waste; isoamylase; SSF; SHF; ethanol
10.13471/j.cnki.acta.snus.2016.05.018
2015-03-18
黄清媚(1989年生),女;研究方向:生物化学与分子生物学;通讯作者:刘泽寰;E-mail:zhliu@jnu.edu.cn
Q815
A
0529-6579(2016)05-0103-05
