兔皮胶原蛋白的提取及其结构鉴定
2016-05-24王雪蒙于玮马良李洪军贺稚非张宇昊
王雪蒙,于玮,马良,2,李洪军,2,贺稚非,2,张宇昊,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学 国家食品科学与工程实验教学中心,重庆,400715)
兔皮胶原蛋白的提取及其结构鉴定
王雪蒙,于玮1,马良1,2,李洪军1,2,贺稚非1,2,张宇昊1,2*
1(西南大学 食品科学学院,重庆,400715) 2(西南大学 国家食品科学与工程实验教学中心,重庆,400715)
摘要为增加兔产业产品附加值,开发新型原料胶原蛋白产品,以兔皮为原料,采用酶法提取胶原蛋白。以胶原蛋白提取率为指标,研究胃蛋白酶用量、酶解液pH和酶解时间3个因素对胶原蛋白提取工艺的影响,确定胶原蛋白较优提取条件。单因素试验和正交试验结果表明,较优条件为酶解液pH值为1.9,酶解时间为4 h,胃蛋白酶用量为1%(w/w),在此条件下,胶原蛋白的提取率为(94.17±0.57)%,纯度为(86.12±0.15)%。聚丙烯酰氨凝胶电泳结果表明,兔皮胶原蛋白主要由α,β和γ3种亚基组分组成,为Ⅰ型胶原蛋白;差示量热扫描结果表明该胶原蛋白的热变性温度为44.59 ℃,热焓值为1.386 8 J/g,具有较高热稳定性。
关键词兔皮;胶原蛋白;酶法;工艺优化;结构鉴定
胶原蛋白是一种天然高分子化合物,广泛存在于动物的皮、骨、软骨、肌腱等结缔组织中,支持和保护身体各器官,是哺乳动物体内含量最多、分布最广的一种蛋白质,约占蛋白质总量的30%[1]。胶原蛋白具有一定的乳化性,吸水保湿性和生物相容性,已广泛应用于食品[2]、化妆品[3]、医药[4]等多个领域。
本研究拟从兔皮中提取胶原蛋白,优化胶原蛋白提取工艺,并对胶原蛋白结构和热力学特性进行了研究。
1材料和方法
1.1原料与主要试剂
新鲜伊拉兔皮,购于重庆市北碚区西南大学屠宰场。
冰醋酸、NaOH、NaCl、H2SO4、Na2S、Ca(OH)2、氯胺T、对二甲氨基苯甲醛、高氯酸、正丙醇、异丙醇、甲醇和KI均为分析纯,购于成都市科龙化工试剂厂;羟脯氨酸为分析纯,购于上海楷洋生物技术有限公司;Tris、考马斯亮蓝R-250为优级纯,购于BIO BASIC公司;质量分数为30%丙烯酰胺为优级纯,购于北京索莱宝科技有限公司;甘氨酸(Glycine)、溴酚蓝(BPB)为分析纯,购于生工生物工程(上海)有限公司;胃蛋白酶(1∶10 000)为分析纯,购于北京Solarbio公司);标准蛋白为(分子质量10~200 kDa),购于加拿大Fermentas公司。
1.2仪器与设备
JA3003B电子天平,上海精天电子仪器有限公司;FYL-C020E料理机,九阳股份有限公司;PHS-25型数显酸度计,杭州雷磁分析仪器厂;99-1大功率磁力搅拌器,金坛市科析仪器有限公司;5810型台式高速离心机,德国Eppendorf公司;QL 901 Vortex旋涡混合器,海门市其林贝尔仪器制造有限公司;8002型温控水浴锅,北京永光明医疗仪器厂;752紫外可见分光光度计,上海箐华科技有限公司;FD-1-50真空冷冻干燥机,北京博医康实验仪器有限公司;日立L-8800型全自动氨基酸分析仪,日本Hitachi公司;Pyris4000差示量热扫描仪,美国PerkinElmer公司;Spectrun100红外光谱仪,美国PerkinElmer公司;Power PacTM基础电泳仪,美国Bio-Rad公司;G:BOX EF型凝胶成像系统,英国Syngene公司。
1.3实验方法
1.3.1兔皮基本成分的测定
水分含量:直接干燥法[5];灰分含量:高温灼烧法[6];脂肪含量:索氏抽提法[7];蛋白质含量:凯氏定氮法[8]。
1.3.2兔皮胶原蛋白提取工艺流程
本试验采用胃蛋白酶法从兔皮中提取胶原蛋白,具体工艺流程如下:
兔皮→前处理(清洗、脱毛、剪碎)→除杂蛋白→清洗→酸浸泡→打浆→酶解→盐析→纯化→冻干→胶原蛋白
(1)前处理:将新鲜兔皮清洗,浸入质量分数10%的NaCl溶液12 h,除去皮下脂肪后,将脱毛剂(向5%的Na2S添加Ca(OH)2至糊状)于室温涂在皮上,4 h后脱毛[9]。充分水洗并切成约3 mm×3 mm的小块,再浸入5倍体积质量浓度为10 g/L的NaCl溶液浸泡以去除杂蛋白(浸泡搅拌6 h,每2 h换1次液),用蒸馏水洗涤3~4次,真空包装冻藏备用。
(2)酸浸泡、打浆:取一定量皮块,按1∶15(g∶mL)比例加入pH 2.2的醋酸溶液,在4 ℃下浸泡8~10 h,待皮块膨胀均匀后打成浆状。
(3)酶解:向打碎的兔皮中继续添加一定量的醋酸溶液,使溶液总体积为兔皮质量的30倍,搅拌成均匀的浆液,控制浆液pH。向兔皮浆液中加入一定量的胃蛋白酶,于4 ℃下酶解。
(4)中和、盐析:将酶解液过滤,向滤液中缓慢滴加浓NaOH(约10 mol/L),调节pH值至7~8,再边搅拌边缓慢加入一定量NaCl(使NaCl最终浓度为4~5 mol/L),盐析12 h。
(5)纯化、冻干:将盐析物离心,取沉淀物,再次水洗离心3次(5 000 r/min,10 min),沉淀即为胶原蛋白粗提物。将胶原蛋白粗提物用pH 2.7的醋酸溶解,离心(5 000 r/min,10 min)除去杂质后灌入透析袋(分子截留质量Mw8 000~14 000 )中,以pH 3.0的醋酸溶液为透析液透析4 d,再以纯水为透析液透析2 d,最后冻干得到纯化的胶原蛋白样品。
1.3.3兔皮胶原蛋白的提取率、纯度的测定和计算
(1)胶原蛋白提取率[公式(1)]:
胶原蛋白提取率/%=
(1)
式中:胶原蛋白含量=羟脯氨酸含量×7.1(7.1为陆生动物系数)[10]。
羟脯氨酸含量测定参照GB/T 9695.23—2008/ ISO3496:1994[11]方法进行,以羟脯氨酸为标准液,绘制标准曲线(R2=0.999 8),如图1所示,再测定各样品的吸光度,计算出羟脯氨酸含量。

图1 羟脯氨酸标准曲线Fig.1 The standard curve of hydroxyproline
(2)胶原蛋白样品纯度:按照上述(1)的方法先测定样品中羟脯氨酸含量,再转换为胶原蛋白含量,按公式(2)计算胶原蛋白的纯度。

(2)
1.3.4兔皮胶原蛋白提取工艺优化
选取工艺中酶解液pH、酶解时间和胃蛋白酶用量3个因素进行参数优化。
1.3.4.1兔皮胶原蛋白提取工艺优化的单因素试验
兔皮胶原蛋白提取工艺优化的单因素试验基本条件为酶解液pH 2.2、酶解时间4 h、酶用量为1%(w/w,以兔皮质量计)。改变其中一个条件,固定其他条件以分析pH、酶解时间、酶用量对胶原蛋白提取率的影响。各因素水平分别为溶液pH值:1.7、1.8、2.0、2.2、2.4;酶解时间:2、4、6、9、12 h;酶用量:0.1%、0.5%、1%、1.5%、2%。
1.3.4.2兔皮胶原蛋白提取工艺优化的正交试验及胶原蛋白纯度的测定
通过单因素试验确定酶解液pH、酶解时间和酶用量3个因素的水平范围(见表1),以胶原蛋白提取率为评价指标进行正交试验,对最优工艺条件下提取的胶原蛋白粗提物先后进行透析、冻干处理得到纯化的胶原蛋白样品,并计算胶原蛋白的纯度。
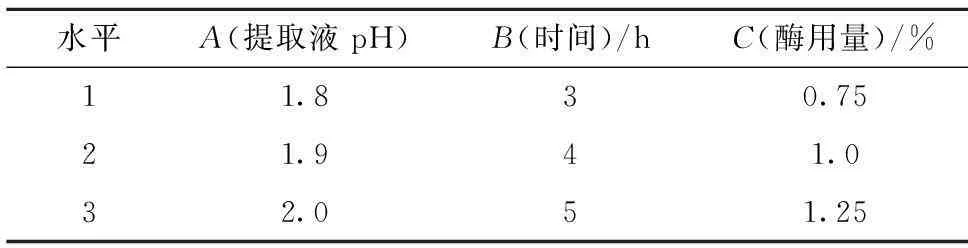
表1 正交试验的因素水平设计
1.3.5兔皮胶原蛋白结构鉴定
通过聚丙烯酰氨凝胶电泳(SDS-PAGE)和差示量热扫描(DSC)分析手段对纯化后的胶原蛋白样品进行结构鉴定。
1.3.5.1胶原蛋白的亚基组成
采用SDS-PAGE垂直电泳分析胶原蛋白的亚基组成,相关溶液配制及具体操作参照陈丽清[12]的方法进行。以0.25 mol/L的Tris-HCl为溶剂,配制1.0 mg/mL的胶原蛋白溶液,按体积比4∶1添加5×样品缓冲液,沸水浴5 min,冷却后上样,上样量为15 μL(Marker上样量为10 μL),分离胶为质量分数6%,浓缩胶质量分数为5%。电流初始设置为15 mA,待溴酚蓝跑到分离胶中后,电流调至25 mA,电泳时间约1 h。考马斯亮蓝染色2 h后用脱色液脱色,直至背景蓝色被脱净,然后用凝胶成像系统拍摄电泳图谱并分析样品的亚基组成。
1.3.5.2胶原蛋白的热稳定分析
用0.05 mol/L醋酸溶液溶解样品,配制0.5 mg/mL的胶原蛋白溶液,吸取20 μL于液体DSC铝盒盘,封存,放入DSC仪,在氮气气氛下,以1 ℃/min的速率从20 ℃升温至50 ℃,记录吸热曲线[13]。
1.3.6数据分析
数据分析采用Microsoft excel 2010和SPSS17.0软件分析,每次试验设置3个平行实验,数据以平均值±标准偏差表示。
2试验结果分析
2.1兔皮基本成分测定结果
由表2可知,兔皮中蛋白含量为14.56%,其中胶原蛋白约占粗蛋白的75%。可见兔皮是一种很好的胶原蛋白提取来源。

表2 兔皮中基本成分
2.2单因素试验
2.2.1酶解液pH对兔皮胶原蛋白提取率的影响
酶解液pH对兔皮胶原蛋白提取率的影响如图2所示。随酶解液pH值的升高,胶原蛋白提取率先升高后下降,在pH 1.8时提取率达最大值(78.93±0.81)%。说明对于兔皮胶原的提取,胃蛋白酶较适作用pH为1.8,高于或低于此pH都不利于胃蛋白酶促进胶原蛋白的释放。此外,当酶解液pH低于1.8时,酸对胶原内部三螺旋结构的降解作用可能增强,导致胶原降解,胶原提取率降低。

图2 酶解液pH对胶原蛋白提取率的影响Fig.2 Effect of pH on yield of collagen
2.2.2酶解时间对兔皮胶原蛋白提取率的影响

图3 酶解时间对胶原蛋白提取率的影响Fig.3 Effect of enzymolysis time on yield of collagen
酶解时间对兔皮胶原蛋白提取率的影响如图3所示。随着酶解时间的增加,胶原蛋白提取率呈现先增加后降低的趋势,在酶解时间为4 h时兔皮胶原蛋白提取率最高达(72.52±0.25)%。与大鲵皮[10]、猪皮[14]胶原蛋白酶解时间相比,兔皮胶原酶解时间大大缩短,这可能与兔皮结构有关,兔皮胶原提取效率远远高于其他种类胶原蛋白,酶解时间4 h时,在酸和酶的作用下断裂胶原蛋白非螺旋区端肽,胶原蛋白得到充分释放。综上所述,确定兔皮胶原较适酶解时间为4 h。2.2.3酶用量对兔皮胶原蛋白提取率的影响
酶用量对兔皮胶原蛋白提取率的影响如图4所示。酶用量为0.1%时,酶量过低,胃蛋白酶不能充分降解胶原的非螺旋区,使胶原蛋白充分释放;胃蛋白酶由0.1%增加到1%,胶原蛋白提取率持续升高,用量达到1%时得率达到(72.52±0.25)%;当酶用量从1%增加到2%,胶原蛋白提取率逐渐下降,这可能是由于酶用量过大,对胶原非螺旋结晶区的破坏更快,从而导致酸对胶原结构的过度降解。综上所述,胃蛋白酶的较适添加量为兔皮质量的1%。

图4 酶用量对胶原蛋白提取率的影响Fig.4 Effect of quantity of enzyme on yield of collagen
2.2.4兔皮胶原蛋白提取工艺参数的优化
在单因素试验结果的基础上,进行溶液pH、酶解时间和酶用量的3因素3水平正交试验,结果见表3。

表3 正交试验结果
由表3知,各因素对胶原蛋白提取率的影响次序为C>B>A。酶解液pH对胶原蛋白提取率的影响最为显著,酶用量次之,酶解时间最小。最优提取方案为酶解液pH 1.9、酶用量1%和酶解时间4 h,即A2B2C2,补加验证试验,得此条件下,胶原蛋白的提取率最高,达(94.17±0.57)%。因此确定胶原蛋白提取的最优工艺参数为:pH 1.9、酶用量1%、酶解时间4 h。
以上最优工艺条件提取出的胶原蛋白粗提物经过透析、冻干处理后得到纯化的白色海绵状胶原蛋白样品。经测定样品中胶原蛋白纯度为(86.12±0.15)%。
2.3兔皮胶原蛋白的结构鉴定
2.3.1胶原蛋白的亚基组成
采用SDS-PAGE电泳检测优化工艺下提取的胶原蛋白的亚基组成,结果如图5所示。
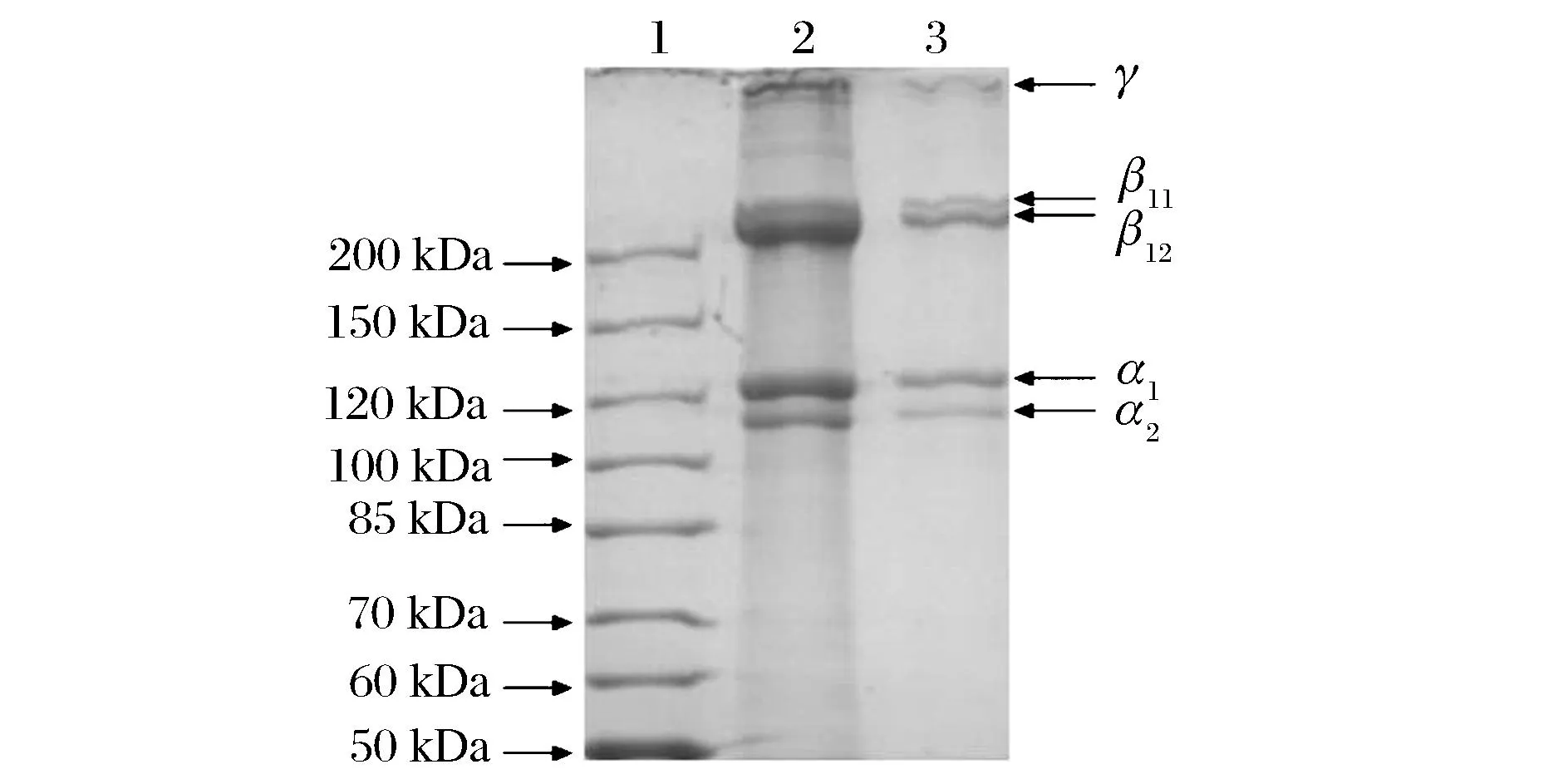
1-标准蛋白; 2-2 mg/mL胶原蛋白溶液; 3-1 mg/mL胶原蛋白溶液图5 兔皮胶原蛋白的SDS电泳图谱Fig.5 SDS-PAGE patterns of rabbit-skin collagen
从兔皮中提取的胶原蛋白具有明显的α、β和γ组分[15-16]。在相对分子质量120 kDa附近的2个条带分别为α1和α2链;200 kDa附近的条带为β链(α链的二聚体);200 kDa以上的为γ链(α链的三聚体)。在α2链以下未发现其他电泳条带,说明在此提取过程中,胶原蛋白的基本结构得以保存,没有生成小分子水解胶原及多肽。SDS-PAGE图谱和胶原蛋白亚基组成表明从兔皮中提取的胶原蛋白为Ⅰ型胶原蛋白。
2.3.2胶原蛋白的热稳定分析
采用差示量热扫描(DSC)检测优化工艺下提取的胶原蛋白的热变性温度(Tm)及热焓值(H),结果如图6所示。
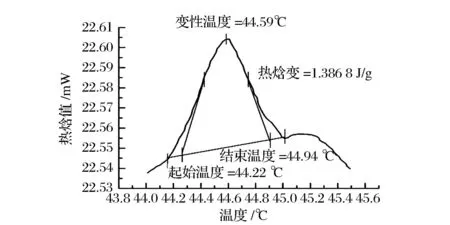
图6 兔皮胶原蛋白的DSC图谱Fig.6 DSC patterns of rabbit-skin collagen
从图6看出,兔皮胶原蛋白热变性温度Tm为44.59 ℃,热焓值(H)为1.386 8 J/g。兔皮胶原蛋白的热变性温度高于猪皮胶原蛋白(37 ℃)[17]和鱼皮胶原蛋白(16.1~30.4 ℃)[18]。研究表明[19],热稳定性是由脯氨酸和羟脯氨酸构成的吡咯环以及羟脯氨酸羟基之间的部分氢键决定的,且热变性温度与胶原蛋白亚氨基酸含量、身体温度和生活环境温度有关。综上所述,本试验优化条件下提取的兔皮胶原蛋白的热稳定较高,维系胶原蛋白结构稳定的分子间作用力较大,天然结构保存较为完整。
3结论
(1)胃蛋白酶提取兔皮胶原蛋白最优条件为:胃蛋白酶用量1%、酶解液pH为1.9、酶解时间为4 h,在此条件下,胶原蛋白提取率可达(94.17±0.57)%,冷冻干燥后的胶原蛋白呈白色海绵状,其纯度为(86.12±0.15)%。
(2)SDS-PAGE电泳结果表明,胶原蛋白主要由α,β和γ3种亚基组分组成,为Ⅰ型胶原蛋白;差示量热扫描(DSC)分析可知,胶原蛋白Tm为44.59 ℃、ΔH为1.386 8 J/g,具有较高的热稳定性。
参考文献
[1]蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006:3-45.
[2]李兴武,章黎黎.胶原蛋白的改性研究及在食品工业中的应用[J].肉类研究,2009(11):80-84.
[3]王学川,任龙芳,强涛涛,等.胶原蛋白的研究进展及其在化妆品中的应用[J].日用化学工业,2005,35(6):388-392.
[4]LEE C H,SINGLA A,LEE Y.Biomedical applications of collagen[J].International Journal of Pharmaceutics,2001,22(1):1-22.
[5]GB5009.3—2010.食品中水分的测定[S].
[6]GB/T 9695.18—2008/ISO 936:1998.肉与肉制品总灰分的测定[S].
[7]GB/T5009.6—2003.食品中脂肪的测定[S].
[8]GB 5009.5—2010.食品中蛋白质的测定[S].
[9]冯文破,祁元明,汤克勇.兔皮Ⅰ型胶原的提取、改性与性能研究[J].北京理工大学学报,2010,30(10):1 231-1 234,1 239.
[10]李莉,顾赛麒,王锡昌,等.响应面法优化酶法提取大鲵皮胶原蛋白工艺[J].中国水产科学,2013,20(7):876-883.
[11]GB/T 9695.23—2008/ ISO3496:1994.肉与肉制品羟脯氨酸含量测定[S].
[12]陈丽清,超高压技术制备高品质明胶及其机理研究[D].重庆:西南大学,2013.
[13]MATMAROH K,BENJAKUL S,PRODPRAN T,et al.Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneus heptacanthus)[J].Food Chemistry,2011,129(3):1 179-1 186.
[14]于玮,王雪蒙,马良,等.猪皮胶原蛋白提取过程中酶解条件优化及其结构鉴定[J].西南大学学报:自然科学版,2015,37(4):106-113.
[15]WANG Lin,LIANG Qiu-fang,CHEN Ting-ting,et al.Characterization of collagen from the skin of Amur sturgeon (Acipencserschrenckii)[J].Food Hydrocolloids,2014,38:104-109.
[16]NALINANON S,BENJAKUL S,KISHIMURA H,et al.Type I collagen from the skin of ornate threadfin bream (Nemipterushexodon):Characteristics and effect of pepsin hydrolysis[J].Food Chemistry,2011,125(2):500-507.
[17]NAGAI T,SUZUKI N,NAGASHIMA T.Collagen from common minke whale (Balaenopteraacutorostrata) unesu[J].Food Chemistry,2008,111(2):296-301.
[18]JONGJAREONRAK A,BENJAKUL S,VISESSANGUAN W,et al.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of brownstripe red snapper (Lutjanusvitta)[J].Food Chemistry,2005,93(3):475-484.
[19]BENJAKUL S,THIANSILAKUL Y,VISESSANGUAN W,et al.Extraction and characterisation of pepsin solubilised collagens from the skin of bigeye snapper (PriacanthustayenusandPriacanthusmacracanthus)[J].Journal of the Science Food and Agriculture,2010,90(1):132-138.
Optimization of extraction process for rabbit-skin collagen and identification of its structure
WANG Xue-meng1, YU Wei1, MA Liang1,2,LI Hong-jun1,2, HE Zhi-fei1,2, ZHANG Yu-hao1,2*
1(College of Food Science, Southwest University, Chongqing 400715, China) 2(National Food Science and Engineering Experimental Teaching Center, Southwest University, Chongqing 400715, China)
ABSTRACTIn order to increase rabbit industry value-added products and develop collagen products of new materials, collagen in rabbit skin was extracted with pepsin. With the collagen extraction rate as the evaluation indicator, the influence of enzyme solution pH、enzymolysis time and the dosage of pepsin to the extraction process of collagen were studied to determine the optimal extraction conditions. The single factor experiment and the orthogonal test results showed that the best processing combination was the enzyme solution pH 1.9, enzymolysis time 4h and pepsin dosage 1%. Under this condition, the extraction rate of collagen was 94.17%±0.57%, with the collagen purity of 86.12%±0.15%. The result of polyacrylamide gel electrophoresis showed that the subunits structure of collagen extracted from rabbit-skin was mainly of α、β and γ, which is type 1 collagen. The result of Scanning Differential Calorimeter analysis showed that the thermal denaturation temperature and enthalpy value of collagen was 44.59 ℃ and 1.386 8 J/g, which proves that the collagen has a higher thermal stability.
Key wordsrabbit skin; collagen; enzymes; process optimization; structure identification
收稿日期:2015-09-06,改回日期:2015-11-30
基金项目:国家自然科学基金项目(No.31301425);中央高校基本科研业务费重大项目(No.XDJK2015A015);中央高校基本科研业务费团队项目(No.2362014xk11)中国博士后科学基金面上项目(No.2014M562267);中国博士后科学基金特别资助项目(No.2015T80951);第四批重庆市高等学校优秀人才支持计划
DOI:10.13995/j.cnki.11-1802/ts.201604038
第一作者:硕士研究生(张宇昊教授为通讯作者,E-mail:zhy1203@tom.com)。
