果蔬中残留毒死蜱农药降解菌的选育及鉴定
2016-05-24孟庆林梁金钟王风青
孟庆林,梁金钟,王风青
(哈尔滨商业大学 食品科学与工程重点实验室,黑龙江 哈尔滨,150076)
果蔬中残留毒死蜱农药降解菌的选育及鉴定
孟庆林,梁金钟*,王风青
(哈尔滨商业大学 食品科学与工程重点实验室,黑龙江 哈尔滨,150076)
摘要为减少果蔬中残留毒死蜱农药,从长期喷洒有机磷农药的耕地土壤中,筛选到1株能高效降解毒死蜱农药的菌株并编号为DOP-Ma3。对其进行形态学和分子生物学鉴定,结果与GenBank上已提交的16S rDNA进行BLAST比对,由MEGA 6.0软件构建的系统发育树,结果表明该菌株与Burkholderia sp. 16S rDNA序列同源性达99%,确定其归属于伯克霍尔德菌属。结合生理生化鉴定结果,确定此菌株为洋葱伯克霍尔德菌(Burkholderia cenocepacia)。实验证明,该菌株在48 h对500 mg/L毒死蜱降解率为69.87%,其降解酶为胞外酶,在35 ℃、30 min、pH 7.0条件下,粗酶液添加量为10%,对250 mg/L的毒死蜱进行降解,其降解率为52.47%。经验证,该菌对氧化乐果、氯氰菊酯和敌百虫也有一定的降解能力。
关键词毒死蜱农药;降解菌;土壤;筛选;16S rDNA
我国蔬菜中的农药残留十分普遍且比较严重[1-3]。国内食用农产品特别是果蔬等中的农药残留污染已经达到了相当严重的程度,会对人们的健康造成损害[4-5]。目前市场上有机磷农药占有较大比重[6],因而对有机磷农药残留的降解就显得比较重要[7]。
有机磷农药(Organophosphates pesticides,简称OPs),主要的化学结构如图1所示,一般含有1个磷酰键(PO)或硫代磷酰键(PS),构成有机磷酸酯或硫代有机磷酸酯。其中,R1和R2直接与P原子结合,或通过S(O)原子与P原子相连,而吸电子的离去基团X则直接或通过S(O)原子间接与P原子相连。当此类杀虫剂被磷酸酯酶水解时,X可从P原子上释放离去,从而表现为解毒代谢作用[8]。
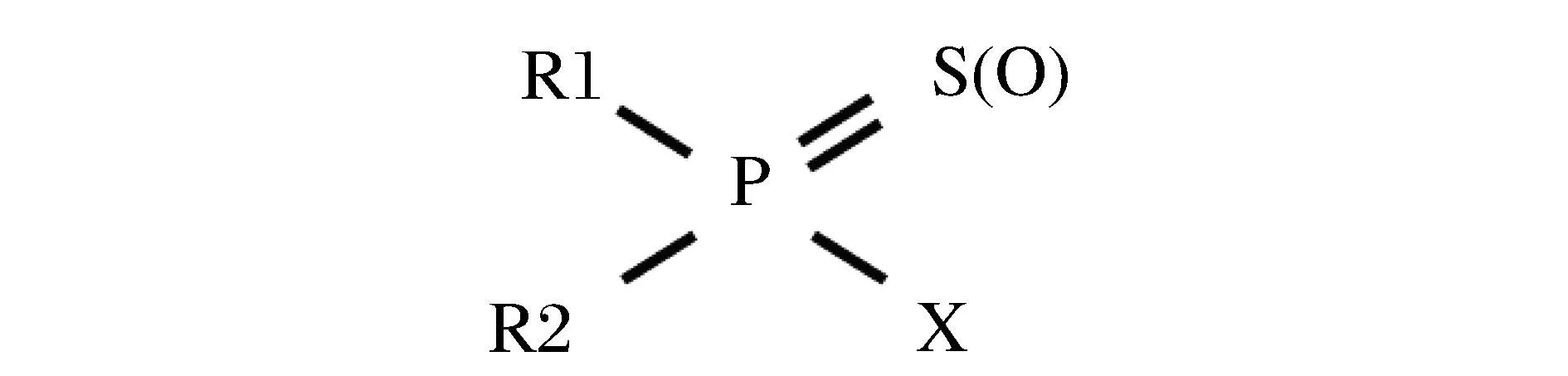
图1 有机磷杀虫剂的化学结构Fig.1 Chemical structure of organophosphorous insecticides
毒死蜱(chlorpyrifos)作为世界广泛使用的有机磷农药主要品种之一,其残留问题引起大量国内外学者的关注与研究。生物降解法具有安全、高效、廉价等优点,近年已报道的研究主要有高效降解微生物的筛选[9]、降解酶的种类与特性[10]、基因工程菌的构建[11]、微生物表面展示技术[12]等。本实验旨在从土壤中筛选出野生高效降解毒死蜱农药的降解菌,对其进行生理生化及分子生物学鉴定,并对其降解酶做初步研究,便于今后菌剂及酶制剂的制备。
1材料与方法
1.1材料与试剂
土壤,取自喷洒过农药的耕地土壤。
毒死蜱乳油(50 g/100 mL),浙江新农化工股份有限公司;石油醚,天津市天力化学试剂有限公司;Ezup柱式基因组DNA抽提试剂盒(细菌),生工生物工程(上海)股份有限公司。
1.2仪器与设备
DZP-102恒温振荡器,中国·哈尔滨东联电子技术开发有限公司;5100紫外可见分光光度计,上海元析仪器有限公司;723N可见分光光度计,上海精密科学仪器有限公司;H1650-W台式高速离心机,湖南湘仪实验室仪器开发有限公司;T100-PCR扩增仪,杭州博日科技有限公司;JY5000电泳仪,北京市君意机电技术公司;SIM凝胶成像系统,百维信生物科技有限公司。
1.3培养基
完全培养基[13]:牛肉膏3.0 g/L、蛋白胨10.0 g/L、NaCl 5.0 g/L,自然pH值。
选择培养基[14]:MgSO4·7H2O 0.500 g/L、K2HPO41.310 g/L、FeSO4·7H2O 0.018 g/L、NaNO33.000 g/L、KCl 0.500 g/L。其中加入一定量的毒死蜱溶液作为唯一碳源。
1.4菌株筛选与鉴定
1.4.1菌株的初步筛选
取1 g土样溶于10 mL生理盐水中,摇匀后取上清液分别用生理盐水梯度稀释,并选取浓度为10-2、10-4、10-6分别涂布于加有50 mg/L毒死蜱的选择培养基平板中,35 ℃倒置培养48 h。将平板上所生长的菌落分别挑至加有100 mg/L毒死蜱的选择培养基的96孔深孔板中,35 ℃恒温培养48 h后,分别取0.1 mL菌液涂布于完全培养基平板中,35 ℃倒置培养24 h,挑取单一菌落于200 mg/L毒死蜱的选择培养基的试管中,依次梯度增加毒死蜱浓度至10000 mg/L,以筛选到高耐药性的菌株。
1.4.2毒死蜱标准曲线的测定
用紫外分光光度法[15]测定并绘制毒死蜱标准曲线:以石油醚作为毒死蜱的溶剂,配制200 mg/L毒死蜱溶液,在紫外分光光度计上全波长扫描(200~700 nm),确定最大吸收波长。同样将石油醚也进行全波长扫描,根据扫描结果验证石油醚可为理想的毒死蜱溶剂。用石油醚分别配置0、5、10、20、30、40、50、75 mg/L的毒死蜱溶液,以石油醚调零,在最大吸收波长处测定毒死蜱含量。根据所得的吸光度值与对应浓度绘制标准曲线。
1.4.3高效降解菌的确定
将筛选出的几株高耐药性菌株分别接种于500、2 500、5 000、7 500、10 000 mg/L毒死蜱的液体选择培养基中,35 ℃恒温培养48 h,分别摇匀后取发酵液适度稀释,取5 mL稀释后发酵液再用等体积石油醚萃取,在最大吸收峰处测其中毒死蜱残留量[15],计算降解率,以确定高效降解菌。
1.4.4菌株的鉴定
1.4.4.1菌株的形态学鉴定
菌株平板划线观察单菌落,挑取单菌落,涂片做革兰氏染色后100倍油镜镜检。菌液富集培养后离心收集菌体做电镜扫描,观察菌体形态。
1.4.4.2菌株的生理生化鉴定
根据《伯杰细菌鉴定手册》(第八版)对菌株进行生理生化鉴定[16]。
1.4.4.3菌株的分子生物学鉴定
用Ezup柱式基因组DNA抽提试剂盒(细菌)提取菌株的16S rDNA。
对菌株16S rDNA进行聚合酶链式反应(polymerase chain reaction,PCR)扩增:反应体系60 μL,模板(菌液)1.2 μL,正向引物(27FP6)1.2 μL,反向引物(1492R)1.2 μL,dNTPs 4.8 μL,Hifi Buffer 6.0 μL,Hifi酶0.6 μL,水定容至60 μL。PCR循环参数为预变性95 ℃ 4 min,变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 90 s,35个循环,72 ℃延伸7 min。取5 μL扩增产物于1 %琼脂糖凝胶电泳[17]。
将DOP-Ma3的16S rDNA 扩增产物送至苏州金唯智生物科技有限公司进行测序,结果在NCBI基因库中进行BLAST分析比对,并选取同源性较高的序列用MEGA 6.0软件以Neighbor-Joining法构建系统发育树[18]。
1.5菌株的生长曲线
将菌株DOP-Ma3按2%接种量接种于完全液体培养基中,35 ℃恒温培养,分别在培养后的2、4、6、8、10、12、14、16、18、20 h取样并在600 nm处测定培养基中菌的吸光度值,以时间为横坐标,吸光度值为纵坐标绘制菌株的生长曲线。
1.6毒死蜱降解酶的细胞定位
分别将菌DOP-Ma3接种于液体完全培养基与加50 mg/L毒死蜱的液体完全培养基,35 ℃、150 r/min摇床培养24 h,分别取菌液30 mL于离心管中,8 000 r/min离心10 min,分离上清液与沉淀,并分别用石油醚清洗2~3次后,上清液即为胞外粗酶液。沉淀用50 mmol/L磷酸盐缓冲液稀释至3 mL,细胞冰水浴并超声波破碎,功率400 W、工作5 s、间歇15 s、工作40次,12 000 r/min离心2 min,取上清液为胞内粗酶液[19]。分别取胞内与胞外粗酶液0.5 mL于5 mL事先用磷酸盐缓冲液配制的250 mg/L毒死蜱底物中。35 ℃水浴反应30 min后加入1 mol/L HCl 0.5 mL终止反应。空白样以水代替粗酶液。于紫外分光光度计中测其在最大吸收峰处的吸光度值,对照标准曲线得出底物中毒死蜱残留量,按公式(1)计算降解率:
(1)
式中:R为粗酶液降解率,%;ρ为空白样吸光度值;ρ1为反应后底物吸光度值;k为标准曲线中斜率。
2结果与分析
2.1毒死蜱降解菌的筛选与鉴定
2.1.1高耐毒死蜱的菌株的筛选
通过选择培养基从土壤中获得200多株耐药性菌株,经梯度增加培养基中毒死蜱浓度至1 000 mg/L,最终获得6株高耐菌株。
2.1.2毒死蜱标准曲线的绘制
2.1.2.1测量方法的验证
以水为基线,将石油醚配置的100 mg/L毒死蜱标样,与石油醚分别在紫外分光光度计下全波长(200~700 nm)扫描,得出毒死蜱与石油醚的吸收光谱曲线,结果见图2与图3。

图2 毒死蜱的紫外吸收图谱Fig.2 The ultra-violet absorption picture of chlorpyrifos
图3 石油醚的紫外吸收图谱Fig.3 The ultra-violet absorption picture of petroleum ether
如图2与图3所示,毒死蜱在293 nm处有明显的特殊吸收峰,而石油醚在此处无明显特殊吸收峰,故可用石油醚为毒死蜱的萃取剂并在293 nm处测毒死蜱浓度。
2.1.2.2毒死蜱标准曲线的测定
以毒死蜱浓度为横坐标(x)、以毒死蜱在293 nm处吸光值为纵坐标(y)绘制标准曲线,如图4。显示在0~80 mg/L范围内有良好的线性关系,回归方程为y= 0.0204x+ 0.021,相关系数为R2=0.999 6。

图4 毒死蜱标准曲线Fig.4 The standard curve of chlorpyrifos
2.1.3高效降解毒死蜱菌株的筛选(复筛)
分别将初筛所得6株高耐菌以2%接种量转接于500、2 500、5 000、7 500、10 000 mg/L毒死蜱质量浓度的选择培养基, 35 ℃恒温培养48 h后取样,适量稀释后以石油醚萃取,在293 nm处测吸光度值,计算降解率,如图5。最终确定1株高效降解菌并编号为DOP-Ma3。

图5 不同菌株对毒死蜱降解率比较Fig.5 Comparisons of degradation rate of chlorpyrifos among different strains
2.1.4菌株的鉴定
2.1.4.1菌株的形态学鉴定
分别用肉眼(图6)和4倍光学显微镜镜检观察完全培养基平板上的DOP-Ma3单菌落形态,菌落呈乳黄色圆形小点状,边缘整齐且半透明,中心微凸起。在试管液体培养时生长于液体表面,为好氧菌。经革兰氏染色后用100倍油镜观察,菌为革兰氏阴性菌(G-),长点状或短杆状。再经S-3400N扫描电镜(图7)观察可清楚看到DOP-Ma3为(0.4~0.6) μm×(1.0~1.2) μm短杆菌。

图6 菌落形态Fig.6 Colonies of strain DOP-Ma3
2.1.4.2菌株的生理生化鉴定
参照《伯杰细菌鉴定手册》(第八版)进行生理生化实验,将菌DOP-Ma3分别接种于生理生化管与相

图7 扫描电镜Fig.7 SEM of strain DOP-Ma3
应的培养基,经培养后观察现象(结果见表1)。精氨酸双水解酶实验中,培养基未出现变色现象,结果为阴性;反硝化作用实验中,大试管中小试管未收集到气体,结果为阴性;水解淀粉实验中,平板中滴加碘液后变为蓝黑色,菌落周围无透明圈,结果为阴性;明胶液化实验,接菌培养后的培养基经4 ℃冷冻10 min后于对照相比有明显的液化现象,结果为阳性。

表1 生理生化实验结果
注:“+”为阳性反应;“-”为阴性反应。
由表1可知,菌株DOP-Ma3可以利用葡萄糖、D-木糖、D-核糖、乙酰丙酸盐、柠康酸盐、中酒石酸盐、2,3-丁二醇、间羟基苯甲酸盐、色胺、戊胺为碳源;但L-鼠李糖、中康酸盐、D-酒石酸盐、赤藓糖醇不能利用。最适生长温度为30~35 ℃。
2.1.4.3菌株的分子生物学鉴定
将提取的16SrDNA经PCR扩增后与Mark同时进行琼脂糖凝胶电泳。结果与Mark对比大小为1 500 bp左右。

图8 菌株DOP-Ma3系统发育树Fig.8 Phylogenetic tree of strain DOP-Ma3
所得序列经NCBI上已公布序列BLAST比对,将同源性99%的序列利用MEGA 6.0软件以Neighbor-Joining法制作系统发育树。由图8可知,所筛菌株DOP-Ma3与已知菌伯克霍尔德菌属同源性均达99 %,确定其为伯克霍尔德菌属(Burkholderasp.),结合生理生化实验结果,确定菌株DOP-Ma3为洋葱伯克霍尔德菌(BurkholderacenocepaciaDOP-Ma3)。GenBank上登录号为KT993571。
2.2菌株的生长曲线
将菌株DOP-Ma3接种于种子培养基中,每两小时测定其OD600,绘制生长曲线,如图9。

图9 菌株DOP-Ma3的生长曲线Fig. 9 Growth curves of strain DOP-Ma3
由图9可见,在完全培养基中菌株DOP-Ma3适应期短,生长迅速,12 h后生长趋势相对稳定。
2.3毒死蜱降解酶位置的确定
分别提取胞外粗酶液与胞内粗酶液对50 mg/L毒死蜱底物进行降解后,在OD293处测毒死蜱残留量并计算降解率,结果见表2。

表2 毒死蜱降解酶位置的确定
表2显示,胞外粗酶液对250 mg/L毒死蜱底物的降解明显,而胞内粗酶液对底物降解几乎为0,初步断定菌降解酶为胞外酶。且未添加毒死蜱的完全培养基中所提胞外粗酶液表现较高降解力,证明该菌株所产降解酶无需毒死蜱为诱导物。加有50 mg/L毒死蜱的发酵液中粗酶液降解率较低,可能是培养基中毒死蜱对菌体的生长有一定的抑制作用,导致产酶量下降,含量降低。
3结论
生物降解作为一种经济、高效、无污染的降解果蔬中农药残留的方法,具有广阔的发展前景。本实验从土壤中筛选到200多株毒死蜱降解菌,经复筛后获得一株高耐药性且高降解能力的菌株,经生理生化与分子生物学鉴定,最终确定其为洋葱伯克霍尔德菌(Burkholderiacenocepacia),编号为DOP-Ma3。该菌株具有良好的耐药性,其对毒死蜱农药的最高耐受度达10 000 mg/L,而且对氧化乐果、氯氰菊酯和敌百虫具有降解能力和耐受力,说明具有一定的广谱性。菌株DOP-Ma3为野生菌株未经诱变,48 h对250 mg/L毒死蜱的降解率为69.87%,与已报道的Rhodopseudomonassp.(红假单胞菌)[20]、Brevibacteriumhalotolerans(耐盐短杆菌)[21]、Bacilluscereus(蜡状芽孢杆菌)等相比有一定优势。所产降解酶为胞外酶且无需毒死蜱诱导,便于后期酶的提取与精制。今后可通过工艺条件优化和分子生物学技术进一步提高降解酶产量与酶活力,并对其酶学性质进行深入研究。另外,该菌株还具有一定的生物防治作用[22],既能减少果蔬表面残留的有机磷农药又能对果蔬生物防腐,利于果蔬贮藏。
参考文献
[1]葛晓光,张智敏.绿色蔬菜生产[M].北京:中国农业出版社,1997.
[2]汪雅谷,张四荣.无污染蔬菜生产的理论与实践[M].北京:中国农业出版社,2001.
[3]张丽.国家质检总局公布蔬菜农药残留量抽查结果[EB/OL] .(2010-11-02)[2011-03-29] .http://www.cctv.com/special/466/5/39289.html.
[4]林玉锁主编.农药环境污染调查与诊断技术[M].北京:化学工业出版社,2003:4-5.
[6]CASIDA J E,KATHLEEN A D.Anticholinesterase insecticide retrospective[J].Chem-Biol Interact,2013,203(1):221-225.
[7]宋茹,纪淑娟.蔬菜水果中有机磷农药残留测定现状及展望[J].农药,2002,41(10):10-12.
[8]李劲彤,杜先林.有机磷杀虫剂的体内活化与解毒[J].中国工业医学杂志,1999,12(1):53-55.
[9]MARGARITA G,ANTONIO B,ELENA G-V,et al.Draft genome sequence of the toluene-degradingPseudomonasstutzeristrain ST-9[J].Genome Announc,2015,3(2):e00192-15.
[10]CHINO-FLORES C,DANTN-GONZLEZ E,VZQUEZ-RAMOS A,et al.Isolation of theopdE gene that encodes for a new hydrolase ofEnterobactersp. capable of degrading organophosphorus pesticides[J].Biodegradation,2012,23(3):387-397.
[11]PINJARI AB,PANDEY JP,KAMIREDDY S,et al.Expression and subcellular localization of organophosphate hydrolase in acephate-degradingPseudomonassp. strain Ind01 and its use as a potential biocatalyst for elimination of organophosphate insecticides[J].Lett Appl Microbiol,2013,57(1):63-8.
[12]LATIFI AM,KARAMI A,KHODI S.Efficient surface display of Diisopropylfluorophosphatase (DFPase) inE.colifor Biodegradation of Toxic Organophosphorus Compounds (DFP and Cp)[J].Appl Biochem Biotechnol,2015,177(3):624-36.
[13]李文华.毒死蜱降解菌的分离、筛选及其降解条件的优化[D].泰安:山东农业大学,2013.
[14]邓晓,李勤奋,侯宪文,等.乐果降解菌LGX1的筛选及其降解特性研究[J].生态环境学报,2010(5):1 034-1 039.
[15]王金花.毒死蜱降解微生物的筛选及其降解特性研究[D].泰安:山东农业大学,2004.
[16]布坎南RE,吉布斯NE.伯杰细菌鉴定手册[M].中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,第8版.北京:科学出版社,1984:809-821.
[17]魏群.生物化学与分子生物学综合大实验[M].北京:化学工业出版社,2007:8-15.
[18]张丽娜,荣昌鹤,何远,等.常用系统发育树构建算法和软件鸟瞰[J].动物学研究,2013,34(6):640-650.
[19]边拯民.有机磷农药降解酶制剂的制备及效果评价[D].长春:吉林农业大学,2011.
[20]李兴华,罗香文,张德咏,等.红假单胞菌PSB07-26对白菜和土壤中毒死蜱的生物降解[J].安全与环境学报,2014(1):219-221.
[21]于婷,董庆龙,刘嘉芬,等.嗜铁细菌CAS17的分离鉴定及其对毒死蜱的降解特性研究[J].环境科学学报,2014(1):136-142.
[22]黄洁芳.新洋葱伯克霍尔德菌NSM-05对松枯梢病生防作用[D].南京:南京林业大学,2011.
Screening and identification of bacteria for the degradation of residues chlorpyrifos pesticide on fruits and vegetables
MENG Qing-lin, LIANG Jin-zhong*, WANG Feng-qing
(Key Laboratory for Food Science and Engineering, Harbin University of Commerce, Heilongjiang Province, Harbin 150076, China)
ABSTRACTIn order to reduce the chlorpyrifos pesticide residues on fruits and vegetables, a strain with high efficient degrading ability for chlorpyrifos pesticide was isolated from?the arable soil sprayed with organophosphorus pesticide and named DOP-Ma3. Morphology analysis was carried out and the phylogenetic tree was generated by MEGA 6.0 software after comparison with homologous 16S rDNA sequences from GenBank. Results showed that it was closely related to Burkholderia sp. with 99% of 16S rDNA sequence homology. Based on the results of physiological and biochemical identification, the strain was determined as Burkholderia cenocepacia. The degradation rate of DOP-Ma3 was 69.87% for 500 mg/L chlorpyrifos in 48 h. The degrading enzyme was extracellular enzyme. The degradation rate of 10% fermentation broth for 250 mg/L chlorpyrifos was 52.47% after degradation at 35 ℃, pH 7.0 for 30 min. It was proved that this bacteria also possessed the ability to degrade omethoate, cypermethrin, and dipterex.
Key wordschlorpyrifos pesticide; degradation bacteria; soil; isolated; 16S rDNA
收稿日期:2015-11-02,改回日期:2016-01-01
DOI:10.13995/j.cnki.11-1802/ts.201604020
第一作者:硕士研究生(梁金钟教授为通讯作者,E-mail:Ljz2050@126.com)。
