匍枝根霉β-葡糖苷酶的分离纯化及其受产物抑制分析
2016-05-24孙全霞汤斌李松
孙全霞,汤斌,李松
(安徽工程大学 微生物发酵安徽省工程技术研究中心,安徽 芜湖,241000)
匍枝根霉β-葡糖苷酶的分离纯化及其受产物抑制分析
孙全霞,汤斌*,李松
(安徽工程大学 微生物发酵安徽省工程技术研究中心,安徽 芜湖,241000)
摘要对匍枝根霉β-葡糖苷酶进行了纯化并研究了葡萄糖、甘露糖、山梨醇和甘露醇对该酶的抑制作用,结果发现,66.7 mmol/L的葡萄糖和88.9 mmol/L的甘露糖可完全抑制一定酶活力单位的β-葡糖苷酶活力(0.76 IU),而山梨醇和甘露醇对β-葡糖苷酶的催化活力没有影响。分析结构发现,葡萄糖和山梨糖、甘露糖和甘露醇结构差异仅在醛基位置,通过Molegro Virtual Docker(MVD)软件模拟并分析葡萄糖、山梨醇和纤维二糖与β-葡糖苷酶的对接模型,发现含有醛基的葡萄糖与纤维二糖在酶的结合区存在两处竞争性结合位点(Asp244和Asn242),且两者在该酶活性中心内的全部结合位点上均处于竞争性关系,其中葡萄糖的醛基在与多个活性位点结合过程中起主导作用;而不含醛基的山梨醇与纤维二糖在该酶的催化中心及外围均不存在竞争性关系,由此推测可能是葡萄糖分子中的醛基在β-葡糖苷酶受产物抑制的过程中起到了关键性的作用。
关键词分离纯化;β-葡萄苷酶;抑制;醛基
纤维素酶是由内切葡聚糖酶(endoglucanase,EG)、外切葡聚糖酶(cellobiohydrolase enzyme,CBH)和β-葡糖苷酶(β-glucosidase,BG)组成的一种复合酶[1]。内切葡聚糖酶可以随机水解纤维素中的β-1,4-糖苷键[2-3],外切葡聚糖酶可以从还原段或非还原段将纤维素水解成纤维二糖[4],β-葡糖苷酶进一步将纤维二糖水解生成葡萄糖[5],在3种纤维素酶的协同之下使得纤维素最终被水解成可发酵性单糖,在整个水解过程中β-葡糖苷酶是限速酶,是纤维素转化成葡萄糖的一个瓶颈[6]。在实际应用过程中,常常由于终产物(葡萄糖)的积累而引起酶催化产物抑制作用并形成中间产物积累,从而致使纤维素酶系的协同作用效率大幅下降,这也是纤维素酶在生物质能源应用领域存在的一个亟待解决的难题。如,TEUGJAS等人研究发现,葡萄糖的积累抑制了β-葡糖苷酶活性并引起纤维二糖的累积和整个纤维素酶系水解效率的下降[7]。由于β-葡萄苷酶的来源不同,所以其各个方面的性质也都不相同[8-11]。LI等人发现,一种新型的β-葡糖苷酶Bgl1269是目前最耐葡萄糖抑制的β-葡糖苷酶,3.6 mol/L葡萄糖浓度下β-葡糖苷酶竟有70%的酶活力[12];OLSEN等人曾经报道过在0.1 mol/L葡萄糖浓度下β-葡糖苷酶仅有30%的酶活力[13];MAI等人曾经从链霉菌中克隆表达了一种耐盐耐葡萄糖的β-葡糖苷酶BglNH,在0.5 mol/L葡萄糖浓度下β-葡糖苷酶还有60%的酶活力[14];SOPHIE等添加6 mmol/L的pNPG能使葡萄糖对来自第一家族的β-葡糖苷酶AS-Esc10的抑制减少2.5倍,以致在2.5 mol/L以上的葡萄糖浓度才开始对β-葡糖苷酶的活力有抑制作用[15]。
本文从匍枝根霉原菌的发酵液中分离纯化得到β-葡糖苷酶(BGLIII),研究了葡萄糖、山梨醇、蔗糖、甘露醇和甘露糖对BGLIII酶活力的影响并利用Molegro Virtual Docker(MVD)软件分析了葡萄糖对BGLIII抑制的机理。有关β-葡糖苷酶受葡萄糖抑制机理的研究,对定向改造β-葡糖苷酶并解除葡萄糖对β-葡糖苷酶的抑制,提高整个纤维素酶的催化效率有着重要的意义。
1材料
1.1菌株
匍枝根霉TP-02(RhizopusstoloniferTP-02)由本实验室保存;稻草、豆渣、硫酸铵、KH2PO4、MgSO4、CaCl2、Tween-80购于国药集团(分析纯);透析袋、0.15 nm滤膜购于上海Sangon公司;DEAE-Sepharose FF阴离子交换层析柱、CM-Sepharose FF阳离子交换层柱、Sephadex G-100购于GE公司。
2实验方法
2.1酶活测定
根据参考文献[16]对纤维素酶活性进行测定。纤维素酶活力单位定义:适当催化条件下,每分钟水解生成1 μmol葡萄糖所需的酶量为1个酶活力国际单位(IU)。
2.2蛋白质浓度测定
采用Brandford方法[17],标准蛋白为牛血清蛋白。
2.3纤维素酶系的分离纯化
匍枝根霉上罐(上海宝兴生物设备公司,BIOFECH-10TSA,10 L)发酵78 h后,利用硫酸铵沉淀、G-100凝胶层析柱、DEAE-Sepharose FF阴离子交换层析、CM-Sepharose FF阳离子交换层析柱等分离方法从发酵液中分离纯化BGLⅢ。
2.4BG水解底物产生的葡萄糖量
取12根比色管,添加BGLⅢ到比色管中(0.76 IU),加入1 mL水杨甘,用柠檬酸-柠檬酸钠缓冲液(0.05 mol/L,pH 4.8)定容到2 mL反应体系,50 ℃下分别反应10~120 min(每隔10 min取1根比色管),采用DNS法[18]测量还原糖的量。对照组除了将等量的酶灭活10 min外,其他条件相同。
2.5糖和醇对β-葡萄糖苷酶的影响
在比色管中添加BGLⅢ(0.76 IU)后再分别添加葡萄糖、蔗糖、山梨醇、甘露醇和甘露糖使反应体系中葡萄糖、蔗糖、山梨醇、甘露醇和甘露糖的浓度为0~100 mmol/L,用柠檬酸-柠檬酸钠缓冲溶液(0.05 mol/L,pH 4.8)定容为2 mL反应体系,然后反应30 min,测量酶活力的变化。对照组除了将等量的酶后灭活10 min以外,其他条件相同。
2.6MVD模拟分析
通过MVD软件进行同源建模,分子对接。分析关键氨基酸与葡萄糖、山梨醇和纤维二糖之间的作用关系。
3结果和分析
3.1纤维素酶系的纯化
经过硫酸铵沉淀、SephadexG-100凝胶层析柱、DEAE-SepharoseFF阴离子交换层析柱、CM-SepharoseFF阳离子交换层析柱4步骤分离法,得到电泳纯的BGLⅢ(图1)。如图1,泳道1是纯化后得到的BGLⅢ,分子质量为70 kDa左右。

1-CM-SepharoseFF阳离子交换层析柱后的BGLIII;2-DEAE-SepharoseFF阴离子交换层析柱收集样品;3-Sephadex G-100 凝胶过滤层析柱后的样品;4-酸铵沉淀后的样品图1 目的蛋白SDS-PAGE图Fig.1 Results of SDS-PAGE
3.2不同时间内BGLⅢ水解底物产生的葡萄糖量

图2 BGLⅢ水解底物产生的葡萄糖Fig.2 The glucose produced by BG hydrolysis the substrate
测量BGLⅢ在10~140 min内水解水杨甘产生的葡萄糖浓度。由图2可知,葡萄糖质量浓度小于4.5 mg/mL时,BGLⅢ水解水杨甘产生的葡萄糖质量浓度不断增加,但随着葡萄糖质量浓度的上升,BGLⅢ水解水杨甘的速度有所下降,当葡萄糖达到4.5 mg/mL时,葡萄糖的质量浓度不再增加。将反应60 min时的水解液(葡萄糖质量浓度为4.5 mg/mL)用柠檬酸-柠檬酸钠缓冲液(0.05 mol/L,pH 4.8)稀释1倍(葡萄糖质量浓度为2.23 mg/mL)后再反应20 min后测葡萄糖浓度,发现葡萄糖的质量浓度又增加到了4.45 mg/mL。对比这两个阶段的试验,推测第一阶段试验里面,葡萄糖质量浓度不再增加是由于葡萄糖浓度过高引起产物的反馈抑制。3.3糖和醇对BGLⅢ的影响
配置不同浓度的糖和醇,研究它们对BGLⅢ酶活力的影响并比较这些糖和醇在结构上的差异。根据图3得出,葡萄糖、山梨糖对BGLⅢ酶活力有很强的抑制作用,在糖浓度为66.7~88.9 mmol/L时,BGLⅢ的酶活力完全丧失;山梨醇、甘露醇和蔗糖对BGLⅢ的水解效率没有影响。如图4分析这两种糖和两种醇的结构,发现葡萄糖的醛基位置加氢还原形成山梨醇;甘露糖的醛基位置加氢还原形成甘露醇,因此它们的结构差异仅仅在于糖的醛基位置。虽然它们在结构上有细微差异但是对BGLIII酶活力的影响却有截然不同的影响,因此我们推测在抑制的过程中葡萄糖和甘露糖的醛基起到了主要的作用。
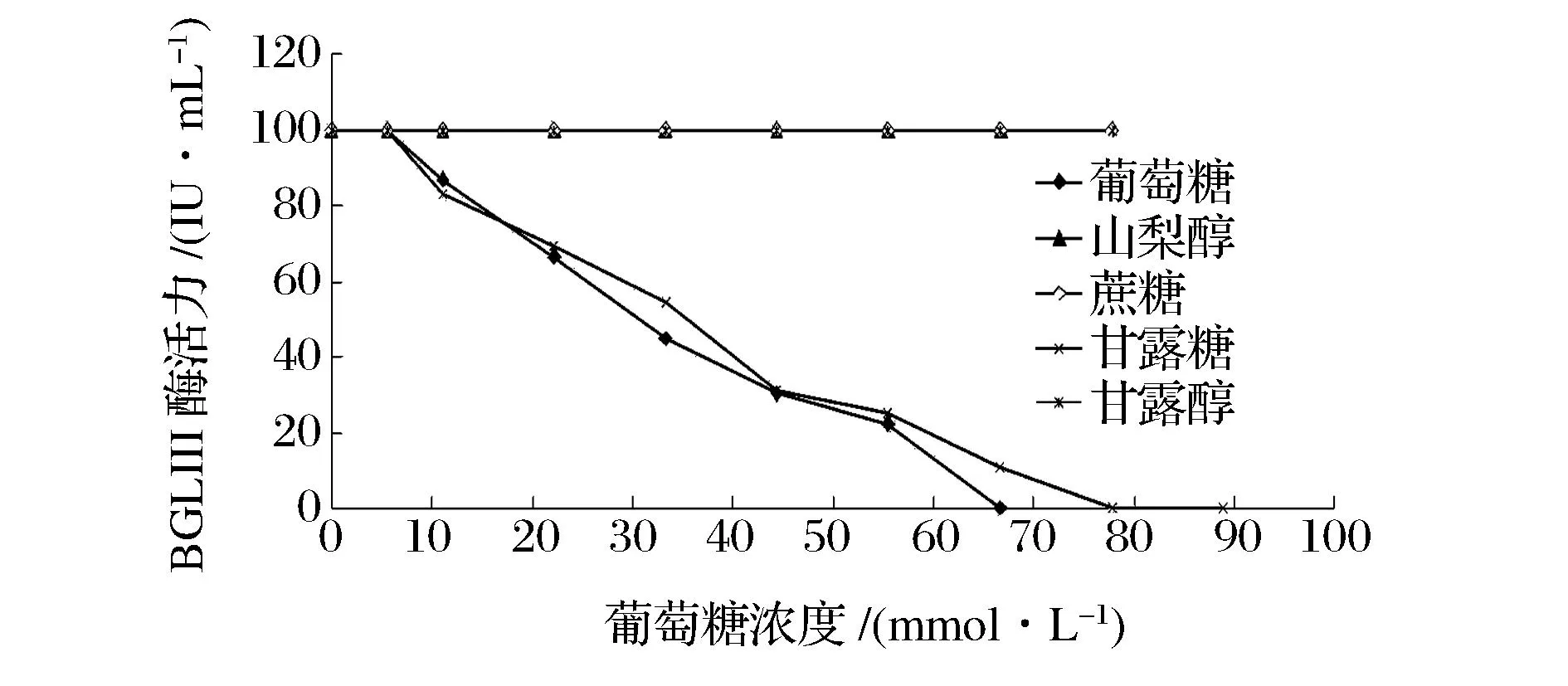
图3 糖和醇对BGLⅢ酶活力的影响Fig.3 Effect of sugar and alcohol on the activity of BGLⅢ
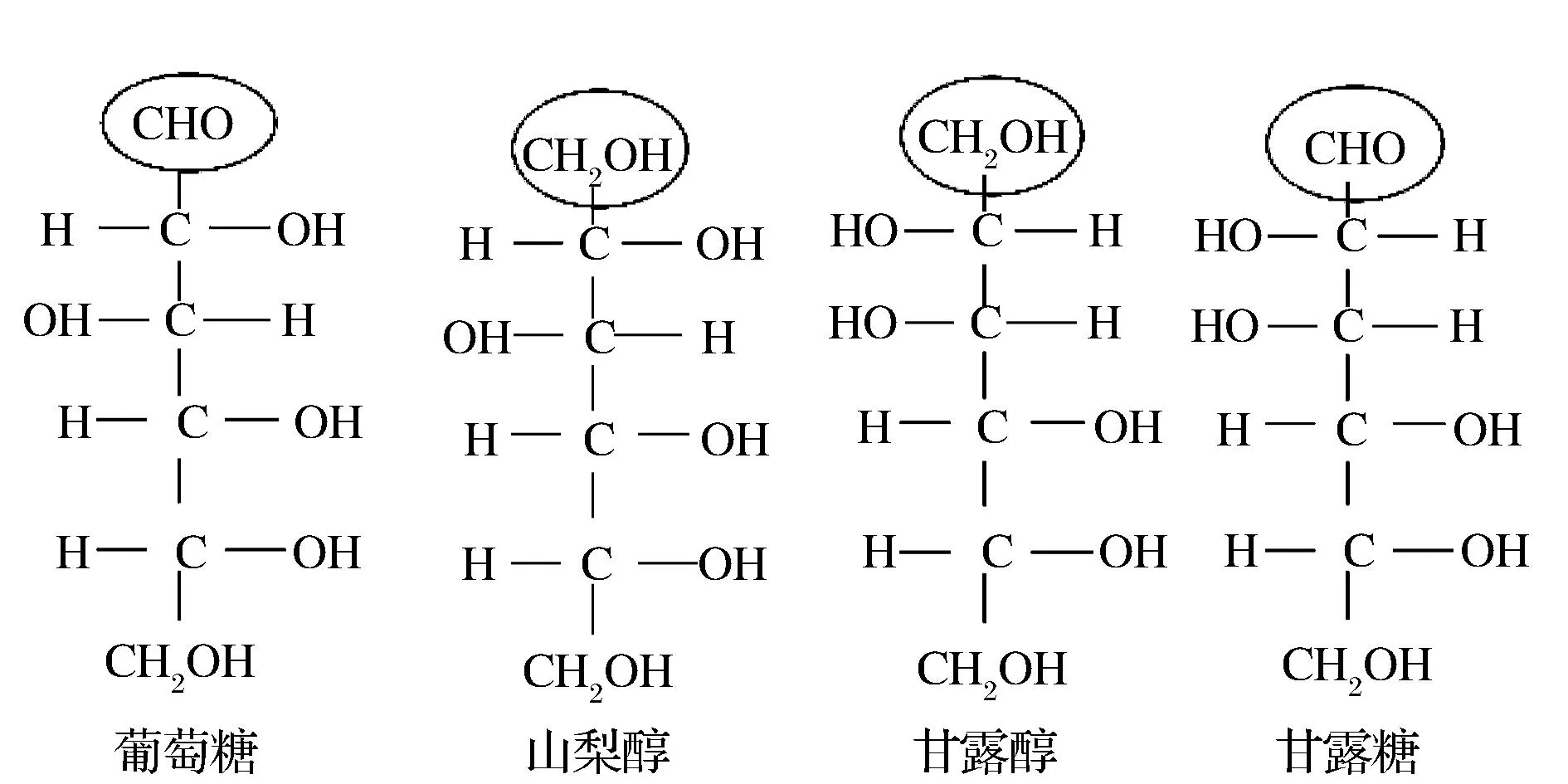
图4 糖和醇的结构Fig.4 The structure of sugar and alcohol
3.4机理分析
3.4.1BGLⅢ结合区的对接分析
利用MVD软件分析葡萄糖对BGLⅢ抑制原因,模拟BGLⅢ在结合区与葡萄糖、纤维二糖、山梨醇的对接模型。
通过对接结果和查阅文献推断此处为底物和BGLⅢ的结合区域。对接结果显示BGLⅢ的活性区域呈口袋结构,这与大多数报道的β-葡糖苷酶的活性区域一致,即底物进入活性中心及产物排出都需经过此入口。由图5-a可知,纤维二糖在结合区结合的位点有Asn242,Gly243,Lys263,Asp244等,氢键整体作用力的方向指向活性中心,由此推测纤维二糖在此处的结合是使其更好的进入活性中心内部;葡萄糖在结合区的结合位点有Asp244,Tyr313,Tyr315,Tyr173,Asn242,与葡萄糖的醛基结合的位点有Asp244,Tyr313,Tyr315,其中Asp244也是与纤维二糖竞争性结合的位点。葡萄糖在此处的结合不仅阻止纤维二糖进入活性中心也同时导致了活性中心内水解产生的葡萄糖无法流出,造成活性中心内部葡萄糖的累积,加大了活性中心内部葡萄糖和纤维二糖竞争结合活性位点的能力。
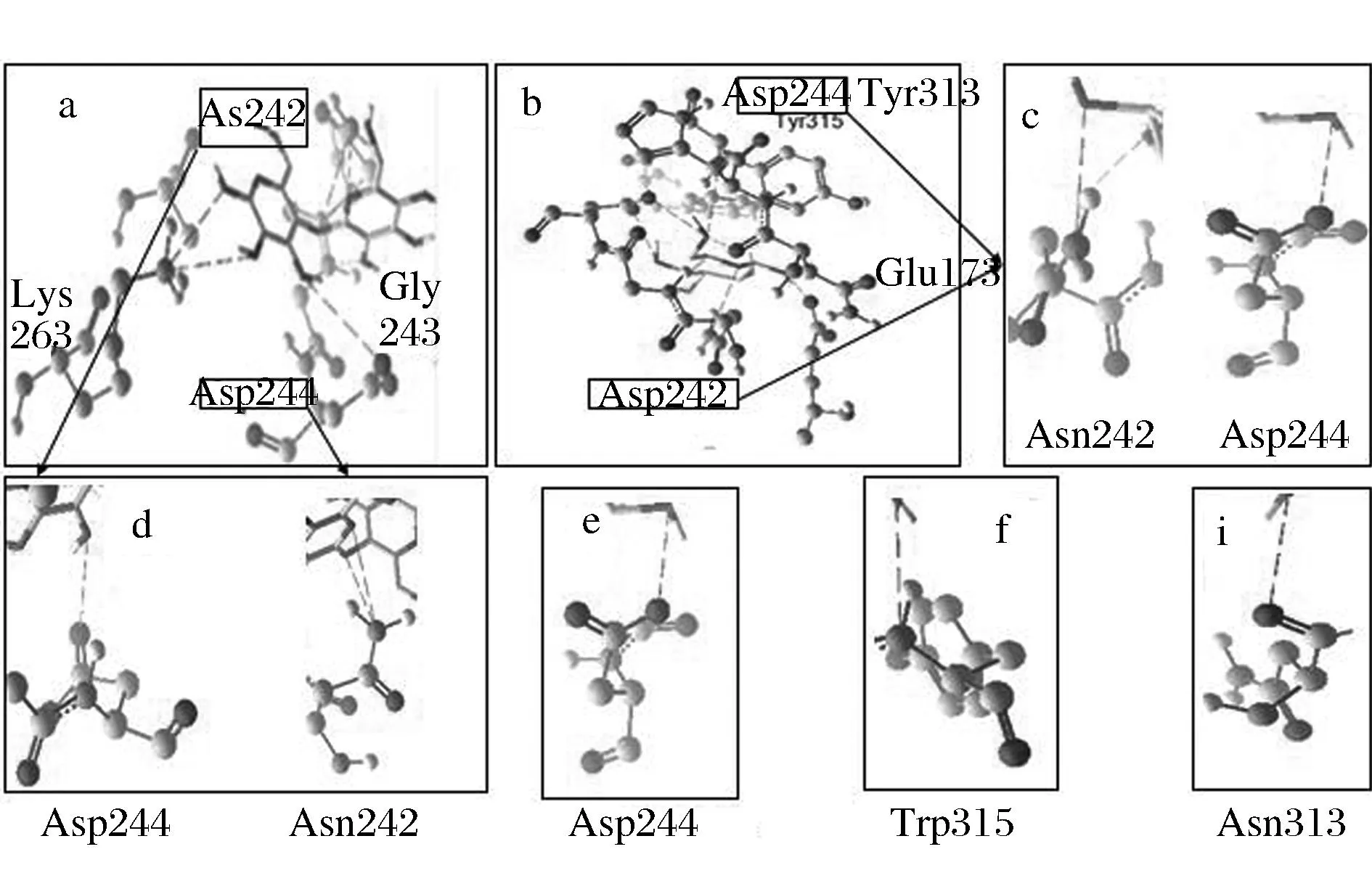
a-纤维二糖与BGLⅢ对接模型;b-葡萄糖与BGLⅢ对接模型;c、d-纤维二糖与葡萄糖竞争性结合的位点;e~i-葡萄糖的醛基结合的位点图5 BGLⅢ结合区的分子对接示意图Fig.5 The docking result of BGLⅢ in bining site
3.4.2BGLⅢ活性中心对接分析
利用MVD软件对BGLⅢ同源建模,模拟活性中心。利用纤维二糖、葡萄糖、山梨醇与BGLⅢ进行对接,模拟在活性中心处与三者作用的氨基酸并分析葡萄糖对BGLⅢ的抑制机理。
由图6-b可知,在活性中心与纤维二糖相互作用的氨基酸有Asn172, His126,Tyr315, Glu384,Glu441,Gln23,Thr442等。由图6-a可知,在活性中心处与葡萄糖相互作用的氨基酸有Cys176,Asn172,Glu173,His126,Tyr315,Trp356, Glu384,Glu441等,葡萄糖与纤维二糖作用的氨基酸几乎相同,因此在活性中心处葡萄糖和纤维二糖是竞争性结合活性位点造成了BGLⅢ的活性受到抑制。对比图6-d、e、f和图6-c可知,与葡萄糖结合的8种氨基酸过程中,Glu384、His126、Asn172和Glu173都与葡萄糖的醛基相互作用,而山梨醇与纤维二糖既没有竞争性结合活性位点,结合的位置对BGLⅢ的活性中心也没有造成堵塞,因此对酶活力没有造成影响。根据以上分析,我们得出在葡萄糖对BGLⅢ的抑制过程中,葡萄糖的醛基和BGLⅢ有很强的结合力对抑制起到了决定性的作用。

a-葡萄糖与BGLⅢ对接模型;b-纤维二糖与BGLⅢ在处对接;c-山梨醇与BGLⅢ在处对接;d~g-葡萄糖的醛基在活性中心处结合的氨基酸图6 BGLⅢ活性中心分子对接示意图Fig.6 The docking result of BGLⅢ in active site
4讨论
本文使用了4步骤分离法对匍枝根霉TP-02发酵液中的BGLⅢ进行分离纯化,得到了纯度较高的BGLⅢ,采用此分离技术的优点在于可以利用蛋白质性质的不同以及梯度洗脱的方式除去杂蛋白,更好的保留目的蛋白。在过G-100凝胶层析柱时,由于时间过长,对酶活损伤较大,我们采用了多次上样、收集和浓缩的方式保证有较高的酶活做进一步纯化。目前对纤维素酶活性抑制的研究主要集中在里氏木霉和黑曲霉的研究,在匍枝根霉中很少有报道。通过MVD软件模拟分析得出葡萄糖在BGLⅢ结合区和活性中心与纤维二糖都存在竞争性结合。在葡萄糖的结合位点中,进一半位点与葡萄糖的醛基相结合,由此可见葡萄糖的醛基和BGLⅢ有很强的结合能力,而山梨醇结合的位置和位点对酶的催化活性均无影响,由此我们得出葡萄糖是通过醛基将自身锚定在结合区以及活性中心内部,即阻止了纤维二糖进入活性中心也造成了活性中心内水解产生的葡萄糖无法流出,加大了葡萄糖在活性中心内与纤维二糖的竞争性结合能力,在抑制过程中起到了决定性的作用。我们认为在抑制的过程中葡萄糖在结合区的结合对酶活性的影响更强。下一步可以突变结合区的位点消除葡萄糖在入口处的结合,或者增加活性中心入口处的大小让产物更好的流出活性中心,减少葡萄糖对BGLⅢ的抑制。
参考文献
[1]BHAT M K.Cellulases and related enzymes in biotechnology[J].Biotechnology Advances,2000,18(5):355-383.
[2]LIU Hao,FU Shi-yu,ZHU J Y,et al.Visualization of enzymatic hydrolysis of cellulose using AFM phase imaging[J].Enzyme and Microbial Technology,2009,45(4):274-281.
[3]DAVIES G,HENRISSAT B.Structures and mechanisms of glycosyl hydrolases[J].Structure,1995,3(9):853-859.
[5]BUNTERNGSOOK B,MHUANTONG W,CHAMPREDA V,et al.Identification of novel bacterial expansins and their synergistic actions on cellulose degradation[J].Bioresour Technol,2014,159:64-71.
[6]SAHA B C,BOTHAST R J.Production,purification,and characterization of a highly glucose-tolerant novel β-glucosidase fromCandidapeltata[J].Appl Environ Microbiol,1996,62(9):3 165-3 170.
[8]DECKER C H,VISSER J,SCHREIER P.β-glucosidases from five blackAspergillusspecies:study of their physicochemical and biocatalytic properties[J].Journal of Agricultural and Food Chemistry,2000,48(10): 4 929-4 936.
[9]GÜNATA Z,VALLIER M.Production of a highly glucose-tolerant extracellular β-glucosidase by threeAspergillusstrains[J].Biotechnology Letters,1999,21(3):219-223.
[10]JOB J,SUKUMARAN R K,JAYACHANDRAN K.Production of a highly glucose tolerant β-glucosidase byPaecilomycesvarieties’MG3:optimization of fermentation conditions using Plackett-Burman and Box-Behnken experimental designs[J].World Journal of Microbiology and Biotechnology,2010,26(8):1 385-1 391.
[11]RIOU C,SALMON J M,VALLIER M J,et al.Purification,characterization,and substrate specificity of a novel highly glucose-tolerant β-glucosidase fromAspergillusoryzae[J].Applied and Environmental Microbiology,1998,64(10): 3 607-3 614.
[12]LI G,JIANG Y,FAN X,et al.Molecular cloning and characterization of a novel β-glucosidase with high hydrolyzing ability for soybean isoflavone glycosides and glucose-tolerance from soil metagenomic library[J].Bioresource Technology,2012,123:15-22.
[13]NYMAND OLSEN S,BORCH K,CRUYS-BAGGER N,et al.The role of product inhibition as a yield-determining factor in enzymatic high-solid hydrolysis of pretreated corn stover[J].Applied Biochemistry and Biotechnology,2014,174(1):146-155.
[14]MAI Z,YANG J,TIAN X,et al.Gene cloning and characterization of a novel salt-tolerant and glucose enhanced β-glucosidase from a marine streptomycete[J].Applied Biochemistry and Biotechnology,2013,169(5):1 512-1 522.
[15]BIVER S,STROOBANTS A,PORTETELLE D,et al.Two promising alkaline β-glucosidases isolated by functional metagenomics from agricultural soil including one showing high tolerance towards harsh detergents,oxidants and glucose[J].Journal of Industrial Microbiology & Biotechnology,2014,41(3): 479-488.
[16]GHOSE T K.Measurement of cellulose activities[J].Pure Appl Chem,1987,59(2):257-268.
[17]杨海泉.碱性淀粉酶的异源表达及分子改造[D].无锡:江南大学,2013:13-15.
[18]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reduce sugar[J].Anal Chem,1959,31(3):426-428.
Purification of a β-glucosidase fromRhizopusstoloniferand analysis on its product inhibition
SUN Quan-xia, TANG Bin*, LI Song
(Anhui Polytechnic University,Engineering Technololy Research Center of Anhui Microbial Fermentation,Wuhu 241000,China)
ABSTRACTβ-glucosidase was purified from Rhizopus stolonifer. Its inhibition by glucose, mannose, sorbitol and mannitol was studied. The results showed that 66.7 mmol/L glucose and 88.9 mmol/L mannose could completely inhibit the activity of 0.76 IU β-glucosidase, while the sorbitol and mannitol had no effect on the catalytic activity of β-glucosidase. Structure disparity of these sugars and polyols was located in the aldehyde group. Molegro Virtual Docker(MVD) was used to simulate the docking model of glucose, sorbitol and cellobiose with the β-glucosidase. It was found that glucose and cellobiose had two competing binding sites (Asp244 and Asn242) in the substrates binding region, and a competitive relationship was found in active regions of these two molecules. The aldehyde group of glucose played a leading role in the process of combination with active sites. However, sorbital and cellobiose displayed noncompetitive relationship in the catalytic center and binding region of β-glucosidase. It indicated that the aldehyde group played a key role in the product inhibition of β-glucosidase by glucose.
Key wordsseparation and purification; β-glucosidase; inhibition; aldehyde group
收稿日期:2015-09-26,改回日期:2015-12-07
基金项目:国家自然科学基金(31270135)
DOI:10.13995/j.cnki.11-1802/ts.201604019
第一作者:硕士研究生(汤斌教授为通讯作者,E-mail:tangbin@ahpu.edu.cn)。
