远东拟沙丁鱼酶解产物的降血压效果评价及其ACE抑制肽的分离纯化与鉴定
2016-05-24王晶晶吉薇吉宏武苏伟明李亚会刘书成
王晶晶,吉薇,吉宏武,2,3,4*,苏伟明,2,3,4,李亚会,刘书成,2,3,4
1(广东海洋大学,食品科技学院,广东 湛江,524088) 2(广东省水产品加工与安全重点实验室,广东 湛江,524088) 3(水产品深加工广东普通高校重点实验室,广东 湛江,524088) 4(广东省海洋食品工程技术研究中心,广东 湛江,524088 )
远东拟沙丁鱼酶解产物的降血压效果评价及其ACE抑制肽的分离纯化与鉴定
王晶晶1,吉薇1,吉宏武1,2,3,4*,苏伟明1,2,3,4,李亚会1,刘书成1,2,3,4
1(广东海洋大学,食品科技学院,广东 湛江,524088)2(广东省水产品加工与安全重点实验室,广东 湛江,524088) 3(水产品深加工广东普通高校重点实验室,广东 湛江,524088)4(广东省海洋食品工程技术研究中心,广东 湛江,524088 )
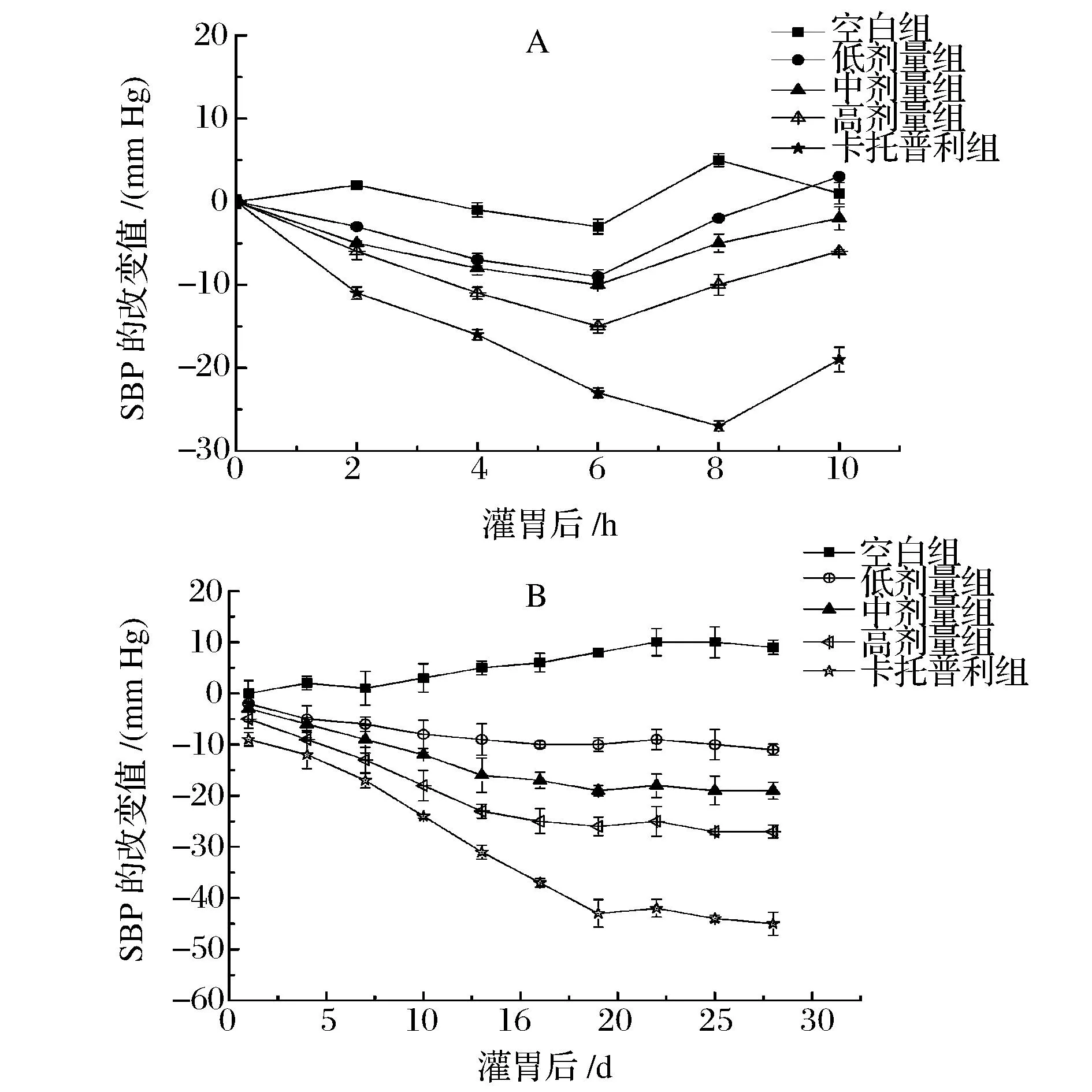
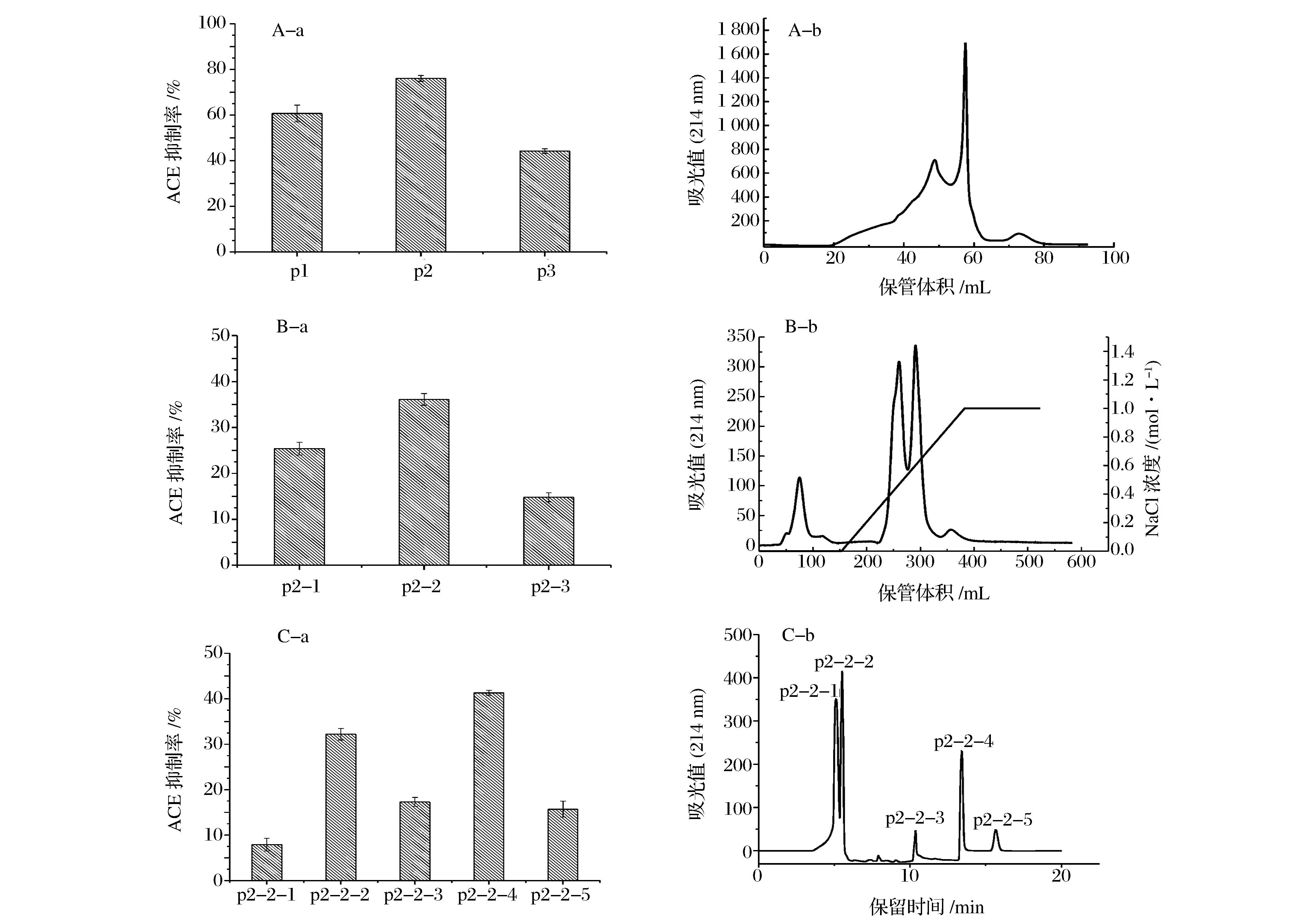
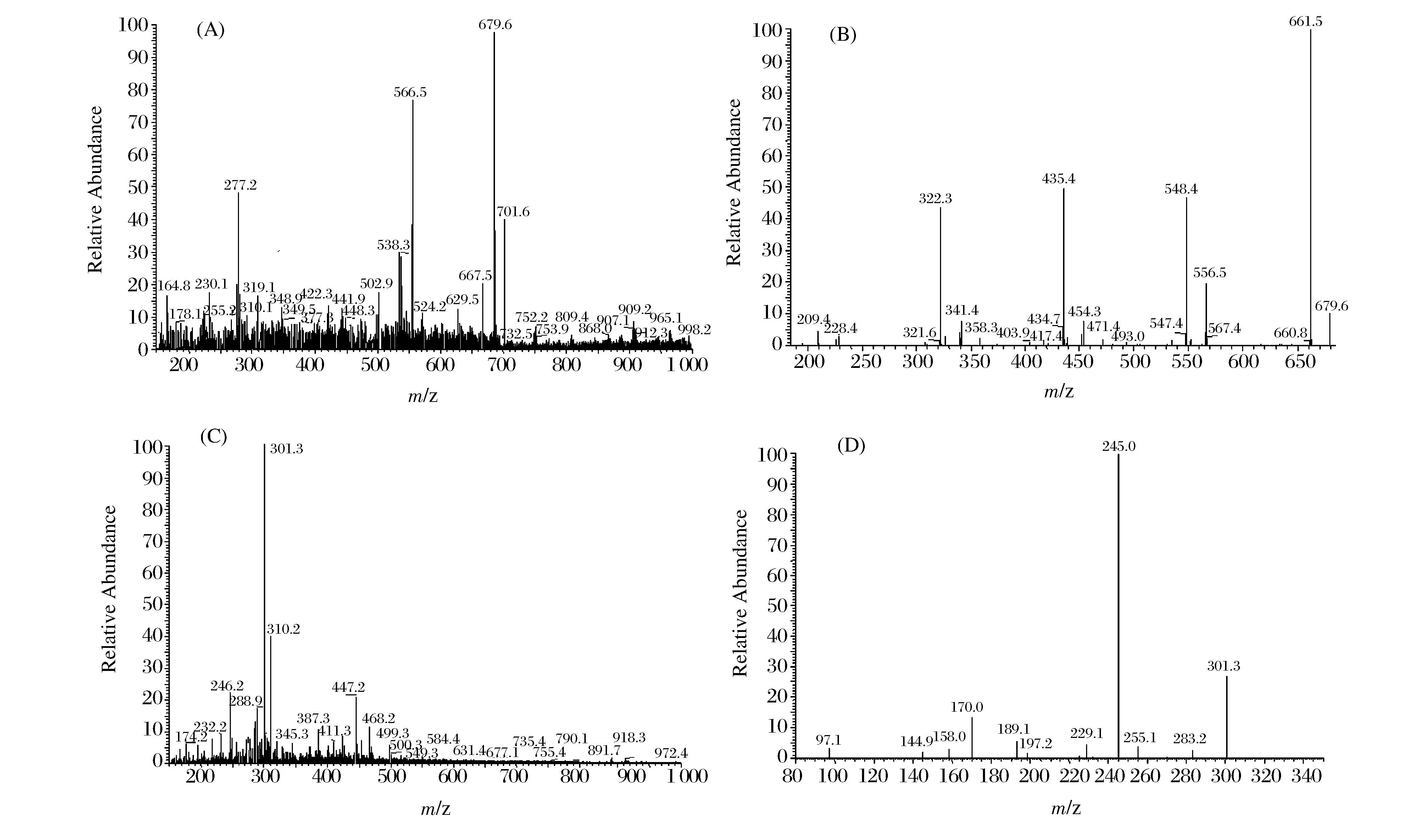
摘要以远东拟沙丁鱼肌肉为原料,采用动物蛋白水解酶和风味蛋白酶联合水解制备其酶解产物(简称为SMMH),SMMH通过截留分子量分别为10 kDa和3 kDa超滤膜进行分离,获得3个组分,分别称为A(MW>10 kDa)、B(3 kDa 关键词远东拟沙丁鱼;酶解产物;血管紧张素转移酶(ACE)抑制肽;原发性高血压大鼠;分离纯化 高血压是一个主要公共健康问题,它几乎影响了将近全世界1亿的人口[1]。研究表明,血压水平和患一些心血管疾病(如动脉硬化、中风和心肌梗塞)的风险有直接关系[2]。肾素-血管紧张素-醛固酮系统(RAS)是调节机体血压正常、体液平衡主要的激素系统,而其中血管紧张素转移酶(angiotensin-converting enzyme,ACE)在这个系统中扮演一个重要的角色。ACE是一种位于细胞膜上的Zn2+依赖型羧二肽酶,它不仅使血管紧张素I转变成血管紧张素II,而且还抑制了一种血管扩张肽(缓激肽)的活性,这导致高血压[3]。因此,抑制ACE活性是一种很好治疗高血压的方式之一。目前,许多人工合成的ACE抑制剂能够有效的治疗高血压(如卡托普利、赖诺普利、福辛普利、西拉普利),虽然这些合成的ACE抑制剂能够有效降低血压,但它们同时也带来一些负面影响(如头痛、咳嗽、眩晕、疲劳和腹泻)[4-5]。由于这些负面影响,近年来人们越来越青睐于食源性的ACE抑制肽。 自从,FERREIRA[6]首次从巴西蝮蛇蛇毒分离出ACE抑制肽后,紧接着人们从许多食物蛋白中分离出抗血压组分,如明胶[7]、牛奶[8]、玉米[9]等。近年来,由于海洋蛋白对促进健康、减少疾病风险的影响以及其丰富的氨基酸结构,越来越多的人们关注来源于海洋蛋白中的ACE抑制肽[10-13]。 我国东南沿海拥有丰富的远东拟沙丁鱼,其生长快、繁殖力强、价值低,食用后具有疏通血管、控制血压升高、免患血栓病等功效,但由于鱼的肉质嫩、脂肪含量高、酶活性强,容易腐败变质,难以保鲜。目前,远东拟沙丁鱼大多被加工成饲料、肥料,少部分制成罐头,资源附加值低[14]。为了提高远东拟沙丁鱼的附加值,本研究采用酶解方法对其肌肉进行水解,评价其酶解产物降血压效果,分离纯化ACE抑制肽,并进行结构解析,以期为远东拟沙丁鱼开发降血压肽保健食品提供基础数据和技术支撑。 1材料和方法 1.1材料与试剂 远东拟沙丁鱼(Sardinops sagax),购买于湛江市东风市场;9周龄雄性 SHR 大鼠(购自北京维通利华实验动物技术有限公司,体重220~240 g,收缩压≥180 mmHg);动物蛋白水解酶、风味蛋白酶由南宁庞博试剂公司提供;ACE 、马尿酰 - 组氨酰 - 亮氨酸 (N-Hippuryl-His-Leu,HHL)购买于美国 Sigma-Aldrich 公司产品 ;丙烯葡聚糖凝胶(Sephacryl S-100 High resolution)、快流速Q琼脂糖凝胶(Q-Sepharose Fast Flow),美国GE公司;乙腈(色谱纯),其余试剂为国产分析纯。 1.2仪器与设备 冷冻干燥机(CCA-1111),东京理化; 旋转蒸发仪(FDU-1100),东京理化;BP-98A无创血压计,日本Softron; LTQ Orbitrap Elite质谱仪,美国Thermo Fisher公司。 1.3远东拟沙丁鱼肌肉酶解产物的制备 工艺流程:远东拟沙丁鱼→前处理→酶解→灭酶→离心→脱色、苦味(珍珠岩)→脱油→过陶瓷膜(50 nm)→超滤→反渗透→旋转蒸发→冷冻干燥→远东拟沙丁鱼低聚肽。 将新鲜的远东拟沙丁鱼去头、内脏、骨头,然后用蒸馏水清洗、打浆。在适宜的酶解条件下反应3 h(动物蛋白水解酶0.5%、风味酶0.1%,温度50 ℃ ,自然pH),之后在90 ℃下灭酶15 min,4 000 r/min离心,同时加入珍珠岩脱色、脱苦味。取上清液于管式离心机中脱油,然后通过陶瓷膜(50 nm)微滤,渗透液通过10 kDa和3 kDa的超滤膜将获得3个组分,分别为A (MW>10kDa)、B(3kDa 1.4ACE抑制活性的测定 ACE抑制活性测定方法参考文献[15]的方法。HPLC色谱条件:SymmetryC18分析型色谱柱 (5μm,4.6mm×250mm);检测波长:228nm;流速:1mL/min;流动相A:水(含0.05% 三氟乙酸 );流动相B:乙腈(含0.05% 三氟乙酸 );进样量:10μL;柱温:25 ℃;洗脱条件:V(B)∶V(A)=25∶75。ACE抑制率根据公式(1)计算: (1) 式中:A1为未加入样品组中马尿酸的峰面积,mAU·s;A2为加入样品组中马尿酸的峰面积,mAU·s。 IC50的定义为在一定条件下抑制ACE酶活性一半时所需要的抑制剂浓度。由于抑制率与制剂浓度之间不是一个线性的关系,因此必须首先绘制抑制剂浓度与抑制率关系的曲线,再从曲线上查出IC50。所有的结果都进行了3次重复测量。 1.5组分C(MW<3000Da)对原发性高血压大鼠的降压效果 实验共分5组,每组原发性高血压大鼠6只,分别关在5个不同的笼子里,并放置于室温24 ℃的SPF动物房内(广东省海洋大学SPF级实验动物房,No:SYXK2014-0053),采用标准实验饲料和饮水喂养1周后开始实验,空白对照组只灌胃蒸馏水;阳性对照组灌胃卡托普利,剂量是5mg/kg(b.w);高、中、低剂量组灌胃组分C,剂量分别为500、1000 和 1500mg/kg(b.w)。短效实验测定灌喂后0、2、4、6、8和10hSHRs大鼠的收缩压(SBP),长效实验测定0、3、6、9、12、15、18、21、24、27dSHRs大鼠的收缩压(SBP),利用BP-98A无创血压计测量老鼠收缩压(SBP)。 1.6ACE抑制肽的分离纯化 首先将组分C通过丙烯葡聚糖凝胶柱(1.6cm×34cm)分离,分离条件:质量浓度5mg/mL;缓冲液为蒸馏水;流速为1mL/min;上样体积2mL;波长214nm。然后将活性最高的组分通过快流速Q琼脂糖凝胶柱(2.6cm×12cm)进一步分离,分离条件:质量浓度1.5mg/mL;50mmol/Ltris缓冲液(pH=9.5);流速为5mL/min;上样体积10mL;波长214nm。最后将活性最高的组分在通过反向高效液相进一步分离,色谱条件:色谱柱YMC-PackODS-AQC18柱(5μm);流动相A乙腈、B超纯水;5%~20%B梯度洗脱20min;进样流速1mL/min,进样量20μL;检测波长:214nm。将各级分离收集的样品旋转蒸发、冷冻干燥并测定每个组分的ACE抑制率。 1.7ACE抑制肽的鉴定 采用美国ThermoFisher公司的LTQOrbitrapElite质谱仪对RP-HPLC分离得到的两个ACE抑制率较高的级份进行氨基酸序列鉴定。质谱条件:离子方式为ESI+、喷雾电压:+ 3.0kV、源加热温度:200 ℃、毛细管温度:300 ℃、鞘气流速:30arb、辅助气流速:5arb。 2结果与分析 2.1远东拟沙丁鱼酶解产物不同超滤组分的体外ACE抑制活性 远东拟沙丁鱼酶解产物与3个超滤组分的ACE抑制活性如图1所示。从图1可以看出,在质量浓度为2mg/mL时,组分B和C都比原酶解液的ACE抑制率高,而组分A比原酶解液的ACE抑制率低,其中组分C显示最强的ACE抑制率为71.4%。这主要是因为ACE抑制肽一般由2~12个氨基酸残基组成,分子质量大多低于1.5kDa[16]。这一结果和LeiDu研究可口囊星虫水溶性蛋白通过超滤分ACE抑制活性相一致[17]。因此,组分C将进一步研究。 图1 远东拟沙丁鱼酶解产物与3个超滤组分的ACE抑制活性Fig.1 The ACE inhibitory activity of 3 ultrafiltered fractions and Sardinops melanosticta muscl hydrolysate 2.2远东拟沙丁鱼超滤组分C(MW<3 000 Da)对原发性高血压大鼠的降压效果 组分C的降压效果通过测定SHRs大鼠收缩压的改变来评估。在一次灌胃SHRs大鼠之后,SHRs大鼠在10 h之内收缩压的变化如图2-A所示。 图2 SHRs大鼠在灌胃超滤组分C之后收缩压(SBP)的变化。Fig.2 Change of systolicblood pressure (SBP) after oral administration of the fraction C from SMMH (显著性差异在P<0.05) 由图2可知,与空白对照组相比,灌胃不同剂量组分C前6 h之内SHRs大鼠的收缩压都有显著降低(P<0.05),其中灌胃剂量为1 500 mg/kg (b.w)能够最大幅度的降低SHRs大鼠的收缩压,并且在第6 h能够降低最大值为13 mmHg ,然而,在10 h后降低收缩压的现象几乎消失。组分C的短期降血压的规律和文献报道的相一致[18]。为了进一步探索组分C的降压效果,连续灌胃28 d(每天灌胃1次)SHRs大鼠,各组SHRs大鼠的收缩压变化如(图2-B)所示,与空白对照组相比,灌胃组分C后对SHRs大鼠收缩压具有显著降低作用(P<0.05),并且随着灌胃剂量的增加,SHRs大鼠收缩压降低值越大,这表明组分C有较强的降血压效果。与阳性对照组相比,灌胃组分C对SHRs大鼠收缩压的降低作用不如其显著(P<0.05),这可能是因为组分C是一种混合物,含有一些非降血压成分,而Captopril是一种人工合成的降血压药物。这一结果与王茵等评价了紫菜酶解产物对SHRs大鼠的长期降血压效果相一致[19]。虽然组分C的降血压作用不如Captopril效果明显,但它具有天然、安全、无毒副作用等优点,可作为抗高血压保健品的基本原料。 2.3ACE抑制肽的分离纯化 图3显示了不同分离步骤的色谱图与各级份的体外ACE抑制率。从图3-A-a可以看出,组分C经丙烯葡聚糖凝胶柱分为3个级份,分别称为p1、p2、p3,各级份的ACE抑制率如图3-A-b所示,其中 p2的ACE抑制率最高为76.1%,并且测定它的IC50值是0.758 mg/mL。p2通过快流速Q琼脂糖凝胶柱进一步分离,又分成了3个级份(图3-B-a), 分别称为p2-1、p2-2、p2-3,各级份的ACE抑制率如图3-B-b所示,其中p2-2显示最强的ACE抑制率为36.2%,并测定其IC50值是0.153 mg/mL。级份p2-2通过反向高效液相 C18分析柱进一步分离得到5个主要的级份(图3-C-a),分别为p2-2-1、p2-2-2、p2-2-3、p2-2-4、p2-2-5,其中,级份p2-2-2和p2-2-4显示最强,它们的ACE抑制率分别为34.1%和41.6%,IC50值分别是8.3和6.9 μg/mL。 2.4ACE抑制肽的鉴定 图4显示了级份p2-2-2(图4-A)和级份p2-2-4(图4-C)的ESI/MS的一级质谱图,由图可知,级份p2-2-2和p2-2-4主要成分分子离子峰的质量分别为679.6 Da和301.3 Da,然后选取这两种分子离子峰通过MS/MS二级质谱分析其氨基酸序列(图4-B,图4-C)。由于b系列和y系列离子在二级质谱中的峰强相对较高,根据这些离子片段质谱信息,手工推断p2-2-2和p2-2-4的氨基酸序列分别为Lys-Val-Glu-Pro-Leu-Pro和Pro-Ala-Leu。 CHANG-BUM[16]报道了ACE抑制肽一般是由2~12氨基酸残基组成,级份p2-2-2和p2-2-4分别是由3肽和6肽组成,这与该文献报道的具有一致性。ACE抑制肽的构效关系研究颇多,但尚无一致结论。CHEUNG[20]报道,当ACE抑制肽的C末端是 Pro或芳香族氨基酸残基(Tyr、Phe、Trp) 及N末端是Pro或疏水性氨基酸残基(Val、 Leu、Ile)时,其具有显著的ACE抑制活性,而C末端残基在结合ACE活性位点时占主导地位。本研究获得的级份p2-2-2的C末端是Pro,级份p2-2-4的N末端是Pro,符合上述规律。 图3 组分C经丙烯葡聚糖凝胶(S-100)柱、快流速Q琼脂糖凝胶(QFF)阴离子交换柱和反向高效液相C18柱分离色谱图及各组分的ACE抑制率Fig.3 The purification step for the fraction C on a Sephacryl 100 gel filtration column, Q-Sepharose Fast Flow anion-exchange column and rereverse phase HPLC . The ACE inhibitory activity of separated fractions were measured(b) 3结论 远东拟沙丁鱼是南海大宗低值鱼类,其酶解产物均具有一定的ACE抑制活性,分子质量越低,ACE抑制率越大。小于3 000 Da的酶解产物对SHRs大鼠的压具有明显的降低功效其降血压的主要成分为2种ACE抑制肽,它们的氨基酸序列分别为 Lys-Val-Glu-Pro-Leu-Pro(IC50=22.9 μmol/L)和 Pro-Ala-Leu(IC50=12.2 μmol/L)。这一研究结果暗示,远东拟沙丁鱼酶解产物可以作为降血压保健食品的功效性基料。 参考文献 [1]WOLF-MAIER K,COOPER R,BANEGAS J,et al. Hypertension prevalence and blood pressure levels in 6 European countries,Canada,and the United States[J]. JAMA ,2003;289(5):2 363-2 369. 图4 级份p2-2-2 和 p2-2-4的一级质谱、二级质谱Fig.4 ESI-MS/MS spectrogram of the fraction p2-2-2 and p2-2-4 [2]TURNBULL F, NEAL B, NINOMIYA T, et al. Effects of different regimens to lower blood pressure on major cardiovascular events in older and younger adults: meta-analysis of randomized trials[J].BMJ, 2008;336(1):1 121-1 123. [3]CUSHMAN D W,CHEUNG H S,SABO E F,et al. Development and design of specific inhibitors of angiotensin-converting enzyme[J]. Am J Cardiol,1982,49(3):1 390-1 394. [4]GHASSEM M,ARIHARA K,BABJI A S,et al. Purification and identification of ACE inhibitory peptides from Haruan (Channa striatus) myofibrillar protein hydrolysate using HPLC-ESI-TOF MS/MS[J]. Food Chem,2011,129(15):1 770-1 777. [5]BOSCHIN G,SCIGLIUOLO G M,RESTA D,et al. ACE-inhibitory activity of enzymatic protein hydrolysates from lupin and other legumes[J]. Food Chem ,2014,145(9):34-40. [6]FERREIRA S.A bradykinin‐potentiating factor (BPF) present in the venom of Bothrops jararaca[J]. British Journal of Pharmacology and Chemotherapy,1965,24(1): 163-169. [7]OSHIMA G,SHIMABUKURO H,NAGASAWA K.Peptide inhibitors of angiotensin I-converting enzyme in digests of gelatin by bacterial collagenase[J].Biochim Biophys Acta,1979,566(7):128-137. [8]MULLALLY M,MEISEL H,FITZGERALD R J.Identification of a novel angiotensin-I-converting enzyme inhibitory peptide corresponding to a tryptic fragment of bovine betalactoglobulin[J].FEBS Lett,1997,402(2):99-101. [9]YANO S,SUZUKI K,FUNATSU G.Isolation from alpha-zein of thermolysin peptides with angiotensin I-converting enzyme inhibitory activity[J]. Biosci Biotechnol Biochem,1996,60(3):661-663. [10]KOHAMA Y,MATSUMOTO S,OKA H,et al. Isolation of angiotensin-converting enzyme inhibitor from tuna muscle[J].Biochemical and Biophysical Research Communications,1988,155(6):332-337. [11]WANG J P,HU J E,CUI J Z,et al. Purification and identification of a ACE inhibitory peptide from oyster proteins hydrolysate and the anti hypertensive effect of hydrolysate in spontaneously hypertensive rats[J]. Food Chem,2008,111(8):302-308. [12]TSAI J S,CHEN J L,PAN B S.ACE-inhibitory peptides identified from the muscle protein hydrolysate of hard clam (Meretrixlusoria)[J]. Process Biochem,2008,43(12):743-747. [13]KAWAMURA Y,TAKANE T, SATAKE M.et al. Physiologically active peptide motif in proteins - peptide inhibitors of ACE from the hydrolysates of Antarctic krill muscle protein[J]. Jpn Agric Res,1996,26(5):210-213. [14]李铭五.远东拟沙丁鱼资源分布与利用[J].水产科学,1986(4):43-45. [15]CUSHMAN D W,CHEUNG H S.Spectrophotometric assay and properties of the angiotensin I-converting enzyme of rabbit lung[J]. Biochem Pharmacol,1971,20(3):1 637-1 648. [16]NATESH R,SCHWAGER S L U,STURROCK E D,et al. Crystal structure of the human angiotensin-converting enzyme-lisinopril complex[J]. Nature,2003(24):421-551. [17]LEI D,MING F,HONGXI W. A novel angiotensin I-converting enzyme inhibitory peptide from Phascolosoma esculenta water-soluble protein hydrolysate[J].Journal of Functional Foods,2013(14): 475-483. [18]AKIO Y,TAKUMA S,DAISUKE O.Novel angiotensin I-converting enzymey inhibitory peptide derived from bovine casein[J].Food Chemistry, 2013,141(6):3 781-3 789. [19]王茵.紫菜降血压肽酶法制备及降压效果的研究[D].福州:福建农林大学,2009:70-71. [20]CHEUNG H S, WANG F L, ONDETTI M A, et al. Binding of peptide substrates and inhibitors of angiontensin-converting enzyme[J]. J Bio Chem,1980,255(3): 401-407. Antihypertensive effect of enzymatic hydrolysate fromSardinopsmelanosticta muscle on spontaneously hypertensive rats and identification of its angiotensin-converting enzyme (ACE) inhibitory peptide WANG Jing-jing1, JI Wei1, JI Hong-wu1,2,3,4*, SU Wei-ming1,2,3,4,LI Ya-hui1, LIU Shu-cheng1,2,3,4 1(College of Food Science and Technology, Guangdong Ocean University, Zhanjiang 524088, China) 2(Guangdong Provincial Key Laboratory of Aquatic Products Processing and Safety, Zhanjiang 524088, China) 3(Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524008,China) 4(Guangdong Engineering Research Center of Seafood, Zhanjiang 524088, China) ABSTRACTSardinops melanosticta muscle was hydrolyzed using a combination of animal protein hydrolysis enzyme and flavor enzyme to obtain its hydrolysate abbreviated as SMMH. SMMH was then ultrafiltered with 10 kDa and 3 kDa cut-off membranes to yield 3 fractions named as A (MW>10 kDa), B(3 kDa Key wordsSardinops melanosticta; hydrolysate; angiotensin-converting enzyme (ACE); SHRs; isolation and purification 收稿日期:2015-11-09,改回日期:2015-12-04 基金项目:广东省高等院校学科建设项目(编号:2013CXZDA020);广东省产学研合作项目(编号:2013B090600155);广东海洋大学创新强校项目(编号:GDOU2013050314, GDOU2014050203) DOI:10.13995/j.cnki.11-1802/ts.201604012 第一作者:硕士研究生(吉宏武教授为通讯作者,E-mail:jihw62318@163.com)。