双抗体夹心酶联免疫方法检测丁香假单胞杆菌斑点致病变种病菌
2016-05-23王文彬孔德昭唐丽娟食品科学与技术国家重点实验室江南大学江苏无锡214122
王文彬, 孔德昭, 唐丽娟, 马 伟,匡 华(食品科学与技术国家重点实验室,江南大学,江苏无锡214122)
双抗体夹心酶联免疫方法检测丁香假单胞杆菌斑点致病变种病菌
王文彬,孔德昭,唐丽娟,马伟,匡华*
(食品科学与技术国家重点实验室,江南大学,江苏无锡214122)
摘要:丁香假单胞杆菌斑点致病变种病菌可以引起十字花科细菌性黑斑病,是侵染萝卜、白菜、花椰菜等农作物的重要病害之一。以灭活的丁香假单胞杆菌斑点致病变种病菌(NCPPB1820)为免疫原免疫小鼠,通过杂交瘤细胞技术,筛选最终获得6株产生特异性单克隆抗体的杂交瘤细胞。将辣根过氧化物酶(horseradish peroxidase,HRP)与抗体偶联,作为检测探针,分别将6种单克隆抗体作为包被抗体,进行两两配对筛选。结果表明,所制备的抗体特异性较好,对水稻细菌性谷枯病菌、水稻细菌性条斑病菌、玉米细菌性枯萎病菌、丁香假单胞菌丁香致病变种均没有交叉反应。以6号抗体作为检测抗体(6-HRP),以1号抗体作为包被抗体,建立酶联免疫分析法获得了最佳的敏感度。检测丁香假单胞杆菌斑点致病变种的最低检测限为1.5×105cfu/mL,定量限为4.12×105cfu/mL。基于双抗体夹心的酶免疫方法特异性好,便捷,可以实现对丁香假单胞杆菌斑点致病变种病菌高通量测定。
关键词:酶联免疫测定;单克隆抗体;丁香假单胞杆菌斑点致病变种病菌
由丁香假单胞杆菌斑点致病变种(Pseudomonas syringae pv. Maculicola)病菌引起的十字花科细菌性黑斑病是世界上重要的十字花科蔬菜细菌性病害[1]。该病菌在分类上属于原核生物细菌界、变形杆菌门、假单胞菌科[2]。该菌最适培养温度在25~27℃,主要宿主有白菜、萝卜、花椰菜等十字花科蔬菜。2002年湖北省长阳县一处蔬菜基地的萝卜爆发的萝卜细菌性黑斑病即是由该病菌引起的[3]。
国外关于该病菌的研究主要集中在致病机理的研究以及用脉冲电场凝胶电泳对该丁香假单胞菌进行分型[4-7]。目前,对于病原微生物的测定技术主要有免疫检测和分子生物学检测技术。Youfu Zhao等建立了检测丁香假单胞菌冠菌素的间接竞争ELISA方法[8]。国内对丁香假单胞杆菌的研究较少。黄琼等对丁香假单胞菌中6个致病变种的全细胞蛋白质进行了电泳和分析,发现该方法可以鉴定不同的丁香假单胞菌致病变种[9]。王华杰对丁香假单胞杆菌斑点致病变种进行了详细的研究和综述[2]。然而,免疫技术检测丁香假单胞杆菌斑点致病变种病菌尚无报道[10]。因此,作者以危害十字花科植物的重要病原微生物丁香假单胞杆菌斑点致病变种病菌为对象,开发并建立双抗体夹心法酶免疫测定方法,为实现丁香假单胞杆菌斑点致病变种病菌的快速鉴定和高通量、快速分析提供技术支持。
1 材料与方法
1.1材料和试剂
丁香假单胞杆菌斑点致病变种(Pseudomonas syringae pv. Maculicola,NCPPB1820),水稻细菌性谷枯病菌(Burkholderia glumae,NCPPB 3591),水稻细菌性条斑病菌(Xanthomonas oryzae pv. Oryzicola,NCPPB 1585),玉米细菌性枯萎病菌(Pantoea stewartii subsp.stewartii,NCPPB449),丁香假单胞菌丁香致病变种(Pseudomonas syringae pv.syringae,NCPPB2844):来自英国NCPPB中心。哥伦比亚琼脂培养基:杭州微生物试剂有限公司;脑心浸液BHI干粉:北京陆桥技术有限公司。弗氏完全佐剂和弗氏不完全佐剂,明胶:购于Sigma公司;辣根过氧化物酶(horseradish peroxidase,HRP),四甲基联苯胺(TMB):阿拉丁试剂公司;辣根过氧化酶标记的羊抗兔/鼠IgG:康成生物工程公司产品;沉淀型单组份TMB底物溶液:上海天根公司;Tween-20,氯化钠,磷酸二氢钾,十二水磷酸氢二钠,柠檬酸和浓硫酸:国药集团化学试剂有限公司。
1.2主要仪器
MK3酶标仪:美国Thermo scientific公司;PH050A型培养箱:上海恒一科学仪器有限公司制造;96孔酶标板,美国Corning公司。
1.3实验方法
1.3.1细菌培养方法丁香假单胞杆菌斑点致病变种冻存菌株在哥伦比亚平板上,27℃培养2~3 d。之后单菌落接种在BHI液体培养基中,27℃培养2 d。
1.3.2单克隆抗体的制备灭活的丁香假单胞杆菌斑点致病变种标准菌株与弗氏完全佐剂等体积混合,乳化至形成油包水结构后皮下多点注射免疫6~8周龄的雌性BALB/c小鼠,剂量为108cfu/只,间隔周期为3周,第3次免疫时剂量减半。第3次免疫1周后对小鼠尾部采血,利用间接酶联免疫法检测血清效价,待效价达到要求(血清滴度>1∶10,000)后挑选效价最高的小鼠进行冲刺免疫。冲刺免疫采用腹腔注射,冲刺剂量为2×107cfu/只。冲刺免疫3 d后,将小鼠处死并取脾细胞与SP2/0骨髓瘤细胞融合。采用间接酶联免疫法对细胞上清液进行分析,挑选分泌特异性识别丁香假单胞杆菌斑点致病变种菌株的细胞株进行亚克隆,扩大培养并冻存。采用体内诱生法制备小鼠腹水,采用辛酸饱和硫酸铵法纯化腹水,获得单克隆抗体。单克隆抗体标记HRP采用NaIO4法,详细步骤见文献[11]。
1.3.3抗体配对筛选利用双抗体夹心法进行单克隆抗体的配对筛选,操作方法如下:将制备的单克隆抗体分别用包被溶液(pH 9.6,碳酸盐缓冲液)稀释至5 μg/mL,包被酶标板,然后进行封闭,封闭后加入标准品溶液,设置阳性对照(P,5×107cfu/mL的标准菌株溶液,100 μL/孔)和阴性对照(N,磷酸盐缓冲液PBS,100 μL/孔),37℃反应1 h后,加入HRP标记的抗体(用抗体缓冲液稀释1 000倍)并在37℃反应1 h,显色,终止反应。检测后,阳性孔吸光值与阴性孔吸光值比值(P/N)≥2.1的配对认为是成功的。比较各组的P/N值,选择比值最高的两株抗体进行下续方法的优化,建立双抗体夹心酶免疫测定方法。
1.3.4检测方法评估以挑选的两株抗体分别作为包被抗体和检测抗体,通过优化抗体的稀释比例,建立丁香假单胞杆菌斑点致病变种病菌检测的双抗体夹心检测方法。将采用磷酸盐缓冲液将标准菌株稀释成一系列浓度,每个浓度设置3个重复,空白孔做6个重复。以病菌浓度为横坐标,其对应的检测吸光度值(OD450)值为纵坐标绘制标准曲线,确定方法的线性范围、检测限和定量限。检测限(LOD)的计算方式如下:以标准曲线中空白孔吸光度平均值加上3倍标准偏差时的吸光值对应的菌体浓度。定量限(QL)为空白孔吸光度平均值的2.1倍时的值对应的菌体浓度。分别以水稻细菌性谷枯病菌,水稻细菌性条斑病菌,玉米细菌性枯萎病菌,丁香假单胞菌丁香致病变种菌株为测试菌,测试检测方法的特异性。
2 结果与分析
2.1抗体的筛选配对
采用杂交瘤技术经过融合筛选获得6株对丁香假单胞杆菌斑点致病变种病菌有亲和性的细胞株。分别将获得的6种抗体作为包被抗体包被酶标板,以HRP标记抗体作为检测抗体,配对筛选结果见表1。表中数据为P/N比值,可见采用1号抗体作为包被抗体,6号抗体作为检测抗体(标记HRP)配对,P/N值最高,为12.53。因此选择1号抗体和6号抗体作为最优配对抗体,建立双抗体夹心免疫分析方法。
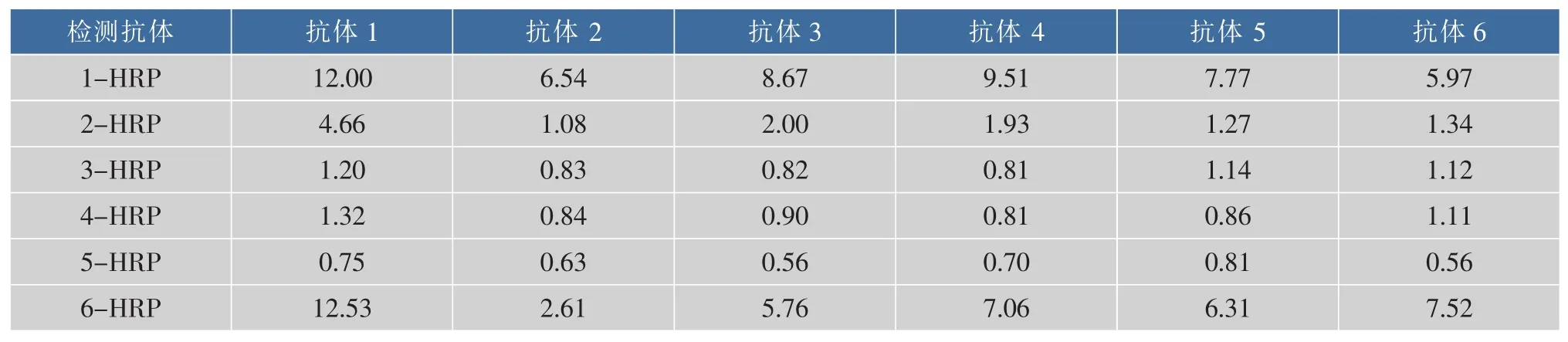
表1 丁香假单胞杆菌斑点致病变种病菌单克隆抗体筛选配对结果Table 1 Pairwish results of monoclonal antibodies aginst Pseudomonas syringae pv. Maculicola
2.2双抗体夹心酶联免疫测定方法建立
将包被抗体和检测抗体进行系列浓度稀释,采用棋盘法进行优化分析。结果表明,当包被抗体质量浓度为4 μg/mL,检测抗体质量浓度为2 μg/mL,获得最佳检测敏感度。图1为非线性拟合的标准曲线,可以看出,检测线性范围在106~108cfu/mL之间,该方法检测丁香假单胞杆菌斑点致病变种病菌的最低检测限(LOD)为1.5×105cfu/mL,定量限(QL)为4.12~105cfu/mL。
用上述方法检测水稻细菌性谷枯病菌、水稻细菌性条斑病菌、玉米细菌性枯萎病菌,丁香假单胞菌丁香致病变种病菌,450 nm下的吸光值(OD450)均在0.2以下,P/N值均小于2.1;表明该方法特异性较好,与上述病菌无交叉反应,见表2。
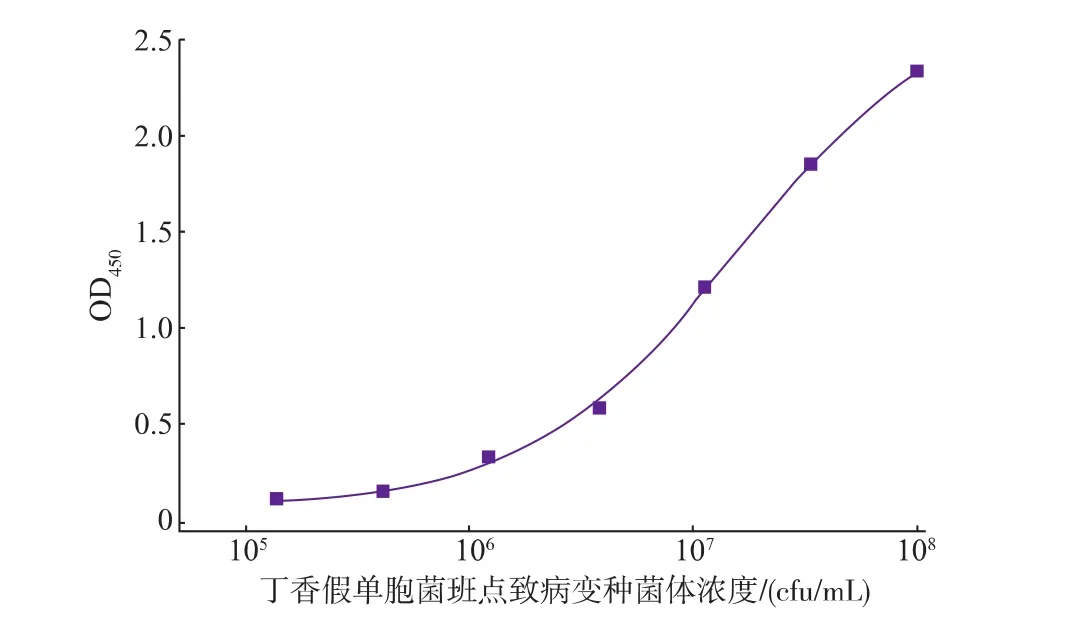
图1 双抗体夹心酶联免疫法测定丁香假单胞杆菌斑点致病变种病菌标准曲线Fig. 1 Standard curve of sandwich immunoassy for Pseudomonas syringae pv. maculicola

表2丁香假单胞杆菌斑点致病变种病毒的双抗体夹心免疫法检测特异性结果Table 2 Specificity tests of sandwich immunoassy for Pseudomonas syringae pv. Maculicola
3 结语
丁香假单胞杆菌斑点致病变种病菌是引起十字花科蔬菜黑斑病的重要植物病菌,可以通过种子传播。目前对于植物病菌危害均采用分子生物学的分析方法,步骤繁琐包括增菌培养、富集、菌体裂解提取DNA、PCR扩增等多个步骤,效率较低。本研究采用免疫学方法,获得了特异性的单克隆抗体,可以实现对丁香假单胞杆菌斑点致病变种病菌鉴定和快速检测。该方法检测丁香假单胞杆菌斑点致病变种的最低检测限(LOD)为1.5×105cfu/mL,定量限(QL)为4.12×105cfu/mL,若增加增菌环节,有望大大提高检测敏感度。本研究为研发植物病菌危害检测提供了有力手段,为研发快速检测试纸条等检测产品提供了核心试剂和技术支撑,可用于口岸、现场植物病菌的鉴定和测试。
参考文献:
[ 1 ] ZHAO Y,Damicone J P,Demezas D H,et al. Bacterial leaf spot of leafy crucifers in Oklahoma caused by Pseudomonas syringae pv. maculicola[J]. Plant Disease,2000,84(9):1015-1020.
[ 2 ]王华杰,史晓晶,赵廷昌,等.十字花科蔬菜细菌性黑斑病研究概述[J].菌物研究,2009,7(3):218-220. WANG Huajie,SHI Xiaojing,ZHAO Tingchang,HU Jun,et al. Progress of study on crucifer bacterial black spot[J]. Journal of Fungal Research,2009,7(3):218-220.(in Chinese)
[ 3 ]喻法金,赵毓潮,毛张菊,等.萝卜细菌性黑斑病在高山菜区发生规律观察[J].湖北植保,2007(3):34-36. YU Jinfa,ZHAO Yucao,MAO Zhangju,et al. Occurrence regularity of radish related bacterial black spot disease in alpine area [J]. Plant Quarantine,2007,21(3):165-169.(in Chinese)
[ 4 ] Cuppels D A,Ainsworth T. Molecular and physiological characterization of Pseudomonas syringae pv. tomato and Pseudomonas syringae pv. maculicola strains that produce the phytotoxin coronatine[J]. Applied and Environmental Microbiology,1995,61 (10):3530-3536.
[ 5 ] Hendrickson E L,Guevera P,Ausubel F M. The alternative sigma factor RpoN is required for hrpActivity in Pseudomonas syringae pv. Maculicola and acts at the level of hrpL transcription[J]. Journal of Bacteriology,2000,182(12):3508-3516.
[ 6 ] Hendrickson E L,Guevera P,PE Aloza-v Zquez A,et al. Virulence of the phytopathogen Pseudomonas syringae pv. maculicola is rpoN dependent[J]. Journal of Bacteriology,2000,182(12):3498-34507.
[ 7 ] WANG L,Mitra R M,Hasselmann K D,et al. The genetic network controlling the arabidopsis transcriptional response to Pseudomonas syringae pv. maculicola:roles of major regulators and the phytotoxin coronatine[J]. Molecular Plant-Microbe Interactions,2008,21(11):1408-1420.
[ 8 ] ZHAO Y,Jones W,Sutherland P,et al. Detection of the phytotoxin coronatine by ELISA and localization in infected plant tissue [J]. Physiological and Molecular Plant Pathology,2001,58(6):247-258.
[ 9 ]黄琼,任欣正.丁香假单胞菌中六个致病变种的全细胞蛋白质电泳分析[J].云南农业大学学报,1996,11(4):197-201. HUANG Qiong,REN Xinzheng. Electro phoretie analysis of whole-cell protein of six pathovars in Pseudomonas syringae[J]. Journal of Yunnan Agricultural University,1996,11(4):197-201.(in Chinese)
[10]孙艳秋,赵奎华,曹远银,等.植物病原细菌快速检测技术研究进展[J].辽宁农业科学,2012(1):44-48. SUN Yanqiu,ZHAO Kuihua,CAO Yuanyin,et al. The progress on the research of rapid detection technology of plant pathogenic bacteria[J]. Liaoning Agricultural Sciences,2012(1):44-48.(in Chinese)
[11] KUANG H,WANG W B,XU L G,et al. Monoclonal antibody-based sandwich ELISA for the detection of staphylococcal enterotoxin A[J]. International Journal of Environmental Research and Public Health,2013,10(4):1598-1608.
Sandwich Immunoassy Against Pseudomonas syringae pv. Maculicola
WANG Wenbin,KONG Dezhao,TANG Lijuan,MA Wei,KUANG Hua*
(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Abstract:A sandwich immnuoassay based on monoclonal antibody for detection of Pseudomonas syringae pv. Maculicola was developed. Killed Pseudomonas syringae pv. Maculicola cell was used as immunogen to immunize BALB/c mice. The antisera was detected and the mice of highest antisera titer was selected for cell fusion. With hybirdoma technology,six cell lines secreting specific antibody to Pseudomonas syringae pv. Maculicola were obtained. Monoclonal antibodies(mAb)coded mAb1 and mAb6 were selected used as coating antibody and detection antibody based on pair-matching screening results. The sandiwich measure based on double antibodies were found to be high specific to targeted bacteria and no cross reactions to other bacteria including Burkholderia glumae,Xanthomonas oryzae pv. Oryzicola,Pantoea stewartii subsp.stewartii and Pseudomonas syringae pv.syringae. Under optimized conditions,the limit of detection was 1.5×105cfu/mL andbook=163,ebook=56quantitative limit was 4.12×105cfu/mL. This immunoassy was highly specific to Pseudomonas syringae pv. Maculicola and suitable for in-field detction,which provide a convient and fast tool in plant bacteria analysis.
Keywords:immunoassay,Pseudomonas syringae pv. Maculicola,monoclonal antibody
*通信作者:匡华(1981—),女,河南长垣人,农学博士,教授,硕士研究生导师,主要从事食品安全方面的研究。E-mail:kuangh@jiangnan.edu.cn
基金项目:国家十二五科技支撑计划项目(2012BAC01B07)。
收稿日期:2014-09-09
中图分类号:S 436.3
文献标志码:A
文章编号:1673—1689(2016)02—0162—04
