黄酒酿造后酵工艺对氨基酸态氮生成的影响
2016-05-23潘慧青石慧媛谢广发江南大学工业生物技术教育部重点实验室江苏无锡11江南大学生物工程学院江苏无锡11粮食发酵工艺与技术国家工程实验室江南大学江苏无锡11中国绍兴黄酒集团有限公司国家黄酒工程技术研究中心浙江绍兴31000
潘慧青,曹 钰*,石慧媛,陆 健,3,谢广发(1.江南大学工业生物技术教育部重点实验室,江苏无锡11;.江南大学生物工程学院,江苏无锡11;3.粮食发酵工艺与技术国家工程实验室,江南大学,江苏无锡11;.中国绍兴黄酒集团有限公司国家黄酒工程技术研究中心,浙江绍兴31000)
黄酒酿造后酵工艺对氨基酸态氮生成的影响
潘慧青1,2,曹钰*1,2,石慧媛2,陆健1,2,3,谢广发4
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122;3.粮食发酵工艺与技术国家工程实验室,江南大学,江苏无锡214122;4.中国绍兴黄酒集团有限公司国家黄酒工程技术研究中心,浙江绍兴312000)
摘要:黄酒的氨基酸态氮是用来反映其中的氨基酸及小肽总体水平的重要指标,其含量的高低直接影响黄酒的质量等级和整体风味。作者针对黄酒后酵阶段工艺条件进行研究,通过对发酵过程中蛋白质、氨基酸态氮、活酵母数的动态变化以及酒体的理化指标和氨基酸组成分析,考察后酵时间和温度对氨基酸态氮生成的影响。结果表明,氨基酸态氮主要产生在黄酒后酵阶段,后发酵时间从14 d延长至17、20、23 d,氨基酸态氮的含量分别提高24.7%、31.7%和37.6%,酵母自溶过程对后酵末期氨基酸态氮的贡献显著。升高后酵温度有利于氨基酸态氮的形成,后酵温度对氨基酸态氮的形成同时受到蛋白质降解酶活性和酵母自溶两方面的综合影响。研究结果显示,氨基酸是氨基酸态氮的主要组成,其含氮量占氨基酸态氮60%以上。
关键词:氨基酸态氮;后酵时间;后酵温度;酵母自溶
黄酒是我国特有的且历史最悠久的传统酒种,是世界3大古酒之一。黄酒中氨基酸含量不仅是酒中之最,而且种类多达21种,其中含有8种人体必需氨基酸。氨基酸在黄酒酿造过程中不仅为微生物提供了丰富的营养物质,也是很多风味物质的前体物质。此外氨基酸赋予黄酒丰富的味觉层次,使其具有鲜美醇和、浓香爽口的特征。氨基酸态氮可大致反应氨基酸及小肽的总体水平,并且测定方法简单、快速,因此多年来黄酒行业采用这一重要指标评价黄酒质量等级。国标中规定了不同成品黄酒类型中氨基酸态氮的最低限量,若氨基酸态氮的含量未达标,就会直接影响黄酒的质量等级以及黄酒特有的口感,将会给黄酒企业带来一定的损失。
目前对黄酒中氨基酸态氮的相关研究还比较少,只有少数文献从经验层面总结了影响氨基酸态氮的因素及提高含量的途径[1-2],但均未有相关的实验论证。此外在一些其他研究报道中提及到黄酒中氨基酸态氮的变化,如增加麦曲的用量或添加酸性蛋白酶都能提高氨基酸态氮的含量[3-6]。这可能由于黄酒酿造本身的复杂,集霉菌、酵母、细菌混合为一体的半固体发酵,所以尚未有针对黄酒中氨基酸态氮形成及影响机理的研究报道。
针对黄酒后酵阶段工艺条件进行研究,通过对发酵过程中蛋白质、氨基酸态氮、活酵母数的动态变化以及酒体的理化指标和氨基酸组成分析,考察后酵时间和温度对氨基酸态氮生成的影响,并尝试分析其影响机理。研究工艺条件对黄酒中氨基酸态氮生成的影响,有助于促进黄酒的优质化发展。
1.1材料与仪器
酿造酵母N85:浙江古越龙山绍兴酒股份有限公司提供;糯米:无锡市华润万家超市;生、熟麦曲:由浙江古越龙山绍兴酒股份有限公司提供;Tricine和蛋白质标准品(相对分子质量4 100~66 000):上海生工生物工程公司;乙腈、甲醇:色谱纯;其他试剂均为分析纯。
UV-2100紫外分光光度计:Unic公司;垂直电泳仪:美国Bio-Rad公司;JD-801凝胶成像仪:江苏省捷达科技发展有限公司;Agilent 1100型氨基酸专用高效液相色谱仪:美国安捷伦公司。
1.2实验方法
1.2.1酵母活化及扩培用米汁培养基活化斜面保藏的酵母菌株,以10%的接种体积分数进行三级扩培。
1.2.2酿酒实验采用3 L的三角瓶发酵600 g糯米,酿造工艺流程见图1。
1 材料与方法

图1 黄酒酿造工艺流程Fig. 1 Diagram of Chinese rice wine brewing
1.2.3样品收集与处理分别在第1、2、3、4、7、10、13、17、21天取样,6 000 r/min离心10 min,上清液用滤纸过滤,测定各个指标或-20℃储存待测。
1.2.4样品测定总糖、总酸、酒精度、非糖固形物和氨基酸态氮的测定:参照国家标准方法(GB/T 13662-2008);上清液蛋白质质量浓度的测定:采用Bradford方法[7];活酵母数:采用YPD平板计数法;上清液Tricine-SDS-PAGE:参照曹佐武[8]改良的实验方法;游离氨基酸的测定:采用OPA/FMOC柱前衍生法[9]。
2 结果与分析
2.1后酵时间对氨基酸态氮的影响
黄酒酿造中前酵阶段采用28℃发酵4 d,进入后酵阶段,后酵温度为15℃,设定继续进行14、17、20、23 d的后发酵,即总发酵时间分别为18、21、24、27 d,考察延长后酵时间对氨基酸态氮的影响。发酵过程中原料的米蛋白和麦曲中的蛋白质经蛋白酶、肽酶逐步降解,其中一部分被微生物吸收利用合成菌体蛋白,一部分转化为其他物质,剩余的残留在醪液中,因此醪液中酵母的数量和蛋白质的质量浓度与氨基酸态氮有着密不可分的关系。
图2显示,前酵阶段醪液中的蛋白质质量浓度快速下降,由于生、熟麦曲皆含有米曲霉分泌的酸性蛋白酶和中性蛋白酶,且熟麦曲中还含有二肽酶和氨肽酶[10],前酵温度利于酶活作用,为蛋白质的分解提供了有利的条件。酵母数量和氨基酸态氮的含量都呈现直线上升的趋势,酵母的活菌数量达到最高值为1.24亿/mL。进入后酵阶段,蛋白质质量浓度下降的速率明显减缓,分析认为既与较低的后酵温度影响酶活有关,还与蛋白酶或肽酶的酶活经过较长时间以及醪液中的较高乙醇浓度和低pH等因素的影响后可能出现下降,因此分解蛋白质的能力也逐步减弱。进入后酵阶段后,酵母的繁殖速率小于死亡速率,活菌数量呈下降的趋势,并且在所考察的后酵末期18~27 d中死亡率逐步增大。在整个后酵阶段醪液中氨基酸态氮质量浓度不断升高,且增长速率逐步增加,尤其是在后酵末期出现快速增长。文献[11-12]报道酵母自溶会释放出蛋白酶A、多肽和氨基酸,因此醪液中的蛋白质极有可能在麦曲中的蛋白酶和酵母释放的酸性蛋白酶双重作用下被分解,酵母的代谢活动减弱,利用的氨基酸速率也会减慢,并且酵母自溶会释放氨基酸,使得醪液中氨基酸态氮呈现上升的趋势,这与赵梅[13]的发酵过程中氨基酸态氮含量变化趋势相同。图2显示,随着后酵末期时间的延长,氨基酸态氮质量浓度越来越高,酵母活细胞数量和蛋白质质量浓度越来越低。

图2 发酵过程中氨基酸态氮、蛋白质及酵母数量的变化Fig. 2 Changes of amino acid nitrogen, proteins and the amounts of yeast during the brewing course
发酵醪上清液的蛋白质Tricine-SDS-PAGE结果可直观反映出黄酒发酵过程中蛋白质的降解,结果见图3。

图3 发酵过程中醪液上清液的Tricine-SDS-PAGE图谱Fig. 3 Tricine-SDS-PAGE electrophoresis of the samples during the brewing process
图3醪液中可溶性蛋白质的相对分子质量均小于66 000,前酵1~2 d,蛋白质条带较多且集中在35 000以下,条带a(Mw约为60 000)略微减少。结合样品上样前所测定的蛋白质质量浓度,由凝胶成像软件分析得知,发酵第2天条带a含量减少了13.6%,其余条带变化不明显;而在前酵2~3 d,蛋白质降解最为显著,这与图2中醪液蛋白质质量浓度在该阶段减少量相一致。从各个条带的变化来看,Mw约为35 000的条带b降解最多,质量浓度降低90%以上。其他条带的降解量分别为:条带a减少约63.9%,条带c(Mw约为27 000)减少70%,条带d (Mw约为23 000)减少47.5%。发酵第3天后,图谱上的蛋白质条带变化不大,反映出蛋白质的降解主要发生在前酵阶段。此外条带c、e、和f始终存在于发酵醪液中直至发酵结束,未能被降完全解,这些蛋白质很可能与黄酒的沉淀有关。
测定不同发酵时间结束时的黄酒理化指标,结果见表1。随着发酵时间延长,酒精度由15.5%提高到19.3%,总糖质量浓度显著降低。总酸质量浓度略有升高,酸度常作为黄酒发酵是否正常的衡量指标,干型酒规定总酸质量浓度在4.0~7.0 g/L,结果显示此次发酵正常。酵母量随发酵时间延长而减少,与前酵末期酵母数量最多的第4天相比,进入后酵阶段,随着发酵时间延长,酵母死亡率分别为20.2%、30.6%、35.5%和39.5%,变化幅度逐渐减小。氨基酸态氮的质量浓度随时间延长呈递增趋势,分别增加了24.7%、31.8%和37.6%,但增加幅度也逐渐减小,与酵母数量变化幅度相似,显示出后酵末期氨基酸态氮的增加和酵母自溶关系密切,适当延长发酵时间能在一定程度上提高氨基酸态氮的质量浓度。
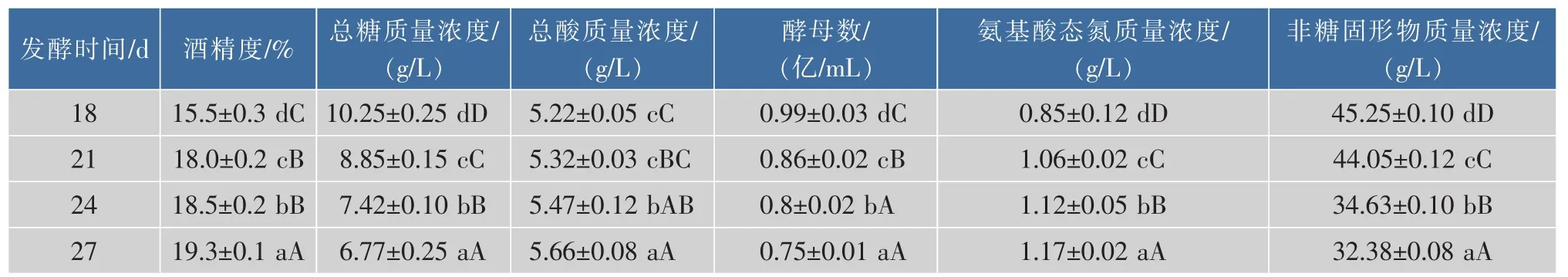
表1 发酵结束时黄酒的理化指标Table 1 Physicochemical indexes of Chinese rice wine at different brewing times
国标中采用甲醛滴定法测定氨基酸态氮,由其测定原理可知其值包含氨基酸以及二肽、三肽等小分子肽所含的氮总和。用OPA/FMOC柱前衍生法测定不同后酵时间发酵醪液中的游离氨基酸含量,并计算总含氮量,结果见表2。可以看出,氨基酸是氨基酸态氮的主要成分,占氨基酸态氮的60%以上。氨基酸的总量随发酵时间的延长逐渐升高,质量浓度一直升高且增加量最大的为天冬氨酸、谷氨酸、丙氨酸、缬氨酸和亮氨酸,与酵母自溶释放的氨基酸中质量浓度较高的氨基酸基本相同[14-17],说明后酵阶段酵母自溶对黄酒中氨基酸态氮的增加有很大贡献。然而氨基酸含氮量占氨基酸态氮的百分比在发酵21 d,死亡率达到30%以后基本保持不变,反映出醪液中的小肽含量在稳步增加。文献[18]报道,酵母自溶是一个缓慢过程,先释放的是相对分子质量大于10 000的蛋白质,随后蛋白质质量浓度降低,小分子肽数量增加。此外酵母自溶过程中释放出的内源性蛋白酶也可能降解发酵体系中的蛋白质,促进氨基酸态氮含量的增加,这还有待实验证实。
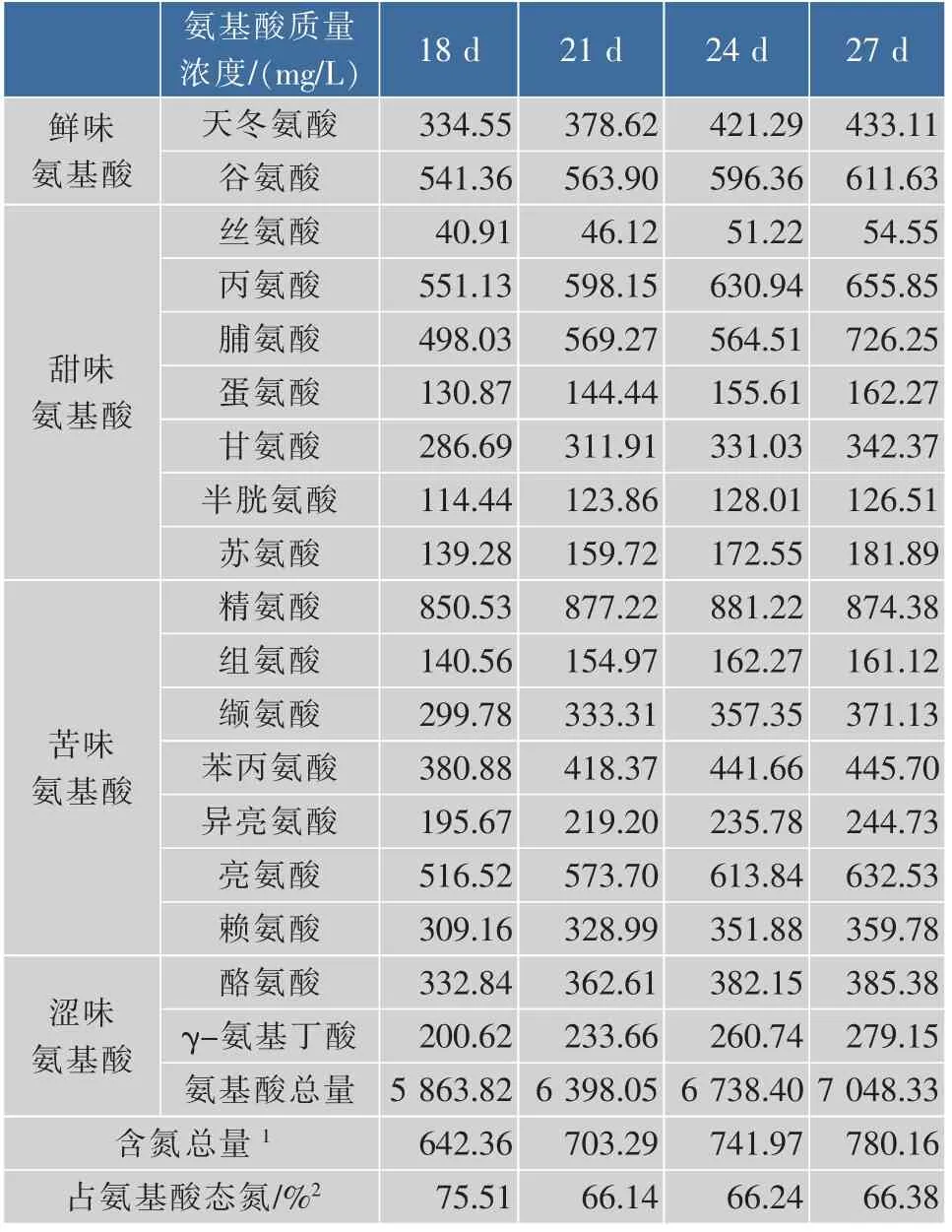
表2 发酵结束时氨基酸的质量浓度Table 2 Contents of free amino acid at end of brewing
2.2后酵温度对氨基酸态氮的影响
黄酒酿造是一个相当复杂的发酵体系,前酵阶段适合各种酶作用,小麦、大米中的淀粉被糖化,蛋白质被降解,使得酵母大量繁殖生长,消耗较多的糖分和氨基酸,产生大量的酒精及风味物质,而后酵是一个低温长时间的发酵过程,酵母继续进行代谢,有利于各种风味物质的形成。由2.1可知,氨基酸态氮主要在后酵阶段产生,同蛋白质降解及酵母自溶存在一定关系。为研究后酵温度对蛋白质降解和酵母自溶的可能影响,设置不同后酵温度,分别为13、15、17℃,后发酵17 d,前酵均采用28℃发酵4 d,即总发酵时间为21 d,考察后酵温度变化对氨基酸态氮生成的影响。
从图4(a)可看出,后酵温度不同蛋白质的降低速率也不同,温度越高,降低速率越快,反映出后酵温度对蛋白质降解酶的酶活是有影响的,温度越高越有利于蛋白质的分解。整个发酵过程中氨基酸态氮的总体变化趋势与2.1研究结果一致,主要在后酵期间产生,且随着后酵温度的升高,氨基酸态氮含量分别增加8.5%和18.3%。但后酵温度不同,氨基酸态氮增加的幅度有差异,13℃后酵温度氨基酸态氮的增加速率明显比15、17℃的慢,这与图4A蛋白质在后酵期间的降解速率缓慢相对应。

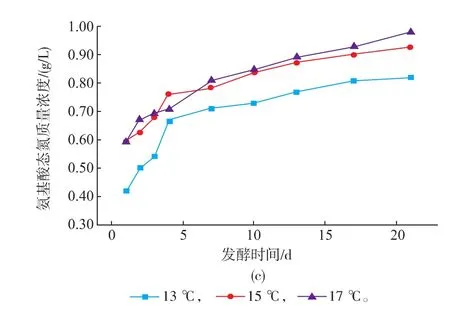
图4 不同后酵温度发酵中蛋白质质量浓度(A)、酵母数量(B)及氨基酸态氮(C)的变化曲线Fig. 4 Changes of proteins(A),the amounts of yeast cells (B)and amino acid nitrogen(C)under different post-fermentation temperature
从表3中酒精、总糖含量及酵母数可以看出,后酵温度越高,微生物的代谢活动越强。后酵17℃比13℃的酒精度增加25.8%,酵母数量是13℃的1.2倍。由图4(b)可知,进入后酵阶段酵母数量均呈现下降趋势,后酵温度13、15、17℃的酵母死亡率分别为26.4%、12.1%和10.9%。温度越低,酵母死亡率越高,可能与该酿酒酵母菌株耐低温能力有关。
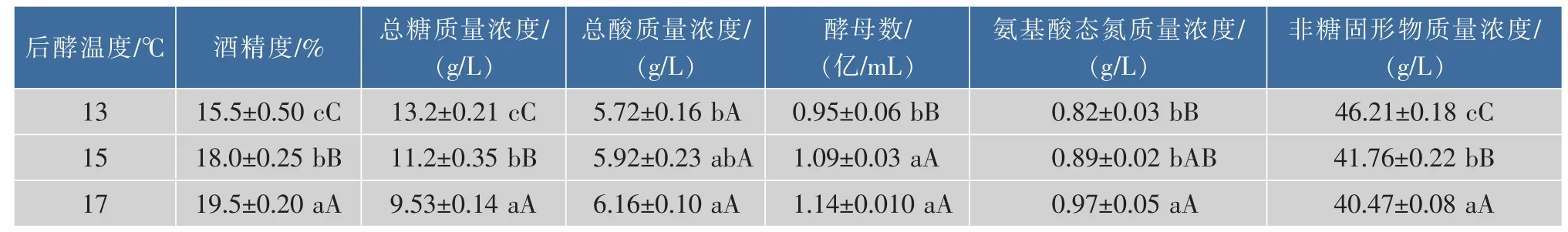
表3 不同后酵温度发酵结束时黄酒的理化指标Table 3 Physicochemical indexes of Chinese rice wine under different post-fermentation temperature
综合上述结果可知,虽然相对较低的后酵温度导致蛋白质的降解缓慢,但同时由于酵母较差的低温耐受性导致的较高死亡率有利于自溶释放氨基酸态氮,暗示在后酵阶段氨基氮的形成同时受到蛋白质降解酶活性和酵母自溶两方面的综合影响。
表4显示,不同后酵温度发酵结束时醪液中的游离氨基酸含量及氨基酸含氮量占氨基酸态氮的比值。氨基酸是氨基酸态氮的主要成分,其总量随着后酵温度升高而升高,且氨基酸含氮量占氨基酸态氮的比值也呈增大趋势,反映出在较高的后酵温度下醪液中小肽的比例下降,这一趋势也在一定程度上暗示了蛋白质降解酶对氨基酸态氮形成的影响。

表4 不同后酵温度下发酵结束时氨基酸的质量浓度Table 4 Contents of free amino acid at end of brewing with different post-fermentation temperature
3 结语
黄酒的氨基酸态氮是用来反映其中的氨基酸及小肽总体水平的重要指标,其含量的高低直接影响黄酒的质量等级和整体风味。作者针对黄酒后酵阶段工艺条件进行研究,通过对发酵过程中蛋白质、氨基酸态氮、活酵母数的动态变化以及酒体的理化指标和氨基酸组成分析,考察后酵时间和温度对氨基酸态氮生成的影响。
结果表明,氨基酸态氮主要产生在黄酒后酵阶段,后发酵时间从14 d延长至17、20、23 d,氨基酸态氮的含量分别提高24.7%、31.7%和37.6%,酵母自溶对后酵末期氨基酸态氮的贡献显著。升高后酵温度有利于氨基酸态氮的形成,后酵温度对氨基酸态氮的形成同时受到蛋白质降解酶活性和酵母自溶两方面的综合影响。不过在发酵过程中氨基酸态氮的形成及变化还与高级醇等多种风味物质的代谢密切相关,并非越高越好,需要将它们的形成综合起来考量。此外,研究结果显示,氨基酸是氨基酸态氮的主要组成,氨基酸含氮量占氨基酸态氮的比例60%以上,尚需进一步对其中的小肽类物质开展研究,以深入理解黄酒的营养和功效,促进黄酒的优质化发展。
参考文献:
[ 1 ]陈靖显.论黄酒中氨基酸态氮含量的相关因素[J].食品与发酵工业,1992,18(2):83-88. CHENG Jingxian. Factors influencing amino acid nitrogen of Chinese rice wine [J]. Food and Fermentation Industries,1992,18(2):83-88.(in Chinese)
[ 2 ]周建弟.浅谈黄酒中的氨基酸及其含量的控制[J].酿酒科技,2002(4):73-74. ZHOU Jiandi. Discussion on amino acid in yellow rice wine and controls on its content [J]. Liquor-Making Science and Technology,2002(4):73-74.(in Chinese)
[ 3 ]寿泉洪,胡普信,潘兴祥,等.生熟麦曲在黄酒传统工艺中的应用研究[J].中国酿造,2011(8):154-157. SHOU Quanhong,HU Puxin,PAN Xingxiang,et al. Application of(un)cooked wheat koji made by material in the production of Yellow rice wine[J]. China Brewing,2011(8):154-157.(in Chinese)
[ 4 ]张雨,冉宇舟,池国红,等.不同添加量的生麦曲对黄酒酿造和风味影响的研究[J].中国酿造,2009(12):104-107. ZHANG Yu,RAN Yuzhou,CHI Guohong,et al. Effect of addition of uncooked wheat starter on brewing and flavor of rice wine [J]. China Brewing,2009(12):104-107.(in Chinese)
[ 5 ]赖樱花,成坚,李勇波,等.酸性蛋白酶对黄酒常规质量指标的影响[J].食品科技,2012,37(3):135-138. LAI Yinghua,CHENG Jian,LI Yongbo,et al. Effect of acidic protease on quality of regular indices in yellow rice wine brewing [J]. Food Science and Technology,2012,37(3):135-138.(in Chinese)
[ 6 ]董甘霖.酸性蛋白酶在机制粳米黄酒中的应用[J].酿酒科技,2006(6):70-71.DONG Ganling. Application of acid protease in the production of machine-made yellow rice wine(by non-glutinous rice)[J]. Liquor-Making Science and Technology,2006(6):70-71.(in Chinese)
[ 7 ] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1-2):248-254.
[ 8 ]曹佐武.有效分离1kDa小肽的Tricine-SDS-PAGE方法[J].中国生物工程杂志,2004,24(1):74-76. CAO Zuowu. An effective method of Tricine -SDS-PAGE forseparatingthe 1kDa peptide[J]. China Biotechnology,2004,24(1):74-76.(in Chinese)
[ 9 ] Herbert P,Barros P,Ratola N,et al. HPLC determination of amino acids in musts and port wine using OPA/FMOC derivatives[J]. Journal of Food Science,2000,65(7):1130-1133.
[10] Zhang B,Guan Z B,Cao Y,et al. Secretome of Aspergillus oryzae in Shaoxing rice wine koji [J]. International Journal of Food Microbiology,2012,155(3):113-119.
[11] Alexandre H,Heintz D,Chassagne D,et al. Protease A activity and nitrogen fractions released during alcoholic fermentation and autolysis in enological conditions[J]. Journal of Industrial Microbiology & Biotechnology,2001,26(4):235-240.
[12] Cebollero E,Carrascosa A V,Gonzalez R. Evidence for yeast autophagy during simulation of sparkling wine aging:a reappraisal of the mechanism of yeast autolysis in wine[J]. Biotechnology Progress,2005,21(2):614-616.
[13]赵梅,冷云伟,李鹏.黄酒发酵过程分析及关键点的控制[J].江苏调味副食品,2009,26(5):30-34. ZHAO Mei,LENG Yunwei,LI Peng. Process analysis of yellow rice wine fermentation and its key points control [J]. Jiangsu Condiment and Subsidiary Food,2009,26(5):30-34.(in Chinese)
[14] Norris J R,Ribbons D W. Methods in Microbiology[M]. London:Academic Press,1970:229-295.
[15] Inmaculada A O,Maria A P,Almudena G R,et al. Role of specific components from commercial inactive dry yeast winemaking preparations on the growth of wine lactic acid bacteria [J]. Journal of Agricultural and Food Chemistry,2010,58(14):8392-8399.
[16] Martinez-rodriguez A J,Carrascosa A V,Polo M C. Release of nitrogen compounds to the extracellular medium by three strains of Saccharomyces cerevisiae during induced autolysis in a model wine system [J]. International Journal of Food Microbiology,2001,68(1-2):155-160.
[17]任静,朱凯.啤酒废酵母酶解制备氨基酸[J].食品与发酵工业,2010,36(5):101-104. REN Jing,ZHU Kai. Research on enzymatic hydrolysis of waste beer yeast for preparation of amino acid [J]. Food and Fermentation Industries,2010,36(5)101-104.(in Chinese)
[18] Martinez-rodrguez A J,Polo M C. Characterization of the nitrogen compounds released during yeast autolysis in a model wine system[J]. Journal of Agricultural and Food Chemistry,2000,48(4):1081-1085.
Effect of Post-Fermentation Technology on Amino Acid Nitrogen Generating during Chinese Rice Wine Brewing
PAN Huiqing1,2,CAO Yu*1,2,SHI Huiyuan2,LU Jian1,2,3,XIE Guangfa4
(1. Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2. School of Biotechnology,Jiangnan University,Wuxi 214122,China;3. National Engineering Laboratory for Cereal Fermentation Technology,Jiangnan University,Wuxi 214122,China;4. National Engineering Research Center for Chinese Rice Wine,China Shaoxing Rice Wine Group Co.,Ltd. Shaoxing 312000,China)
Abstract:Amino acid nitrogen(AAN)is an important indicator representing the overall level of amino acids and low molecular weight peptides in the Chinese rice wine,which content can affect the quality and flavor of wine. The influence of post-fermentation process parameters to AAN generating were discussed in this work,which included the post-fermentation time and post-fermentation temperature by tracing the dynamic changes of protein content,AAN content and amounts of viable yeast cells,Tricine analysis by SDS-PAGE,and the physicochemical indexes andbook=145,ebook=38amino acid composition of fermentation broth. The results showed that the post-fermentation was the main period for AAN producing. The content of AAN in draft rice wine was increased 24.7%,31.7% and 37.6%,respectively when post-fermentation time prolonged from 14 days to 17 days,20 days and 23 days. Yeast autolysis process offered a significant contribution to AAN at end of post-fermentation. Meanwhile it had positive effect on AAN formation when post-fermentation temperature raised at range of 13℃to 17℃. The results implied that AAN was influenced by both activities of protein degradation enzymes and the degree of yeast autolysis when post-fermentation temperature was changed. Furthermore,the work indicated that amino acids are the main composition of nitrogen compounds,which nitrogen content accounted for more than 60% of AAN. This study is aimed to understand the effect of process conditions on the AAN generating,which will benefit the quality improvement of Chinese rice wine.
Keywords:amino acid nitrogen,post-fermentation temperature,post-fermentation time,yeast autolysis
*通信作者:曹钰(1971—),女,江苏泰兴人,工学硕士,副教授,硕士研究生导师,主要从事传统酿造的机理及相关微生物和酶类的研究。E-mail:tsaoy5@jiangnan.edu.cn
基金项目:国家973计划项目(2013CB733602);江苏高校优势学科建设工程资助项目;江南大学糖化学与生物技术教育部重点实验室开放课题(KLCCB-KF201407)。
收稿日期:2014-08-31
中图分类号:Q 815
文献标志码:A
文章编号:1673—1689(2016)02—0144—07
