TACE联合微波消融治疗原发性肝癌的效果分析*
2016-05-23邓兴胡鸿游箭廖运国文晓霞赵晓伟
邓兴 胡鸿 游箭 廖运国 文晓霞 赵晓伟
(川北医学院第二临床医学院·南充市中心医院影像科/介入放射科,四川 南充 637000)
·论著·
TACE联合微波消融治疗原发性肝癌的效果分析*
邓兴胡鸿游箭廖运国文晓霞赵晓伟
(川北医学院第二临床医学院·南充市中心医院影像科/介入放射科,四川 南充 637000)
【摘要】目的探讨经导管动脉化疗栓塞术(TACE)联合微波消融(PMCT)治疗原发性肝癌的临床价值。方法根据治疗方法的不同将2012年7月~2015年7月随访资料完整的75例中晚期肝癌患者分为观察组33例及对照组42例,对照组患者单纯采用TACE治疗,观察组则采用TACE联合微波消融治疗,观察手术前后两组血清甲胎蛋白(AFP) 水平的变化,影像学检查(B超、CT、MRI)测量肝癌病灶直径等指标,随访1、3、6、12、24月和36月存活率。结果与对照组相比,观察组疗效明显提升、不良反应发生率显著下降、生存期延长,无出血、肿瘤破裂及肝功能衰竭等严重并发症发生。结论TACE 联合微波消融治疗原发性肝癌安全有效,并发症少,符合肿瘤微创、综合治疗理念,是中晚期肝癌患者较理想临床治疗方法。
【关键词】原发性肝癌;经导管动脉化疗栓塞术;微波消融
肝癌是我国最常见的恶性肿瘤之一,具有生长快、转移早等特点,近年来肝癌的发病率和死亡率逐年增高。综合介入治疗现已成为不能手术肝癌患者的重要治疗手段,与单一介入疗法相比较,可明显改善肝癌患者的预后,延长患者的生存期[1,2]。其中经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)是治疗不能手术切除肝癌的首选方法,但存在远期生存率低等问题[3]。结合局部肝癌治疗技术如无水乙醇注射(percutaneous ethanol injection,PEI)、射频消融(radiofrequency ablation,RFA)、微波消融 (percutaneous micro-wave coagulation therapy,PMCT)、冷冻消融(cryoablation,CA)和高强度聚焦超声(high intensity-focus ultrasound,HIFU)等因其具有创伤小、恢复快、疗效显著等优势在临床已得到广泛应用[4-7],回访资料显示利用TACE联合PMCT治疗原发性肝癌临床疗效较好。
1材料与方法
1.1临床资料收集自2012年7月~2015年7月期间,在我院住院并经临床、实验室检查、影像学和/或病理检查确诊为原发性肝癌并接受TACE/联合微波消融治疗的75例患者,随机分为观察组33例和对照组42例,患者术前甲胎蛋白不同程度升高,>2000ug/L 10例,1000-2000ug/L 7例,200-1000ug/L6例,另外6例患者中部分术前肿瘤标记物CA19-9明显升高,6例患者术前各项肿瘤标记物未见明显升高。诊断标准参照2011年9月“第十三届全国肝癌学术会议”肝癌诊断相关标准。病例入选标准:①经临床、影像(B超、CT、MRI)活/或病理明确诊断为原发性肝癌。②肝癌巴塞罗那分期(BCLC)为A、B或C期。③肝功能为Child-Pugh A或B级。④已失去外科手术切除指征或因患者年龄较大手术风险较高或者患者不愿意行外科手术治疗。
1.2方法
1.2.1主要治疗设备及材料德国西门子公司全数字化通用型平板血管造影系统(8轴落地式全方位机器人-Artis Zeego);GE公司ADVANTX LCV+数字减影血管造影机;西门子SOMATOM Spirit 双层螺旋CT;德国西门子公司超高端多层螺旋CT(双源CT);南京亿高公司ECO-100型水冷型微波治疗仪;单极微波天线(18G);常规介入器械、栓塞剂及化疗药。
1.2.2治疗方法每例患者在获得确诊后,术前评估无手术禁忌证,并由患者/及家属签署手术知情同意书。①对照组采用TACE治疗使用Seldinger穿刺技术,将5-F导管沿股动脉送入腹腔干/肠系膜上动脉造影,明确肿瘤供血动脉后,选择性或超选择进入肿瘤供血动脉,缓慢注射化疗药物5-氟尿嘧啶 (5-FU)600mg,顺铂(DDP)40~80mg,丝裂霉素C(MMC)10~20mg/表柔比星20~40mg和碘化油乳剂(表柔比星20mg与碘化油10~30ml混匀,视病灶大小5~30ml)对肿瘤血管进行栓塞,根据情况加用明胶海绵颗粒强化栓塞。②观察组采用TACE联合PMCT治疗TACE术后1-2W复查CT,了解病灶区域碘化油沉积、病灶数量并决定下一步微波治疗时间及穿刺路径。根据初诊及复查CT片初步判断肿瘤消融数量及穿刺路径。术前半小时给予杜冷丁80mg、地西泮5mg肌肉注射。患者取仰卧位或侧卧位,吸氧并行心电监测生命体征,在体表贴定位标记线后行CT扫描确定穿刺点及穿刺路径。使用微波消融针缓慢进针, 重复CT扫描将微波消融针头刺入预设靶点,根据肿瘤大小设定微波消融参数(预设功率55~70W,时间6~12min)。可酌情行多点多次治疗,使消融范围在肿瘤边缘外约 0.5~1cm[8],以确保肿瘤消融完全。术中观察患者有无不适,可根据具体情况对症治疗。术后常规卧床24h 并予以吸氧、心电监护监测生命体征,并给予止血、预防感染、保肝、止痛及对症治疗。
2结果
2.1术后影像学检查情况采用TACE术后所有病例1月复查CT可见病灶内碘化油均有不同程度沉积,密实程度与术中DSA造影情况基本吻合,部分乏血供肿瘤病灶内碘化油沉积欠佳(见图1)。采用微波消融术中病灶CT值较术前均有不同程度减低,其中16例术后病灶内立即出现气体影(48.5%,16/33)。术后1~6月复查CT消融病灶 CT值均有显著下降呈均匀一致低密度影,增强扫描未见强化,提示肿瘤坏死完全(见图2~4);同时11例病灶内的碘化油沉积较消融前明显浓聚(33.3%,11/33),更进一步加强了TACE的疗效;术后3个月复查病灶明显缩小17例(51.5%,17/33),病灶无明显变化5例(15.2%,5/33)。若存在残余肿瘤组织可再次行TACE联合PMCT或者单纯PMCT治疗。
2.2 AFP水平观察组中21例术前甲胎蛋白(AFP)升高的患者,术后1月复查甲胎蛋白均有不同程度降低,其中6例术后甲胎蛋白恢复至正常水平(28.6%,6/21),9例下降>60.0%(42.9%,9/21),6例下降>30.0%(18.2%,7/21)。
2.3毒副反应和并发症观察组33例PMCT术后,所有病人在术中及术后均感不同程度肝区疼痛不适,若肿瘤位于肝包膜下则疼痛更剧烈,其中2例病人因疼痛剧烈不能耐受疼痛术中采取静脉全身麻醉,多数病人可在术后1-3天内恢复;6例病人术后感恶心、呕吐(18.2%,6/33),5例出现轻到中度发热(15.2%,5/33),体温最高为38.6℃,经对症治疗后均能缓解;1例术后剧烈腹痛,呈疼痛-缓解-疼痛表现,复查CT提示并发胆道出血,再次肝动脉造影证实并明确靶血管后行栓塞止血成功(3.0%,1/33)。无手术相关死亡病例。
2.4随访情况依据患者接受首次介入治疗的日期为起点,以月为单位计算,采用电话与门诊随访相结合的方式,随访日期截止到2015年7月。随访时间为8~36个月,中位随访时间11个月,其中失访5例,失访率15.2%。观察组中晚期HCC治疗后生存时间4~36(15±0.4)个月,6月、12月总生存率分别为 97.0%(32/33)、84.8%(28/33)。显著高于对照组(78.5%,33/42)、(64.2%,28/42),截止随访结束,死亡15例(45.5%,10/33),存活18例(54.5%,18/33)。见表1及图5。
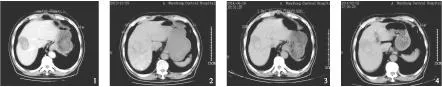
图1TACE术后病灶内少量碘化油沉积图2、3、4微波消融术后1月、2月、6月,病灶完全液化坏死,液化坏死区超越病灶边缘5mm
Figure 1Conventional TACE postoperative lesions within a small amount of iodized oil depositionFigure 2, 3, 4Microwave ablation after 1 month, 2 months, 6 month, was completely liquefied necrosis, liquefaction necrosis area beyond lesions edge 5 mm

表1 两组患者术后生存情况比较(n)

图5两组患者生存时间曲线图
Figure 5Survival time curve
3讨论
3.1TACE与PMCT的治疗机制肝癌的恶性程度较高,大多数在首次诊断时,已经属于中晚期,病死率较高,尤其是对于未经治疗的患者,平均生存期仅为2~6个月,而对于大肝癌患者经手术治疗后的 5 年复发率仍有40%~60%[9]。目前,在原发性肝癌的治疗中,TACE被公认为是无外科手术指征的中晚期肝癌患者的首选治疗方法。该法是经导管注入适当的化疗药物+栓塞剂混悬液栓塞肿瘤供血动脉,以达到预期的治疗目的。但是,由于肿瘤周边部分以及纤维包膜上、包膜外浸润的癌组织、子灶、门静脉癌栓等以门静脉供血为主[10],TACE治疗时血管不能完全栓塞,生成侧支循环,另外血管闭塞、肿瘤乏血以及肝内动静脉瘘造成的化疗药物过快流失等均影响癌细胞的灭活,其远期生存率较低[11]。微波凝固消融主要是利用微波的热效应和恶性肿瘤细胞对热的耐受能力比正常细胞差,局部加温在39℃~55℃ 可致癌细胞停止分裂,肿瘤组织发生凝固性坏死。微波消融的疗效和肿瘤血供的关系与TACE 相反,肿瘤的血供越少,微波的热能流失越少,微波消融的热效率就越高,疗效也就越好[12]。
3.2TACE联合PMCT治疗优势TACE序贯联合PMCT治疗中晚期原发性肝癌可弥补单纯TACE不能完全栓塞肿瘤血供,不能使肿瘤细胞达到完全坏死,结合PMCT治疗,有利于发挥两者各自的优点,增加治疗效果:①TACE序贯联合PMCT,于消融前栓塞肿瘤血管,可阻断或减少肿瘤局部区域的血液供应,减少循环血流的“热沉”作用[13],增强消融疗效,且微波固化消融的热效应可进一步增加肿瘤组织对化疗药物的敏感性,促进化疗药物对肝癌细胞的杀伤,增加TACE治疗的治疗效果[14]。②术前行TACE-DSA造影可以发现B超、CT、MRI等影像学检查未能发现的肝内微小转移灶并进行栓塞治疗,同时碘油栓塞后起示踪剂作用,有利于后续的微波凝固消融治疗,使消融更精确、治疗更彻底。③大量研究已经证实,肝癌肿瘤局部和全身存在自发的和复杂的免疫反应,包括T细胞反应和对肿瘤各种相关性抗原刺激引起的体液反应[15,16],肿瘤细胞变性坏死后的分解产物具有抗原性,能诱导特异性细胞毒性T细胞的产生,增强细胞免疫功能; 消融杀死肿瘤细胞后可以减少肿瘤细胞分泌的免疫抑制因子;热刺激作用下热休克蛋白70合成增加,进一步增加免疫细胞的抗原递呈能力;改变T淋巴细胞亚群的分类增强免疫反应[17]。有研究证实,微波消融原位彻底灭活了所有肿瘤组织,能消除肿瘤对免疫系统功能的抑制,同时增加抗原呈递细胞数量,进一步提高抗原提呈效率,微波消融肿瘤后机体CD8+T细胞和IFN-γ水平随之升高[18],进而进一步增强机体自身免疫力,加强疗效。④TACE序贯联合PMCT治疗可减少TACE治疗的频次,从而有助于降低多次、反复的TACE治疗对正常肝脏组织的损害等副作用。⑤观察组部分病人术后复查CT病灶内碘化油沉积较术前相比密实程度有所增加,可能进一步增加TACE疗效,但因病例数较少,需继续观察。
3.3不足微波凝固消融治疗肝癌,方法简单、安全、实用,患者痛苦小、凝固效果确切。但对于直径 >5 cm的大肝癌患者,在三维空间上仍有可能出现治疗漏洞而致治疗不彻底,导致疗效降低[19,20]。PMCT 虽然可以多点多次叠加,但仍然很难对肿瘤做到一次灭活,而残余的肿瘤组织又会引起肿瘤的复发和转移[21]。另外,越来越多的研究表明,PMCT治疗肝癌可能产生严重的并发症,最常见的有出血、感染、腹腔脏器损伤、血气胸、胆漏等[22,23],本组出现1例并发胆道出血(行CT及血管造影明确并行栓塞治疗止血成功),其余未出现重大并发症,而充分的术前准备、术中熟练的操作和严格质量控制的消融技术可以使并发症发生率降至最低。
4结论
本文资料显示,TACE联合PMCT治疗原发性肝癌可以弥补单纯TACE或PMCT自身的缺陷,可减少多次TACE对正常肝脏组织的损害,两者在治疗上有很强的互补性,能加强对于肿瘤的疗效,提高患者的生存期及生活质量,同时可改善患者局部和全身的免疫功能;操作上也较为简便,手术创伤及并发症较外科手术明显减小,术后恢复时间较外科手术切除明显缩短,是一种安全有效,并发症少,符合肿瘤微创、综合治疗理念,是中晚期肝癌患者较为理想的治疗手段。
【参考文献】
[1]Liu C, Liang P, Liu F,etal. MWA combined with TACE as a combined therapy for unresectable large-sized hepotocellular carcinoma[J]. Int J Hyperthermia,2011,27(7):654-662.
[2]赵明,王健鹏,吴沛宏,等. TACE与TACE联合RFA 治疗中晚期原发性肝癌 167 例临床对比分析[J]. 中华医学杂志,2010,90(41):2916-2921.
[3]Ray CE Jr,Brown AC,Green TJ,etal. Survival outcomes in patients with advanced hepatocellular carcinoma treated with drug-eluting bead chemoembolization[J].AJR Am J Roentgenol,2015,204(2) :440-447.
[4]Dunne RM,shyn PB, sung JC,etal.Percutaneoys treatment of hepatocellular carcinoma in patients with cirrhosis, A comparison of the safety of cryoablation and radiofrequency ablation[J]. EUR J Radiol,2014,83(4):632-638.
[5]申权,杨维竹,江娜,等.射频消融术联合TACE治疗肝癌[J].中国介入影像与治疗学,2011,8(1):33-36.
[6]Liao M,Huang J,Zzhang T,etal.Transarterial chemoembolization in combination with local therapies for hepatocellular carcinoma[J].A metaanalysis,Plos One,2013,8(7):68453.
[7]Muneeb A, Christopher L B, Fred T L,etal. Principles of and advances in percutaneous ablation[J]. Radiology,2011,258(2):351-369.
[8]Muneeb A, Christopher L B, FRED T L,etal. Principles of and advances in percutaneous ablation[J]. Radiology,2011,258(2):351-369.
[9]Huang Q, Bian GB, Duan XG,etal. An ultrasound-directedrobotic system for microwave ablation of liver cancer[J]. Robotica,2010,28(2): 209-214.
[10] 谭凯,杜锡林,杨涛,等.肝癌合并门静脉癌栓术后门静脉化疗疗效分析[J],西部医学,2015,27(7):989-995.
[11] Weledji EP,Enow Orock G,Ngowe MN,etal. How grim is hepatocel-lular carcinoma[J]. Ann Med Surg(Lond),2014,3(3):71-76.
[12] 陈刚,唐晓军,李宏波,等. 肝动脉化疗栓塞联合经皮微波消融治疗中晚期肝癌的疗效评价[J]. 临床放射学杂志,2012,31:712.
[13] 倪嘉延,许林锋. TACE联合PRFA治疗原发性肝癌的Meta分析[J]. 临床放射学杂志,2013(32)9,1331-1334.
[14] Gleisner AL,Choti MA,Assumpcao L,etal. Colorectallive rmetastases:recurrence and survival following hepatic resection,radiofrequency ablation,and combined resection radiofrequency ablation[J]. Arch surg,2008,143:1204-1212.
[15] Mizukoshi E,Nakamoto Y, Arai K,etal. Comparative analysis of various tumor-associated antigen-specific T cell responses in patients with hepatocellular carcinoma[J]. Hepatology,2011 53(4):1206-1216.
[16] Korangv F, Ormandy LA, Bleck,JS,etal. Spontaneous tumor-specific humoral and cellular immuneresponses to NY-ESO-1 in hepatocellular carcinoma[J]. Clin Cancer Re,2004,10(13):4332-4341.
[17] 王瞻,许林峰.肺癌微波消融治疗进展[J].临床放射学杂志,2014,33(7):1105-1106.
[18] Den Brok MH, Sutmuller RP, Nierkens S,etal. Efficient loading of dendritic cells following cryo and radiofrequency ablation in combination with immune modulation induces anti-tumour immunity[J].Br J Cancer,2006,95(7):896-905.
[19] 吴晓安,陈建清,钟小红,等. 终末期肝癌患者的治疗分析[J]. 实用癌症杂志,2010,25(6): 627-628,631.
[20] Shrager B, Jibara GA, Tabrizian P,etal. Resection of large hepatocellular carcinom(≥10cm)):A unique western perspective[J]. J Surg Oncol,2013,107( 2):111-117.
[21] Schütte K,Seidensticker R,Milbradt O,etal. Assessment and moni-toring of liver function by 13C-aminopyrine breath test after selectivetransarterial chemoembolisation of hepatocellular carcinoma[J].Z,Gastroenterol,2015,53(1) :21-27.
[22] Martin RC,Scoggins CR,Mc Masters KM. Safety and efficacy of microwave ablation of hepatic tumors: aprospective review of a 5-year experience[J]. Ann Surg Oncol,2010,12(1):171-178.
[23] Dong BW,Liang P,Yu Xi,etal, Sonogarphically guided microwave coagulation treatment of liver cancer: an experimental and clinical study[J]. AJR Am J Roentgenol,1998,171(2):449-454.
Effectiveness analysis of TACE combined with percutaneous micro-wave coagulation therapy on primary liver cancer
DENG Xing,HU Hong,YOU Jian, et al
(DepartmentofMedicalImaging/InterventionalRadiology,TheSecondClinicalInstituteofNorthSichuanMedicalCollege,NanchongCentralHospital,Nanchong63700,Sichuan,China)
【Abstract】ObjectiveTo evaluate clinical value of transcatheter arterial chemoembolization (transcatheter arterial chemoembolization, TACE) and sequential combination microwave coagulation ablation (percutaneous micro-wave coagulation therapy, PMCT) on primary liver cancer. Methods 75 middle-late stage liver cancer patients were divided into observation group (n=33) and control group (n=42). The control group was treated with conventional treatment. The observation group was treated with microwave ablation therapy and conventional treatment. The serum AFP protein and diameter of liver lesions (ultrasound, CT, MRI) were observed. The patients followed up for 1 month, 3 months, 6 months, 12 months, 24 months and 36 months of survival. ResultsCompared that of control group, the incidence of adverse reactions, survival duration, hemorrhage, rupture of the tumor and liver failure, and other serious complications of observation group reduced. ConclusionTACE combined with microwave coagulation ablation is safe and effective for treatment of primary liver cancer.
【Key words】Primary liver neoplasms;Transcatheter arterial chemoembolization;Percutaneous micro-wave coagulation therapy; PMCT
(收稿日期:2015-12-01; 编辑: 陈舟贵)
【中图分类号】R 735.7
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.04.021
通讯作者:游箭,教授,本刊编委,E-mail:cqjr1997@163.com
基金项目:四川省教育厅重点项目(11ZA188)
