医用臭氧对肝癌细胞HepG2生物学行为的实验研究*
2016-05-23周玉川刘康钟立明杨巧丽游箭魏欣邓川
周玉川 刘康 钟立明 杨巧丽 游箭 魏欣 邓川
(川北医学院第二临床医学院·南充市中心医院 1.组织工程与干细胞研究所;2.介入放射科, 四川 南充 637000)
·论著·
医用臭氧对肝癌细胞HepG2生物学行为的实验研究*
周玉川1刘康1钟立明2杨巧丽2游箭2魏欣2邓川2
(川北医学院第二临床医学院·南充市中心医院1.组织工程与干细胞研究所;2.介入放射科, 四川 南充 637000)
【摘要】目的探讨使用医用臭氧(O3)在体外对肝癌HepG2细胞的作用。 方法获取人肝癌HepG2细胞在体外增殖、传代、对数生长期的细胞,将细胞分为对照组和实验组,实验组采用含浓度为0.5μg/ml的医用臭氧水的培养液处理细胞,对比两组试验的细胞形态学变化,细胞生长曲线、细胞凋亡情况、细胞迁移能力变化。结果体外实验结果显示,含臭氧的培养基中细胞数量明显减少,肿瘤细胞膜破裂,核固缩甚至裂解,臭氧对细胞的生长有抑制作用,同时CCK-8的检测结果显示O3能抑制肝癌细胞的增殖(P<0.01),Transwell迁移实验显示O3能抑制肿瘤细胞的迁移(P<0.01)。结论臭氧能直接杀死肝癌HepG2细胞,能在体外抑制肝癌HepG2细胞的增殖和迁移。
【关键词】臭氧;肝癌HepG2细胞;抑制作用;杀伤
肝癌是全球恶性程度极高、预后极差的恶性肿瘤之一。肝癌的发生发展是一个涉及多基因、多步骤的复杂的过程[1],传统治疗肝癌的手段主要有手术治疗、放疗和化疗等,随着基础医学和生命科学的不断发展,人类对恶性肿瘤的生物学特性及其治疗方式研究的不断深入,联合运用多种综合治疗方式已被大多数学者所接受。近年来,对于臭氧(O3)是否能够治疗恶性肿瘤仍存在怀疑,关于O3的疗效报道不一[2]。国内外有关单独应用O3治疗恶性肿瘤的报道极少,O3发挥肿瘤治疗作用的机制尚不清楚。本研究拟采用一定的医用O3浓度作用于体外培养的肝癌HepG2细胞,观察其对肝癌细胞的生物学影响,探讨O3应用于临床治疗肿瘤的可行性,同时为O3治疗恶性肿瘤的体外实验提供可行的实验方案,为后续的研究提供重要的研究方法和数据。
1材料和方法
1.1材料和主要试剂人肝癌细胞株HepG2购自ATCC;O3由南充市中心医院介入科臭氧发生仪(Medozon,德国赫尔曼)制得;CCK-8检测试剂盒购自日本DOJINDO公司;细胞培养板、Matrigel基质胶和基质膜购自BD公司;CO2培养箱、离心机购自Thermo Fisher公司;酶标仪购自上海科华公司;电子荧光显微镜购自日本NIKON;DMEM高糖培养基(HyClone, Thermo scientific)。
1.2实验方法
1.2.1细胞培养人肝癌HepG2细胞快速复苏后,接种于T75的培养瓶中,加10ml含10%胎牛血清(FBS)的DMEM高糖培养基,混匀后置于37℃的5%CO2培养箱中。
1.2.2细胞形态观察取对数生长期的细胞,向48孔板中加入5×104个/孔的细胞,分为实验组和对照组,实验组加入含臭氧0.5μg/ml的10%胎牛血清的培养液500μl,对照组加入等量的含血清培养基。24h后倒置显微镜下观察细胞生长状态,瑞氏染液染色,拍照。
1.2.3细胞生长曲线测定将1个48孔板分成实验组和对照组,实验组加入含臭氧0.5μg/ml培养液600μl,对照组加入等量的含血清培养液,继续培养7天,每天取3孔用牛鲍氏计数板计数,取每日均数作图,即为细胞生长曲线。
1.2.4CCK-8检测O3对肝癌细胞的抑制作用取对数生长期的细胞,经0.25% 胰酶消化后制成6×105个/ml的细胞悬液。向48孔培养板中加入100μl/孔细胞混悬液。将细胞分为2组,分别是浓度为0.5μg/ml的O3实验组和未处理的空白对照组,复孔数为5。待细胞贴壁后,吸出培养液,实验组中添加含臭氧0.5μg/ml的含血清培养液500μl,空白对照组添加含血清培养液500μl。各组细胞处理24 h 后每孔加入10μl CCK-8,37℃孵育4h。4h后,吸取上清液200μl于96孔板中,在波长450nm处测吸光度值并记录。
1.2.5Transwell迁移实验将对数生长期HepG2细胞 分为空白对照组和实验组,空白对照组加含血清培养液预处理8h,实验组用含O30.5μg/ml的含血清培养液预处理8h,然后换为无血清培养基饥饿处理4h后消化细胞,每组分别设3个复孔,每个培养小室上室内加入200μl细胞悬液(5×104个细胞)。培养小室下加入600μl 含10%FBS的DMEM高糖培养液,培养24 h。将膜用PBS洗2次 ,用棉签轻轻擦拭上室内侧面的细胞,用福尔马林液固定30 min,洗2次,0.1%结晶紫染色,室温30min,然后用PBS液清洗3次,倒置显微镜下随机选取5个视野观察,计数每个视野的细胞数,取平均数。
1.3统计学分析运用t检验对肝癌细胞增殖和迁移的结果进行统计学分析。P<0.05为差异有统计学意义。
2结果
2.1肿瘤细胞的形态学观察肿瘤细胞贴壁生长,在培养24h后细胞生长状况(如图1),可以看到对照组细胞生长良好,形态正常,染色结果显示细胞结构完整,胞浆丰富,核均匀分布。而O3组细胞数量明显少于对照组,细胞边缘模糊,胞浆减少,细胞膜破裂,核固缩甚至裂解。
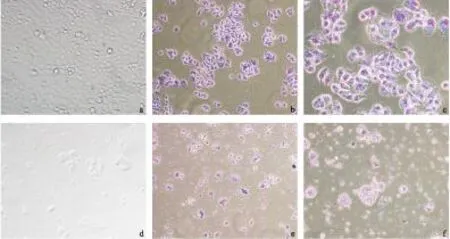
图1对照组(a,b,c)和实验组(d,e,f)肿瘤细胞形态学对比
Fig1Morphology of control group and experiment group
注:b,c,e,f采用瑞氏染色;a,c,d,f(×200);b,e(×100)
2.2肿瘤细胞的生长曲线空白对照组种植在48孔板中第1天,细胞生长缓慢,第1~4天细胞呈对数生长,第4~6天细胞处于稳定状态,第6~7天细胞出现衰老死亡。实验组细胞在培养的第1天细胞总数显著减少,第2~5天细胞缓慢生长,第5~6天出现较快生长,第6~7天趋于稳定,见图2。
2.3O3对肝癌细胞增殖的影响在细胞培养24 h 后采用CCK-8检测各孔的吸光度值,以空白组做对照,测得各组 OD 值(见图3),运用T检验对实验组与对照组做分析,结果表明O3对肝癌细胞的增值有抑制作用,结果有显著统计学意义(P<0.01) 。
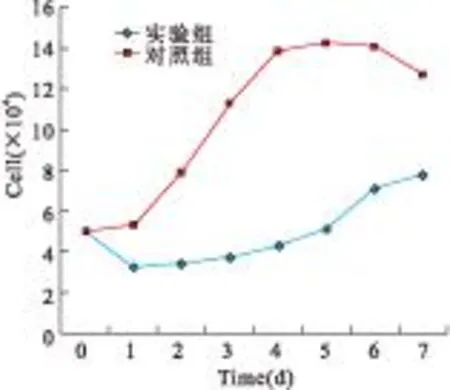
图2实验组和对照组细胞生长曲线
Figure 2The growth curve of experiment group and control group
2.4Transwell迁移实验实验结果显示,经臭氧处理的实验组HepG2细胞穿过聚碳酸脂膜的细胞数量明显低于空白对照组(见图4),经T检验计算差异有显著统计学意义(P<0.01)。

图3臭氧对HepG2 细胞增殖的影响.
Figure 3The effect of ozone solution on proliferation of liver cancer cell HepG2
注: 与对照组比较,①P<0.01
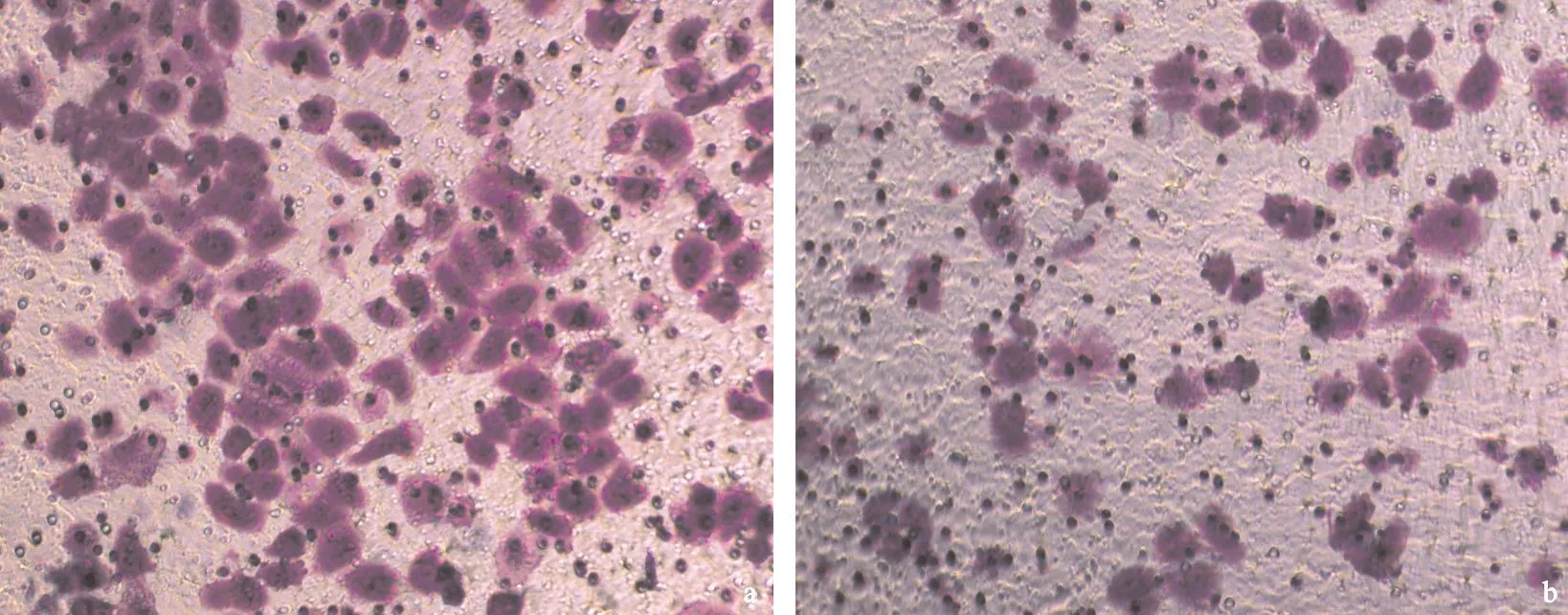
图4对照组(a)与实验组(b)O3对HepG2 细胞迁移的影响
Figure 4The effect of ozone solution on migration of liver cancer cell HepG2
注:结晶紫染色(×200);两组比较P<0.01
3讨论
O3水具有极强的氧化性,是广谱的杀菌剂。但臭氧的化学性质极不稳定,在空气和水中会分解变成氧气和氧自由基,O3变成氧气的解离速度取决于温度,pH值,水质[3]。本次实验采用的医用臭氧水都是在按临床治疗标准配置而成,双蒸水高压灭菌后,测得pH值为7.0,在20℃制得含臭氧0.5μg/ml的培养液。从制得的臭氧浓度的培养基到加样完成控制在20min以内,操作过程中减少避免剧烈震荡,尽量减少实验前O3的消耗,并在无菌室温环境下培养10min,充分保证O3与培养细胞的反应时间和浓度,然后放入37℃的CO2培养箱中继续培养。
据Bhalla D.K[4]研究,臭氧能损伤人体的呼吸道黏膜,甚至能导致肺部炎症,此外无报道对人体其他组织有影响,实验人员在操作过程中尽量减少与臭氧的直接接触,带好口罩,手套,在安全柜中进行实验。
有大量报道O3用于各种疾病的治疗,主要利用O3的强氧化性、抗炎、镇痛以及杀菌的作用[5~9]。最新报道[10]称臭氧还能用于缓解肌肉疲劳,改善心功能。自从利用O3的自血疗法[11]治疗肿瘤并取得疗效后,已有相关研究报道其在体内抗肿瘤的作用机制,如增强红细胞的代谢,改善局部血液循环,增强免疫系统,诱导产生大量的免疫细胞因子[12]。有报道体外O3对肿瘤细胞有抑制作用[13],但O3对肿瘤细胞的体外抑制作用机制尚不明确。就本实验来说,还没有任何O3在体外单独抑制肝癌HepG2细胞增殖的报道。
Huz JI等[14]的报道低氧环境能促进肿瘤细胞的生长,其机理是O3在水溶液中能逐渐分解产生氧气,造成一个持续的富氧环境,抑制肿瘤组织和细胞的生长。Sweet等[15]将人工培养的肺癌、乳腺癌及子宫癌细胞暴露在空气中,并且分别施加不同浓度的O3于密闭的空气中,观察不同浓度的O3对肿瘤细胞及正常组织细胞的影响,当O3浓度达到0.3~0.5μg/m1能抑制40-60%肿瘤细胞的生长,而非肿瘤细胞并没有明显损伤;当空气中的O3浓度达0.8μg/m1,90%的肿瘤细胞增长受到抑制,非肿瘤细胞的损伤达到50%,该实验结果显示O3浓度控制在一定范围内可以选择性杀灭肿瘤细胞。而本次实验的浓度为0.5μg/m1,正是基于该报道,事实证明,在该浓度下,肿瘤细胞的增殖抑制作用明显,与上述报道相符。还有研究[16]显示O3与化疗药物联合使用能提高5-Fu疗效。
癌细胞最主要的生物学特征是能持续的分裂和增殖,因此抑制肿瘤细胞的分裂增殖,甚至能诱导其凋亡是肿瘤治疗的重要手段之一[17]。本次实验选用形态学观察、生长曲线、CCK-8 法和Transwell迁移实验对O3的增殖抑制作用进行检测,获得了O3抑制肝癌细胞增殖的体外实验证据。首先通过形态学观察,发现肿瘤细胞膜通透性增强,导致胞浆漏出,进而胞膜褶皱,呈毛细胞样,最后出现裸核。而细胞核的变化跟细胞凋亡一样,先是核固缩,最后细胞核裂解[18]。这与Kuroda K1[19]的动物实验结果相同,与臭氧直接接触的肿瘤细胞都发生了坏死,但这与Costanzo[20]的研究结论不同,可能与实验方法有关。特别是两者之间的浓度差异和处理方式不同有关。因此,臭氧是否能激发细胞凋亡的通路还是因为理化性质导致肿瘤细胞裂解还不得而知,这需要后续的实验去研究。
实验绘制的生长曲线和CCK-8检测细胞增殖中,实验组的细胞因为部分被直接杀死,部分细胞形态受到影响,因此生长曲线检测细胞培养过程出现最初的细胞数量减少,然而随着培养时间延长,O3被分解,变成O2不溶于水而挥发,对细胞的作用减少甚至消失,一段时间后肿瘤细胞呈现增长。在Transwell迁移实验中,因细胞死亡和结构的变化,实验组穿过聚碳酸脂膜的细胞数量较空白对照组显著减少。
4结论
本实验显示,医用臭氧水在体外条件下能够直接强力杀伤肿瘤细胞,破坏细胞结构,但作用机制尚待深入研究。提示臭氧有望更多的用于肿瘤患者的康复与治疗。后续研究将观察臭氧对肝癌家兔体内的疗效。并从形态学入手,逐步探索臭氧治疗肿瘤的机理。
【参考文献】
[1]牛静静. siRNA靶向沉默fbxl20基因对肝癌SMMC-7721细胞生物学行为的影响[J].川北医学院学报, 2012, 27(3): 221-224.
[2]Clavo B,Ceballos D,etal. Long-term control of refractory hemorrhagic radiation proctitis with ozone therapy [J]. J Pain Symptom Manage, 2013,46(1):106-112.
[3]何华名, 栗亚飞. 不同制备方式臭氧水溶解规律及喷雾特性研究[J]. 沈阳农业大学学报, 2013, 44(5): 678-682.
[4]Bhalla DK. Ozone-induced lung inflammation and mucosal barrier disruption: Toxicology, mechanisms, and implications[J]. Toxicol. Environ. Health. B Crit. Rev,1999,2:31-86.
[5]何晓峰. 臭氧治疗医学的创新、发展与前景[J]. 西部医学, 2010, 22(12): 2187-2190.
[6]谷玉玲.医用臭氧自血疗法联合中医康复治疗老年缺血性脑卒中的临床观察[J].内蒙古中医药, 2012, 31(16): 17-18.
[7]杨圣伟.浅谈医用臭氧的临床应用及前景展望 [J]. 临床医药实践杂志, 2008,4.
[8]Sagai M, Bocci V. Mechanisms of Action Involved in Ozone Therapy: Is healing induced via a mild oxidative stress[J]. Medical Gas Research, 2011,1:29.
[9]Clavo B, Santana-Rodriguez N, Llontop P,etal.Ozone Therapy in the Management of Persistent Radiation-Induced Rectal Bleeding in Prostate Cancer Patients[J].EvidBased Complement Alternat Med,2015,480369.
[10] Di Filippo C, Trotta MC, Maisto R,etal.Daily Oxygen/O3Treatment Reduces Muscular Fatigue and Improves Cardiac Performance in Rats Subjected to Prolonged High Intensity Physical Exercise[J].Oxid Med Cell Longev, 2015, 2015:190640.
[11] Martínez-Sánchez G, Delgado-Roche L,etal. Effects of ozone therapy on haemostatic and oxidative stress index in coronary artery disease[J]. Eur J Pharmacol, 2012,15;691(1-3):156-162.
[12] 郭雪娇. 医用臭氧治疗膝骨性关节炎的机制及临床研究进展[D].山东:山东大学,2013.
[13] 韩世龙,朱晓黎.经皮注射医用臭氧治疗兔VX2移植瘤的实验研究[J].Journal of Interventional Radiology, 2013, 22(3):223-227.
[14] Huz JI. Spontaneous regression of hepatocellular carcinoma is most often associated with tumour hypoxia or a systemic inflammatory response[J]. HPB (Oxford), 2012,14(8):500-505.
[15] Sweet F,Kao MS,Lee SC,etal.Ozone selectively inhibits growth of human cancer cells[J].Science, 1980,209:931-933.
[16] Zänker KS, Kroczek R.In vitro synergistic activity of 5-fluorouracil with low-dose ozone against a chemoresistant tumor cell line and fresh human tumor cells[J].Chemotherapy, 1990,36(2):147-154.
[17] 王琪琳.靶向c-FLIP在癌症治疗中的分子调节机制[J].Chinese journal of immunology,2013, 29(9) 998-1002.
[18] 汤雪明.医学细胞生物学[M].北京:科学出版社,2004.
[19] Kuroda K, Azuma K, Mori T,etal.The Safety and Anti-Tumor Effects of Ozonated Water in Vivo[J].Int J Mol Sci, 2015, 22,16(10):25108-25120.
[20] Costanzo M, Cisterna B, Vella A,etal. 2015 Apr 21. Low ozone concentrations stimulate cytoskeletal organization, mitochondrial activity and nuclear transcription[J]. European Journal of Histochemistry,2015,59:2.
Research for the treatment of medical ozone on liver cancer cell line HepG2
ZHOU Yuchuan1,LIU Kang1,ZHONG Liming2,et al
(1.ResearchInstituteofTissueEngineeringandStemCells·TheSecondClinicalMedicalCollegeofNorthSichuanMedicalCollege,NanchongCentralHospital,Nanchong637000,Sichuan,China;2.DepartmentofInterventionalMedicinc,NanchongCentralHospital,Nanchong637000,Sichuan,China)
【Abstract】ObjectiveTo explore the inhibitory effect of medical ozone on liver cancer cell line HepG2 in vitro. MethodsThe liver cancer cell line HepG2 were divided into experiment group and control group. The experiment group was treated with 0.5μg/ml medical ozone. The morphology, growth curve, apoptosis and migration ability were observed. ResultsThe cells in experiment group were decreased compared with that of control group. There were cell membrane breakage, karyopycnosis and even nuclear cracked in experiment group. Transwell model Assay showed tumor cells migration was inhibited by ozone solution. ConclusionOzone can restrain proliferation and migration of liver cancer cell line HepG2, and can directly kill HepG2 liver cancer cells in vitro.
【Key words】Ozone; Liver cancer cell line HepG2; Inhibition; Kill
(收稿日期:2015-11-02; 编辑: 陈舟贵)
【中图分类号】R 735.7
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.04.006
通讯作者:钟立明,主任医师,教授,电话:13696235751
基金项目:南充市应用技术研究与开发项目(13A0047)
