人工合成色素偶氮玉红标准样品的研制
2016-05-18何桂华韩焕美郑新华张爱霞陈晞王乐耿岩玲王晓段文娟赵恒强济南出入境检验检疫局山东济南5004山东省分析测试中心山东济南5004
何桂华,韩焕美,*,郑新华,张爱霞,陈晞,王乐,耿岩玲,王晓,段文娟,赵恒强(.济南出入境检验检疫局,山东济南5004;.山东省分析测试中心,山东济南5004)
人工合成色素偶氮玉红标准样品的研制
何桂华1,韩焕美1,*,郑新华1,张爱霞1,陈晞1,王乐1,耿岩玲2,王晓2,段文娟2,赵恒强2
(1.济南出入境检验检疫局,山东济南250014;2.山东省分析测试中心,山东济南250014)
摘要:建立了一种快速有效的制备食用合成色素偶氮玉红标准样品的方法。采用凝胶色谱技术对筛选的偶氮玉红原料纯化后,再用无水乙醇对产物进行沉降、洗涤,室温真空干燥,粉碎,过筛,可得偶氮玉红纯品;然后通过核磁共振(1HNMR谱、(13)CNMR谱)、红外光谱、LC-MS/MS法对样品进行定性分析,结构确认后进行均匀性和稳定性检验;经8家具有资质实验室进行协同定值,偶氮玉红纯度为99.23%±0.38%,满足标准样品的要求。
关键词:偶氮玉红;标准样品;合成色素
偶氮玉红,又称酸性红(Azorubine),是通过重氮化4-氨基萘磺酸和4-羟基萘磺酸之间的偶合反应,利用现代的生物技术制成的食用合成色素。偶氮玉红是一种偶氮型酸性染料,外观为红色粉末或颗粒,溶于水,微溶于乙醇,具有酸性染料的特性,而且具有耐热性、耐碱性、耐氧化还原性和良好的染色性。偶氮玉红,因为具有合成着色剂的共性,比如色泽鲜艳、着色力强、性质稳定、价格低廉,成为食品工业常用的添加剂之一。但是,由于偶氮玉红是以萘等芳烃类化工产品为原料,经过磺化、偶氮化等一系列有机反应化合而成[1],属于苯胺类色素。研究表明,苯胺类色素影响人体细胞代谢﹑酶的活力,甚至在人体内形成致癌物,引起癌变,过量食用对人体健康危害极大[2]。GB 2760-2014《食品安全国家标准食品添加剂使用标准》中规定了各类食品中各种着色剂的使用限量,其中偶氮玉红为0.05 g/kg[3]而且仅限于冷冻饮品、糖果剂焙烤食品挂浆,因此,合成着色剂的检测已成为食品安全质量控制的重要指标。在常规检测工作中,标准样品是具有一种或多种足够均匀的和很好确定了的特性值的材料和物质,可以用来校准仪器、评价测量方法和给材料赋值,是产品质量控制和保证结果准确度的重要溯源标准[4-6]。目前,我国多种合成着色剂包括偶氮玉红还没有标准样品,均是依靠国外进口,费时费力不经济。本文报道了偶氮玉红标准样品的研制方法,对完善我国国家标准技术体系建设、加强食品安全质量控制具有重要意义。
1 材料与方法
1.1仪器与试剂
Agilent1260液相色谱仪配二极管阵列检测器:美国安捷伦公司;TSQ quantum ultra液相色谱-串联质谱仪:美国Thermo公司;Bruker AV400核磁共振仪:德国Bruker公司;Shimadzu UV-3100紫外-可见光谱分光光度计:德国贺利氏公司;傅里叶转换红外光谱仪:德国Bruker公司;感量为0.1 mg的分析天平:瑞士梅特勒公司;Milli-Q纯水器:美国Millipore公司;IKAKS130型振荡器:德国IK公司。
甲醇和乙腈(色谱纯):默克公司;无水乙醇(分析纯):国药集团化学试剂有限公司;超纯水由Milli-Q纯水器制备;偶氮玉红85(又名酸性红,CAS:3567-69-9,分子式:C20H12N2Na2O7S2,分子量:502.44):购于上海染料研究所。其他试剂,如非提及均为分析纯。
1.2试验条件
用硅胶装填凝胶色谱柱(容量800 mL),以水冲洗凝胶色谱柱备用;称取偶氮玉红粗品2.0 g,溶于30 mL水中,超声溶解,加入助滤剂硅藻土,搅拌15 min后过滤,滤液加入凝胶柱,用纯水冲洗凝胶柱,前期分出少许副色素,收集主色素组分,减压蒸出水分,溶液浓缩至约20 mL,过滤,滤液加入无水乙醇10 mL,产物沉降,再次过滤,以无水乙醇洗涤,室温真空干燥,粉碎,过60目筛,得偶氮玉红纯品(99.5 %)。
1.3色谱条件
色谱柱:Agela Technologies Venusil XBP-C18色谱柱(4.6 mm×150 mm,5 μm,150魡)或相当者;流动相A:20 mmol/L乙酸铵;流动相B:甲醇;流动相采用梯度洗脱,洗脱条件见表1;柱温:室温;进样量:10 μL;检测波长:520 nm。

表1 液相色谱流动相洗脱梯度条件Table 1 Condition of mobile phase for purifying carmosine by HPLC
1.4定性分析
LC-MS/MS的色谱条件:偶氮玉红样品用甲醇溶解,浓度为1.0 μg/mL;色谱柱:Thermo Hypersil GOLD (2.1 mm×100 mm);流动相:20 mmol/L乙酸铵水溶液+甲醇,梯度根据色谱柱和表1适当调整;流速为0.3 mL/min;柱温为室温;进样量5 μL。LC-MS/MS操作条件:ESI源负离子MRM监测模式;雾化气是氮气,压力6.525 kPa;毛细管电压:4 000 V;干燥气温度:300℃;流速:8 L/min;源内裂解电压:175 V;碰撞能量:-35 V;去簇电压:-60 V;扫描范围:m/z 250-800。
偶氮玉红的1HNMR和13CNMR的谱图均是在Bruker AV400上完成,溶剂是氘代二甲亚砜;傅立叶变换红外光谱在Bruker V80光谱仪上完成,样品以KBr样品压片后直接黏附在样品架上,每个谱图扫描32次,分辨率为4 cm-1,背景谱图是空气,红外光谱采用透射模式;紫外-可见光谱用Shimadzu UV-3100 UV-VIS-NIR分光光度计测定,将制备好的偶氮玉红纯品配制成浓度为20 μg/mL的水溶液,用紫外可见光谱进行全波长扫描。
2 结果与分析
2.1纯化条件选择
偶氮玉红粉末用8 %氯化钠水溶液与95 %乙醇组成的混合溶剂(3∶2,体积比)重结晶二次,再以10 %乙酸钾水溶液与95 %乙醇组成的混合溶剂(2∶1,体积比)重结晶二次,最后再以约40℃的95 %乙醇对偶氮玉红滤饼洗涤二次,滤饼于80℃烘干,粉碎,过60目筛,得干剂纯度为98.7 %,产率最高仅为72.3 %。虽然重结晶方法采用试剂较为单纯,但是该方法耗时长,产率低,不经济。
偶氮玉红经凝胶色谱预分析后了解,原料主要杂质为分子量较小的未磺化芳族伯胺和未反应原料以及少许分子量较大的副色素,故可以采用凝胶色谱法分离。考虑到偶氮玉红的理化性质,凝胶色谱采用水作为洗脱溶剂;有考虑到分子量较小的且极性相对较大的杂质对目标物的干扰,加入一定量的助滤剂硅藻土。收集目标产物洗脱液,减压蒸出部分,使得未完全分离、分子量较大的副色素结晶或沉淀以便过滤除去,滤液中加入适量无水乙醇,偶氮玉红产物沉淀,再次过滤并用无水乙醇洗涤后,可以得到纯度较高的偶氮玉红产品,产率还比较可观。经室温干燥、粉碎、过筛后,采用HPLC法对其纯度进行验证,纯度为99.5 %,满足标准样品的要求。偶氮玉红,若是通过均匀性和稳定性检验,再经多家实验室定值,应该可以作为实验室在日常检测中的对照品或标准品使用。
2.2定性分析
对制备的纯品通过核磁共振、红外光谱和液相色谱-质谱进行定性分析。分析偶氮玉红1HNMR数据如下:δ8.10(1H,s)、7.56(1H,t)、9.00(-OH,d)、8.68 (1H,d)、8.03(1H,s)、8.46(1H,t)、7.80(1H,t)、7.70 (1H,t);其13CNMR数据如下:133.54、120.95、125.15、 122.19、125.45、112.26、131.55、126.01、126.01、133.23、144.31、126.69、130.37、128.95、128.81、133.54;红外光谱的特征吸收峰:3 435、1 604、1 500、1 474、1 435、1409、1277、1191、1046、1002、762、687、654、625、595cm-1,与报道和有机化合物结构鉴定工具书涉及内容[7]吻合良好;分析偶氮玉红的液相色谱-质谱/质谱的总离子流图和一级质谱图(图1),可知,出峰时间约12 min,扫出质荷比为456.92的[M-2Na+H]-离子峰和479.18的 [M-Na]-离子峰。核磁共振成像、红外光谱、质谱之间结果既独立又能相互印证,与文献报道[8-9]的偶氮玉红的结构信息吻合,证明样品是偶氮玉红。
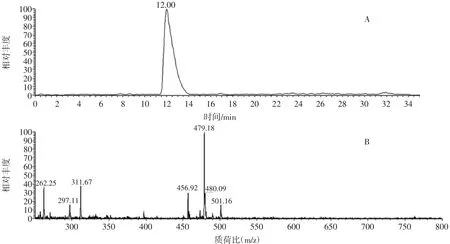
图1 偶氮玉红液相色谱质谱总离子流图(A)和一级质谱图(B)Fig.1 Total ion chromatogram(A)and mass spectra(B)of carmosine
2.3均匀性与稳定性检验
2.3.1均匀性检验
采用随机顺序重复测量方法,从分装后的样品中随机抽取10瓶样品,按3种程序分别从每瓶中称取1.0 mg样品3份,每份样品分别用10.0 mL去离子水溶解,进行HPLC分析,计算其纯度。采用方差分析法进行检验,对其均匀性做出判断。表2为均匀性检验的测量数据。

表2 均匀性检验的测量数据Table 2 Data measured for homogeneity test of carmosine

续表2均匀性检验的测量数据Continue table 2 Data measured for homogeneity test of carmosine
对上述数据进行方差分析和F检验,查F界值表,得F0.05(9,20)=2.94,由于F= MSamong/MSwithin=1.62<F0.05(9,20),所以本样品是均匀的。
2.3.2稳定性检验
样品分装后,于室温下干燥避光密闭保存。以24个月为期对制备的偶氮玉红标准样品每6个月取样检验,每份试样以测定5次的平均值为其测量结果,以其数据的数据做散点图,观察因变量(纯度)与自变量(月份)是否具有线性关系。从散点图(图2)可以看出,0~24个月的纯度值与其时间存在明显的线性关系,故采用直线作为经验模型,通过观察斜率值是否有显著变化对标准样品的稳定性进行预测,用t检验对数据进行统计分析斜率,斜率变化不显著,说明偶氮玉红标准样品在两年内未观测到显著的不稳定性。

图2 偶氮玉红稳定性检验结果的散点图Fig.2 Scatter diagram of carmosine for satability testing.
2.4标准样品的定值
经紫外分光光度计进行全扫描后发现偶氮玉红在波长285、330、520 nm处有特征吸收,其中520 nm吸收值最强,而且此波长下干扰物质最少,因此,HPLC定值分析选择520 nm,其色谱图见图3。

图3 偶氮玉红的液相色谱图Fig.3 Chromatogram of carmosine by HPLC
按照GB/T 15000.3-2008《标准样品工作导则(3)标准样品定值的一般原则和统计方法》标准要求,采用8家获得国家认可、具备资质的实验室协作定值。随机抽取48瓶样品,每个实验室6瓶,按照上述HPLC条件应用面积归一法进行定值,图2为偶氮玉红的典型液相色谱图,表3为8家实验室对偶氮玉红样品的定值结果汇总。
用格拉布斯(Grubbs)检验法对8家实验室数据进行统计分析,剔除可疑值后计算其平均值及标准偏差。偶氮玉红标准样品的定值结果为:标准值:99.23 %;置信度为95 %的扩展不确定度值:0.38 %;实验室内标准偏差Sr:0.06 %;实验室间标准偏差SL:0.09 %。

表3 定值结果汇总表Table 3 Multi-lab certification result collected in one table
3 结论
采用凝胶色谱技术对市售偶氮玉红原料纯化,制得偶氮玉红纯品。通过核磁共振(1HNMR谱、13CNMR谱)、红外光谱和LC-MS/MS对偶氮玉红纯品进行定性分析,8家实验室应用HPLC法进行协同定值,偶氮玉红纯度为(99.23±0.38)%,满足标准样品的要求,为产品质量控制、检测方法验证和保证实验室测量结果的准确可靠与互认建立了溯源标准,对完善我国国家标准技术体系建设具有重要意义。
参考文献:
[1]王惠琴,郑大威,林太凤,等.食用色素在食品中的应用及检测方法研究[J].食品工程,2009(4): 3-5
[2]卢士英,邹明强.食品中常见的非食用色素的危害与检测[J].中国仪器仪表,2009(8): 45-50
[3]中华人民共和国国家卫生和计划生育委员会. GB2760-2014食品安全国家标准食品添加剂使用标准[S].北京:中国标准出版社,2014
[4]韩永志.标准物质的稳定性检测及评价[J].化学分析计量,2001 (10):37-39
[5]钱耆生.分析测试质量保证[M].大连:辽宁大学出版社, 2004: 576-578
[6] Stklker A A M,Brinkman U A Th.Analytical strategies for residue analysis of veterinary drugs and growth-promoting agents in foodproducing animals-a review[J].J Chromatogr A,2005,1067(1): 15-53
[7]宁永成.有机化合物结构鉴定与有机波谱学[M].北京:科学出版社,2004:322-363
[8] Yoshioka N, Ichihashi K. Determination of 40 synthetic food colors in drinks and candies by high-performance liquid chromatography using a short column with photodiode assay detection[J]. Talanta, 2008, 74(5): 1408-1413
[9] Feng F, Yansheng Zh,Wei Y,et al. Highly sensitive and accurate screening of 40 dyes in soft drinks by liquid chromatography-electrospray tandem mass spectrometry[J]. J Chromatogr B, 2011, 879 (20):1813-1818
Preparation and Certification of Reference Sample Carmosine Derived from Synthetic Colorant
HE Gui-hua1,HAN Huan-mei1,*,ZHENG Xin-hua1,ZHANG Ai-xia1,CHEN Xi1,WANG Le1,GENG Yan-ling2,WANG Xiao2,DUAN Wen-juan2,ZHAO Heng-qiang2
(1. Jinan Entry-Exit Inspection and Quarantine Bureau,Jinan 250014,Shandong,China;2. Shandong Analysis and Test Center,Jinan 250014,Shandong,China)
Abstract:A methodology regarding the preparation and certification of certified reference sample of carmosine was presented.Carmosine on sale was purified by gel chromatography technology,and then the collection was precipitated and washed with alcohol. The production was processed with vacuum drying at room temperature,mashing and sieving continuously to be pure sample. After the qualitative analysis of carmosine by1HNMR spectrum and(13)CNMR spectrum,infrared spectrum and LC-MS/MS,homogeneity test and stability testing were employed. And then,the purity was certified by HPLC in different 8 qualified laboratories,the result analyzed statistically was 99.23 %±0.38 %.
Key words:carmosine;standard sample;synthetic colorant
收稿日期:2015-02-02
*通信作者
作者简介:何桂华(1968—),女(汉),高级工程师,硕士,主要从事食品检验研究。
基金项目:国家质检总局科研项目(2012IK178);山东局科研项目(SK201424)
DOI:10.3969/j.issn.1005-6521.2016.08.034
