薯蓣属5种药食同源植物红外光谱鉴别研究
2016-05-18齐路明王元忠张霁金航云南中医学院云南昆明650500云南省农业科学院药用植物研究所云南昆明65000
齐路明,王元忠,张霁,金航,*(1.云南中医学院,云南昆明650500;.云南省农业科学院药用植物研究所,云南昆明65000)
薯蓣属5种药食同源植物红外光谱鉴别研究
齐路明1,2,王元忠2,张霁2,金航1,2,*
(1.云南中医学院,云南昆明650500;2.云南省农业科学院药用植物研究所,云南昆明650200)
摘要:采用傅里叶变换红外光谱(FT-IR)结合化学计量学鉴别不同种药食同源薯蓣植物。采集云南5种药食同源薯蓣属(淮山药、黄独、高山薯蓣、粘山药、参薯)样品红外光谱数据,选择基线校正、9点平滑、自动归一化、二阶导数等预处理方法对光谱进行优化。原始光谱显示,除粘山药样品,其余4种薯蓣属样品红外光谱相似度较高,在1154、1081、1021、928、763、577cm(-1)附近均出现表征淀粉和一些糖苷类成分的吸收峰。选取1 800 cm(-1)~400 cm(-1)波段二阶导数光谱数据,结合聚类分析(HCA)和偏最小二乘判别分析(PLS-DA)法进一步挖掘红外光谱数据信息。通过HCA提取727个变量建立矩形阵列获得树状图,分类正确率为91.2 %。PLS-DA模型前6个主成分累积贡献率为97.3 %;得分图显示,5种样品分类效果理想。证明FT-IR结合HCA和PLS-DA方法,对5种不同种薯蓣植物的鉴别可行。
关键词:薯蓣;药食同源;红外光谱;聚类分析;偏最小二乘判别分析
药食同源是中医药独有特色之一,许多中药因为该性质而被广泛的使用。薯蓣属(Dioscorea)植物是百合纲薯蓣科(Dioscoreaceae)下的物种,其种类繁多、分布广泛[1]。该属植物在我国有悠久的食、药用历史,最有代表性的是山药,《神农本草经》就有相关的药食两用记载[2]。随着中药相关学科的发展,薯蓣属植物的用途越来越广泛,可作为食用、药用及工业原料[3],具有较大的研究空间。目前关于薯蓣的研究多是围绕薯蓣皂苷元展开,色谱、质谱技术先后运用到这个领域中来[4-5]。同时,许多薯蓣属植物具有相对平和的药性,对于调理人体五脏六腑机能、协调气血津液通畅疗效确切,可以达到治未病的效果,是我国著名的补益之品。随着生活水平不断提高,人们对健康的观念正在悄然发生转变,薯蓣属植物药食两用的性质符合当前人们对于健康的要求。在中药产业中,该类植物有可能凭借独特功效占据重要的市场位置。因此,对药食同源薯蓣属植物的研究也有重要意义。
薯蓣属物种中,淮山药、参薯、黄独等都是有一定营养价值的药膳食品[3,6-8],其块茎含有氨基酸、多糖、矿物质、维生素等对人体有益的营养因子[9-10]。这些植物养生保健效用强度具有较大差异,其中山药的补益效果最好,以往多有研究通过比较外观性状以及显微特征的差异,以达到山药与其它薯蓣属植物鉴别的目的[11-12]。另有研究表明,一些薯蓣属物种的过多食用会引起一定毒副作用[13]。随着以预防、保健[14]为目的的药食同源产品的开发和利用,薯蓣属植物可能越来越多面临加工化、包装化、商品化,难免会出现以次充好的现象,仅靠外观性状和显微特征的鉴别难以满足稳定市场秩序的需要。因此寻找一种更加有效快速的鉴别方法显得重要。
目前消费者对药品、食品关注度不断增加,对其品质快速检测也提出更高标准[15]。有机物分子中,组成化学键或官能团的原子处于不断振动状态,利用红外光谱技术,分子中的化学键或官能团可发生不同吸收频率的振动吸收,因此在红外光谱上可获得分子中化学键或官能团的信息[16]。与其它鉴别方法相比,傅里叶变换红外光谱可获得样品的整体信息,有直接、快速、无损、简便等优点[17-18]。近年来,该项技术结合化学计量学方法广泛用于食品药品的产地、真伪鉴别。Kwon 等[19]用红外光谱结合聚类分析鉴别亚洲山药和非洲山药,结果表明两个地区的山药在表征多糖和蛋白质的红外光谱波段上存在明显差异。Anjos[20]等结合偏最小二乘回归模型预测不同产地蜂蜜中糖的含量,取得较好效果。Fan[21]等结合主成分分析和偏最小二乘判别分析方法对不同产区的天麻进行了准确鉴别。本试验采用傅里叶变换红外光谱技术结合化学计量学方法对5种药食同源薯蓣属植物进行鉴别研究,以期为薯蓣属植物提供一种有效、快速的鉴别方法。
1 材料与方法
1.1材料
试验中5种药食同源薯蓣属植物共34份样品均采自云南地区,经云南省农业科学院药用植物研究所张金渝研究员鉴定为淮山药(Dioscorea opposita)、高山薯蓣(Dioscorea henryi)、黄独(Dioscorea bulbifera)、粘山药(Dioscorea hemsleyi)、参薯(Dioscorea alata)。样品信息见表1。

表1 五种薯蓣属植物的来源Table 1 Source of five species in genus Dioscorea
样品采集后,清洗干净,去皮,保留块茎部位,将块茎切成薄片,置于干净白纸上,常温下阴干,用中药粉碎机粉碎,过100目筛,存放于干燥密封袋中,备用。
1.2仪器与试剂
Frontier型傅里叶变换红外光谱仪:Perkin Elmer公司,配备DTGS检测器,扫描范围为4000cm-1~400cm-1,分辨率为4 cm-1,扫描信号累加16次;100目标准筛:浙江上虞市道墟五四仪器厂;FW-100型高速万能粉碎机:天津市华鑫仪器厂;XS125A型电子分析天平:瑞士Precisa公司;YP-2型压片机:上海市山岳科学仪器有限公司。
溴化钾(分析纯):天津市风船化学试剂科技有限公司。
1.3光谱采集
按1∶40质量比称取薯蓣样品和溴化钾粉末,以先后顺序将样品和溴化钾放入玛瑙研钵中研磨均匀,压片测定光谱。光谱平均扫描3次,取平均光谱进行分析。
1.4光谱预处理
原始光谱中,除了与样品化学物质相关的信息,还包含各种因素产生的噪音信号,对光谱信息会产生干扰,影响校正模型建立和对未知样品组成的预测[22]。为减弱试验过程基线漂移、样品浓度等非目标因素影响,利用Omnic 8.0软件依次对原始光谱进行9点平滑、基线校正、归一化处理。
1.5精密度、稳定性和重复性试验
1.5.1精密度试验
以1号淮山药样品为考察对象,同1.3中的方法,重复扫描5次红外光谱,所得光谱经1.4预处理,利用TQ软件分别将5条红外光谱与平均光谱进行相似度匹配,匹配值在99.98~100.00之间,用光谱数据的匹配值计算平均相对标准偏差RSD为0.009 %,表明该方法精密度好。
1.5.2稳定性试验
以1号淮山药样品为考察对象,每隔10 min进行一次红外光谱测定,所得光谱经1.4预处理,匹配值在99.11~99.99之间,用光谱数据匹配值计算平均相对标准偏差RSD为0.37 %,表明该方法重现性好。
1.5.3重现性试验
以1号淮山药样品为考察对象,同1.3分别压片5次,所得光谱经1.4预处理,匹配值在99.43~99.87之间,用光谱数据的匹配值计算平均相对标准偏差RSD 为0.54 %,表明该方法稳定性好。
2 结果与讨论
2.1不同种薯蓣红外光谱分析
红外光谱反映物质的整体吸收特性,与中医的整体观念一致,能全面反映出样品官能团和化学键信息[23],根据红外光谱可以大致分析出5种药食两用薯蓣属植物的化学成分特征。
5种薯蓣属样品的平均红外光谱图见图1。

图1 5种薯蓣属植物的原始光谱Fig.1 The original spectra of five species in genus Dioscorea
除粘山药样品外,其余4种薯蓣属样品红外光谱相似度较高,在3 400 cm-1附近为O-H伸缩振动吸收峰;2 929 cm-1附近为亚甲基CH2反对称伸缩振动吸收峰;1 645 cm-1附近主要为O-H弯曲振动吸收峰,也有可能包含羰基C=O伸缩振动[24]。在1 154、1 081、1 021 cm-1附近C-O吸收峰最强,和928、763、577 cm-1附近吸收峰都表征淀粉和一些糖苷类成分[25],提示薯蓣属植物块茎中含有丰富的淀粉和糖类成分[26],也许是表征薯蓣属植物药食两用性质的特征之一。粘山药样品和其它4种样品的红外光谱差异较大,在1 733、1 625、1 377、1 249、1 062、1 030 cm-1等吸收峰都显示出不同特征。通过原始光谱分析,能够将粘山药样品区别出来。
2.2不同种薯蓣的二阶导数光谱分析
二阶导数光谱可放大样品光谱的信息,准确显示样品之间的差异,5种薯蓣属样品二阶导数谱见图2。
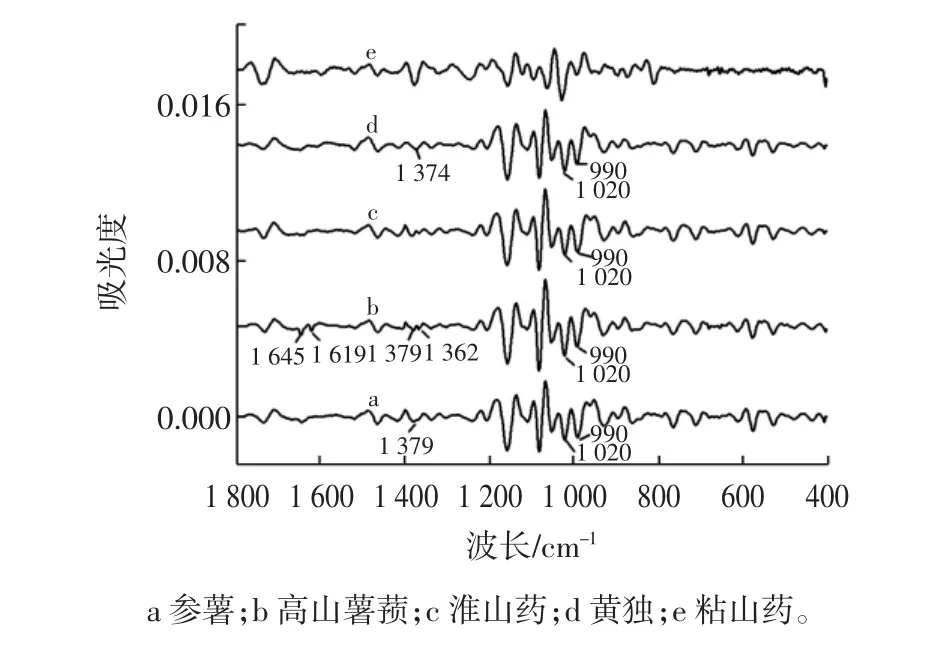
图2 5种薯蓣属植物的二阶导数光谱Fig.2 The second derivative spectra of five species in Dioscorea
在1 800 cm-1~400 cm-1波段范围内,能够得到更多的光谱特征差异。参薯和高山薯蓣样品在1645cm-1处都出现中等强度的吸收峰,可以与其它样品区分出来;高山薯蓣在1 619 cm-1附近的吸收峰可以与其它样品区分;通过1 379 cm-1和1 362 cm-1吸收峰可以对黄独样品进行区分;另外,淮山药和参薯样品在1 020 cm-1和990 cm-1附近峰强相当,黄独和高山薯蓣这两个峰的峰强明显不同,也可以作为区分这4个物种的依据。由此可见,5种薯蓣属样品红外光谱在1 800 cm-1~400 cm-1波段范围存在较多特征差异,为实现对5种具有药食同源性质的薯蓣属植物鉴别研究奠定基础。
2.3HCA分析
HCA是一种无监督模式识别方法,常用于样品分类,特别适用于样品归属不清楚的情况,不需要输入其它任何信息[27]。选取5种薯蓣属物种特征性较强的1 800 cm-1~400 cm-1波段内的二阶导数光谱,通过SPSS 20.0分析软件,提取727个变量建立矩形阵列,应用平均组内联接算法,采用余弦相似度作为度量标准,获得这5种薯蓣属样品的树状分类效果,见图3。

图3 五种薯蓣属植物聚类分析树状图Fig.3 Dendrogram for cluster analysis of five species in genus Dioscorea plants
由图3可知,参薯、黄独和粘山药样品都被准确分类,3号、5号高山薯蓣样品以及3号淮山药样品分类错误,正确率为91.2 %。树状图显示,淮山药和参薯样品首先聚为一类,说明这两个物种具有较近的亲缘关系;粘山药样品最后和其它4种薯蓣属样品聚在一起,表明粘山药与其它4种薯蓣属样品的差异性较大,这和红外光谱初步分析的结论一致。由于淮山药和参薯化学成分和药理作用非常相似,在实际应用中参薯常常会代替山药入药[28],所以参薯在树状图中最先和淮山药聚为一类。至于粘山药,在云南某些地区经过煮和蒸熟后一般代粮食用[7],几乎没有研究表明粘山药具备与养生保健的功效,这可能是在HCA中粘山药最后与其他样品聚在一起的原因。两个高山薯蓣样品分类错误,可能是随机误差所致,也有可能与该物种和其它薯蓣相似度较高有关。综上所述,除高山薯蓣样品,傅里叶变换红外光谱结合HCA对薯蓣属样品分类效果准确,通过余弦相似度,能够大致判断这5种薯蓣属植物的亲缘关系。
2.4PLS-DA分析
鉴于HCA过程中出现聚类错误的样本,本文尝试用PLS-DA对5种薯蓣属样品进行鉴别,以期获得更好的鉴别效果。PLS-DA是一种有监督的降维方法,通过提取主成分或者潜在变量达到鉴别目的[29]。为了获取更多的差异特征,选取样品在1 800 cm-1~400 cm-1波段内的二阶导数光谱数据进行PLS-DA分析。通过提取主成分,前6个主成分的累积贡献率为97.3 %,能够解释5种样品红外光谱的大部分数据信息。以主成分1、主成分2和主成分3得分值为坐标轴建立该类植物红外光谱得分图见图4。
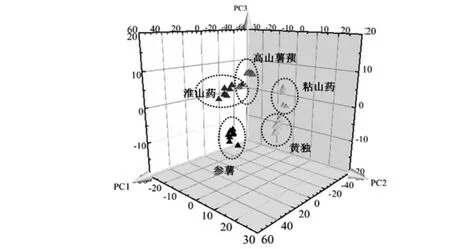
图4 五种薯蓣属植物偏最小二乘判别分析散点得分图Fig.4 Scattered 3D scores plot for PLS-DA analysis of five species in genus Dioscorea
得分图显示,相较于HCA,PLS-DA对5种薯蓣属样品的分类效果更好。但是3号高山薯蓣样品分类仍然和淮山药分为一组,可能是由于误差所致。其余薯蓣属样品在图中位置分类界限清楚,所建立的分类模型可清晰的将不同物种样品分为5类,傅里叶变换红外光谱技术结合PLS-DA模型,可以对5种药食两用的薯蓣属植物准确的鉴别分类。
3 结论
药食同源的性质是我国中药的鲜明特色之一,薯蓣属植物在我国民间历史悠久,在应用过程中积累了众多宝贵的经验。本文认为在注重利用先进科学技术对其有效成分提取的同时,回归其本身自然质朴的保健护理效用研究有较大的价值,也更能体现出我国传统中医药独树一帜的思想观念。另外,随着现在社会对于养生保健要求的不断加强,薯蓣属植物因其独特的性质将会面临着更加广泛的应用。本文主要意义是探究傅里叶红外光谱结合化学计量学方法对药食两用薯蓣属植物快速准确鉴别的可行性,以为其在市场中的真伪鉴别打下基础。
本文通过傅里叶变换红外光谱技术结合偏最小二乘判别分析和聚类分析法对5种薯蓣属样品进行鉴别。对原始光谱进行9点平滑,基线校正,归一化等预处理。对红外光谱初步分析,选取具有指纹性的1 800 cm-1~400 cm-1光谱波段进行二阶导数处理,除粘山药外,其它4种薯蓣属物种的相似度比较高。结合HCA和PLS-DA两种方法,可以将这5种药食同源的薯蓣属植物完全鉴别开,表明傅里叶变换红外光谱技术对药食同源的薯蓣属植物的鉴别可行,可提供一种有效、快速的鉴别方法。夹角余弦相似度显示,淮山药和参薯的相似度比较高,说明参薯的化学性质与淮山药最相似,而粘山药的药理作用和养生保健的功效则可能与其它物种差异最大。如若明确薯蓣属植物药理和保健功效差异,则需对其主要有效成分进行更加详细的分析。
参考文献:
[1]裴鉴.中国植物志[M].北京:科学出版社, 1985: 16
[2]聂桂华,董秀华.山药的研究概况[J].中草药, 1993, 24 (3): 158-160
[3]徐有明,李双来,郭治成,等.薯蓣属植物基础研究进展与开发利用[J].湖北林业科技, 2005(3): 37-41
[4] Raman V, Galal A M, Avula B, et al. Application of anatomy and HPTLC in characterizing species of Dioscorea (Dioscoreaceae)[J]. Journal of Natural Medicines, 2014, 68(4): 686-698
[5] Li R, Zhou Y, Wu Z, et al. ESI-QqTOF-MS/MS and APCI-IT-MS/ MS analysis of steroid saponins from the rhizomes of Dioscorea panthaica[J]. Journal of Mass Spectrometry, 2006, 41(1): 1-22
[6]袁书林.山药的化学成分和生物活性作用研究进展[J].食品研究与开发, 2008, 29(3): 176-179
[7]刀志灵,龙春林,刘怡涛.云南高黎贡山怒族对植物传统利用的初步研究[J].生物多样性, 2003,11 (3): 231-239
[8] Bhandari M R, Kasai T, Kawabata J. Nutritional evaluation of wild yam (Dioscorea spp.) tubers of Nepal[J]. Food Chemistry, 2003, 82 (4): 619-623
[9] Hu G, Hu S Q. Manufacture and Nutritional Analysis of Chinese Yam Jam[J]. Advanced Materials Research, 2012, 554: 973-977
[10] Lu Y L, Chia C Y, Liu Y W, et al. Biological activities and applications of dioscorins, the major tuber storage proteins of yam[J]. Journal of traditional and complementary medicine, 2012, 2 (1): 41
[11]安木讷.山药及其易混品伪品的鉴别[J].中草药, 1999 (8): 32
[12]杭悦宇,徐珞珊,史德荣,等.中国薯蓣属植物地下茎淀粉粒形态特征及其分类学意义[J].植物资源与环境学报, 2007, 15(4):1-8
[13]徐增莱,丁志遵.黄药子的研究概况[J].中草药,1998,29(2): 125-128
[14]王震宙,黄绍华.山药中的功能保健成分及其在食品加工中的应用[J].食品工业, 2004, 25 (4): 51-52
[15]褚小立,陆婉珍.近五年我国近红外光谱分析技术研究与应用进展[J].光谱学与光谱分析, 2014, 34 (10): 2595-2605
[16] Cheng C, Liu J, Zhang C, et al. An overview of infrared spectroscopy based on continuous wavelet transform combined with machine learning algorithms: application to chinese medicines, plant classification, and cancer diagnosis [J]. Applied Spectroscopy Reviews, 2010, 45 (2): 148-164
[17] Jiang Y, David B, Tu P, et al. Recent analytical approaches in quality control of traditional Chinese medicines-a review[J]. Analytica Chimica Acta, 2010, 657 (1): 9-18
[18] Bunaciu A A, Aboul-Enein H Y, Fleschin S. Application of Fourier transform infrared spectrophotometry in pharmaceutical drugs analysis[J]. Applied spectroscopy reviews, 2010, 45 (3): 206-219
[19] Kwon Y K, Jie E Y, Sartie A, et al. Rapid metabolic discrimination and prediction of dioscin content from African yam tubers using Fourier transform-infrared spectroscopy combined with multivariate analysis[J]. Food Chemistry, 2015, 166: 389-396
[20] Anjos O, Campos M G, Ruiz P C, et al. Application of FTIR-ATR spectroscopy to the quantification of sugar in honey[J]. Food Chemistry, 2015, 169: 218-223
[21] Fan Q, Chen C, Lin Y, et al. Fourier Transform Infrared (FT-IR) Spectroscopy for discrimination of Rhizoma gastrodiae (Tianma) from different producing areas[J]. Journal of Molecular Structure, 2013, 1051: 66-71
[22]张银,周孟然.近红外光谱分析技术的数据处理方法[J].红外技术, 2008, 29(6): 345-348
[23] Choong Y K, Sun S Q, Zhou Q, et al. Determination of storage stability of the crude extracts of Ganoderma lucidum using FTIR and 2DIR spectroscopy[J]. Vibrational Spectroscopy, 2011, 57 (1): 87-96
[24]马芳,张方,汤进,等.不同产地茯苓皮药材红外光谱的识别[J].光谱学与光谱分析, 2014, 34(2): 376-380
[25]黄冬兰,陈小康,徐永群,等.三七炮制前后的红外光谱分析研究[J].光谱学与光谱分析, 2014, 34 (7):1849-1852
[26] Shujun W, Hongyan L, Wenyuan G, et al. Characterization of new starches separated from different Chinese yam (Dioscorea opposita Thunb.) cultivars[J]. Food Chemistry, 2006, 99(1): 30-37
[27] Trebuňa P, Halc姚inová J. Mathematical tools of cluster analysis[J]. Applied Mathematics, 2013, 4(5): 814
[28]杭悦宇,秦慧贞.山药新药源的调查和质量研究[J].植物资源与环境, 1992, 1(2): 10-15
[29] Bassbasi M, De Luca M, Ioele G, et al. Prediction of the geographical origin of butters by partial least square discriminant analysis (PLS-DA) applied to infrared spectroscopy (FTIR) data[J]. Journal of Food Composition and Analysis, 2014, 33(2): 210-215
Study on Discrimination of Five Species of Medicinal and Edible Dioscorea Plants by Fourier Transform Infrared(FT-IR)Spectroscopy
QI Lu-ming1,2,WANG Yuan-zhong2,ZHANG Ji2,JIN Hang1,2,*
(1. Yunnan University of Traditional Chinese Medicine,Kunming 650500,Yunnan,China;2. Institute of Medicinal Plants,Yunnan Academy of Agricultural Sciences,Kunming 650200,Yunnan,China)
Abstract:Fourier transform infrared(FT-IR)spectroscopy combined with chemometrics methods were used to discriminate different species of medicinal and edible plants of genus Dioscorea. The infrared spectra of five species of medicinal and edible plants of genus Dioscorea(Dioscorea opposita、Dioscorea bulbifera、Dioscorea henryi、Dioscorea hemsleyi、Dioscorea alata)were collected. The original spectra were optimized by 9-point smoothing,multipoint baseline correction and automatic normalization. According to the preliminary analysis of spectra data,apart from D. hemsleyi,we could find that other four species of Dioscorea plants had high similarities. The peaks at 1 154,1 081,1 021,928,763,577 cm(-1)were strongest characterize the chemical composition of starch and some glycosides. The second derivative spectra in the region from 1 800 cm(-1)to 400 cm(-1)were selected for hierarchical cluster analysis(HCA)and partial least square discriminant analysis(PLS-DA). By HCA,727 variables were extracted to build a rectangular array for obtaining the dendrogram. The rate of correct classification was 91.2 %. The results of PLS-DA showed that,the cumulative contribution of first six principal components was 97.3 %. At the same time,the classification result in scores plot was satisfactory. The study demonstrated that FT-IR spectroscopy coupled with HCA and PLS-DA could discriminate the different species of medicinal and edible plants of Dioscorea satisfactorily.
Key words:Dioscorea;medicinal and edible;fourier transform infrared spectroscopy;hierarchical cluster analysis;partial least squares discriminant analysis
收稿日期:2015-02-02
*通信作者:金航(1964—),男(汉),研究员,学士,主要从事药用植物资源学方面的研究。
作者简介:齐路明(1990—),男(汉),硕士研究生,主要从事中药资源与开发研究。
基金项目:农业部公益性行业科研专项(201303117)
DOI:10.3969/j.issn.1005-6521.2016.08.033
