干豆制品用大豆中大豆异黄酮提取工艺研究
2016-05-18顾建明蒋盼上海大学生命科学学院上海市能源作物育种及应用重点实验室上海200444
顾建明,蒋盼(上海大学生命科学学院,上海市能源作物育种及应用重点实验室,上海200444)
干豆制品用大豆中大豆异黄酮提取工艺研究
顾建明,蒋盼
(上海大学生命科学学院,上海市能源作物育种及应用重点实验室,上海200444)
摘要:以干豆制品加工用大豆为原料,研究了浸提温度、浸提时间、超声波处理时间和大豆压制厚度对大豆中大豆异黄酮和大豆蛋白浸出效果的影响,经过正交试验和结果分析得到大豆异黄酮浸出的最佳处理组合为超声波处理时间40min,压制厚度10%,浸提温度55℃,浸提时间12h,以此每吨大豆可回收大豆异黄酮790.67g。
关键词:大豆;大豆异黄酮;回收;食品
在我国大豆制品加工具有悠久的历史,大小加工厂遍布城乡各地,其中每年用于老豆腐、豆腐干、百叶、素鸡等干豆制品加工的大豆数量十分巨大。在这些干豆制品生产过程中,点卤后的压滤会产生大量的废水,废水的排放对环境造成了严重的污染,这些废水中含有丰富的大豆可溶性保健功能物质,如大豆异黄酮(soybean isoflavone),研究显示,由此造成的大豆异黄酮的损失约占大豆异黄酮总量的44 %[1-2]。
大豆异黄酮具有类雌激素活性,能缓解妇女更年期综合症状且安全性高[3],抗氧化性[4-5],抗癌活性[6-7],以及预防骨质疏松[8]、缓解糖尿病症状[9-10]和预防心血管疾病[11-12]的作用。
异黄酮在自然界中的资源十分有限,仅分布于豆科的蝶形亚科的极少数植物中,大豆是唯一含异黄酮且其含量具有人体保健功能意义的食物资源[13]。大豆异黄酮有四类12种存在形式:异黄酮甙元(大豆黄素daidzein、黄豆黄素glycitein、染料木素genistein),β-葡萄糖甙(daidzin、glycitin、genistin),6"-O-乙酰基葡萄糖甙和6"-O-丙二酰基葡萄糖甙。
目前市场上销售的大豆异黄酮从脱脂大豆粕中提取制得,从干豆制品加工用大豆中采用本论文的预处理方法回收大豆异黄酮的研究鲜见报道[14-19]。与从干豆制品加工过程中压滤出的黄浆水中回收大豆异黄酮相比较,本论文旨在进一步寻求一种高效、经济、高品质和适合工业化生产的回收大豆异黄酮的方法。
1 材料和方法
1.1材料
考马斯亮蓝G-250、牛血清蛋白质、甲醇(色谱纯),乙腈(色谱纯),磷酸(分析纯,≥85 %),BHT(色谱纯,纯度≥99 %);大豆异黄酮(Daidzein,Glycitein,Genistein,纯度≥99 %)购自同田生化技术有限公司;大豆购于当地超市。
1.2仪器
恒温干燥箱(DHG-9240A):上海精宏实验设备有限公司;电热恒温水浴锅(HWS24型):上海一恒科学仪器有限公司;KQ-100超声仪(40KHZ/100W):上海施兰自动化设备有限公司;低速离心机(YXJ-1型):江苏金坛市环宇科学仪器厂;电子分析天平(AB104):METTL ER-TOLEDO Group,梅特勒-托利多仪器(上海)有限公司;高效液相色谱仪(LC-20A):日本岛津,SPD-20A紫外检测器、CTO-10AS柱温箱、LC-20AT泵。
1.3方法
1.3.1大豆异黄酮的测定
1.3.1.1标准曲线回归方程
准确称取大豆黄素、黄豆黄素、染料木素标准样品各5 mg,甲醇溶解后定容于50 mL容量瓶中,配置成3种大豆异黄酮的标准品母液(0.1 mg/mL),4℃保存备用。
在紫外区(199 nm~400 nm)扫描确定其最大吸收波长[20]。
准确吸取大豆异黄酮标准品母液1.0、2.0、4.0、6.0、8.0、10.0 mL于10 mL容量瓶中,甲醇定容,制得1、2、4、6、8、10 μg/mL的3种大豆异黄酮的标准溶液。用Ф13 mm,孔径为0.45 μm的有机针孔过滤器过滤于进样瓶中,色谱柱CLC-NH2(Ф6 mm×150 mm),流动相:V乙腈∶V0.001 %磷酸= 28∶72,流速0.7 mL/min,柱温40℃,最大吸收波长下检测,进样10 μL,重复测定3次,绘制大豆黄素、黄豆黄素、染料木素标准溶液的浓度(μg/mL)与峰面积的标准曲线。
1.3.1.2处理样品测定
每个处理均取大豆15 g,加入100 mL水,处理完成后,滤纸过滤,得澄清浸出液,定容至50 mL,4℃保存备用。
取20 mL浸出液,加入25 mL甲醇,50 mL盐酸溶液(4 mol/L),0.75 g BHT,水浴(44.6℃)回流3 h后过滤,收集上清液,用甲醇定容至100 mL,4℃下保存。吸取该处理液500 μL,用Ф13 mm,孔径为0.45 μm的有机针孔过滤器过滤于进样器中,在相同色谱条件下测定样品的峰面积,根据标准曲线方程计算样品中大豆异黄酮的浓度/含量。单因素试验中采用计算定容至50 mL的浓度(μg/mL),正交试验中采用计算15 g大豆中的大豆异黄酮含量(mg)。
1.3.2大豆可溶性蛋白的测定
1.3.2.1标准曲线回归方程
采用考马斯亮蓝染料比色法测定,计算蛋白质浓度(μg/mL)与吸光度(A)的标准曲线回归方程。
1.3.2.2处理样品测定
每个处理均从上述备用澄清浸出液中吸取1 mL,定容至100 mL,再从中吸取1.0 mL稀释液与5.0 mL考马斯亮蓝充分混合,2 min后测定吸光度A(λ=595 nm),按蛋白质标准曲线方程计算可溶性大豆蛋白质浓度,单因素和正交试验中采用的蛋白质浓度(μg/mL)/含量(mg)计算方法同上。
1.3.3干豆制品用大豆中大豆异黄酮的浸出
1.3.3.1浸提时间对大豆异黄酮和大豆蛋白浸出的影响
将大豆压制成原厚度的50 %,浸没于100 mL水中,在25℃下分别放置2、6、12、18、20 h,过滤,分别收集各时间的浸出液,测定浸出液中大豆异黄酮和大豆蛋白的浓度。绘制浸提时间(h)和大豆异黄酮浓度/大豆蛋白浓度(μg/mL)关系的曲线。
1.3.3.2浸提温度对大豆异黄酮和大豆蛋白浸出的影响
将大豆压制成原厚度的50 %,浸没于100 mL水中,在2、25、35、45、55、65、75℃下分别放置12 h,过滤,分别收集各温度下的浸出液,测定浸出液中大豆异黄酮和大豆蛋白的浓度。绘制浸提温度(℃)和大豆异黄酮浓度/大豆蛋白浓度(μg/mL)关系的曲线。
1.3.3.3压制厚度对大豆异黄酮和大豆蛋白浸出的影响
将大豆分别压制成原厚度的10 %、50 %、100 %,浸没于100 mL水中,在25℃下分别放置18 h,过滤,分别收集各厚度下的浸出液,测定浸出液中大豆异黄酮和大豆蛋白的浓度,绘制压制厚度(%)和大豆异黄酮浓度/大豆蛋白浓度(μg/mL)关系的曲线。
1.3.3.4超声波处理时间对大豆异黄酮和大豆蛋白浸出的影响
将大豆压制成原厚度的50 %,浸没于100 mL水中,在室温下超声波(40 kHz,100 W)分别处理10、20、30、40、50、60 min,过滤,分别收集各处理浸提液,测定浸提液中大豆异黄酮和大豆蛋白的浓度,绘制超声波处理时间(min)和大豆异黄酮浓度/大豆蛋白浓度(μg/mL)关系的曲线。
1.3.3.5大豆异黄酮的最佳浸出条件
大豆异黄酮的最佳浸出条件采用正交试验L9(34)来确定。选取浸出时间(h)、浸出温度(℃)、压制厚度(%)、超声波处理时间(min)四个因素三水平进行试验(见表1)。浸出液经过滤后,测定每个处理大豆浸出液中的大豆异黄酮和大豆蛋白含量(mg/15 g大豆),在相对有较高的大豆异黄酮浸出的前提下,尽可能兼顾有较少的大豆蛋白浸出,以此评价每个处理并得出最佳大豆异黄酮的浸出条件。
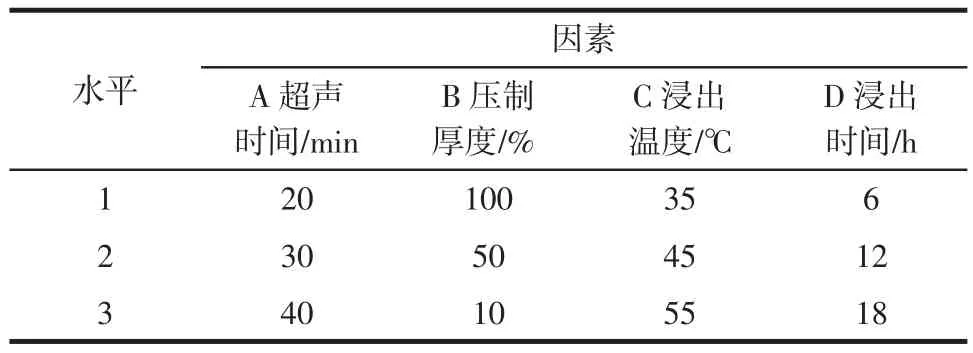
表1 浸出正交试验的因素和水平表L9(34)Table 1 The factors and levels of orthogonal design for soybean leaching,L9(34)
2 结果和讨论
2.1大豆异黄酮测定的标准曲线回归方程
大豆黄素、黄豆黄素、染料木素的最大吸收波长分别为248、258、260 nm。
3种大豆异黄酮(大豆黄素、黄豆黄素、染料木素)浓度与峰面积方程分别为y=104 835x+4 119.7,R2= 0.990 9;y = 97 218x - 74 013,R2= 0.991 1;y = 53 807x+ 3 914.3,R2=0.990 7,在1 μg/mL~10 μg/mL浓度范围内,浓度与峰面积呈较好的线性关系。
2.2大豆蛋白测定的标准曲线回归方程
蛋白质浓度与吸光度方程为y=0.007 5x+0.043 8,R2=0.991 6。在波长595 nm处,在10 μg/mL~100 μg/mL浓度范围内,蛋白质浓度与吸光度呈较好的线性关系。
2.3浸提时间对大豆异黄酮和大豆蛋白浸出的影响
浸提时间对大豆异黄酮和大豆蛋白浸出的影响见图1。
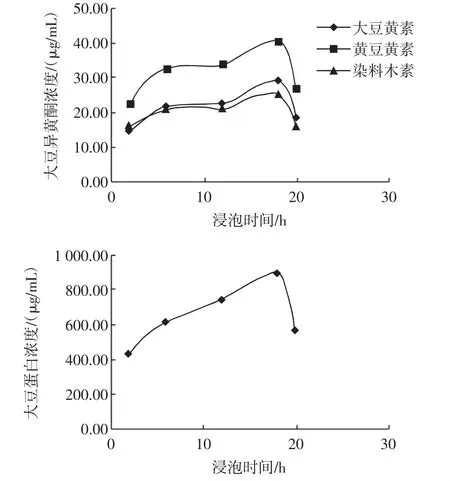
图1 浸提时间对大豆异黄酮和大豆蛋白浸出的影响Fig.1 The effect of soaking time on soybean isoflavones and protein leaching
图1显示,随着浸提时间的延长,3种大豆异黄酮的含量逐渐增加,当达到18 h时,3种大豆异黄酮的含量达到最大值,其中大豆黄素的含量为29.05 μg/mL,黄豆黄素的含量为40.69 μg/mL,染料木素的含量为25.42 μg/mL,但是当浸提时间延长至20h时,3种异黄酮的含量开始下降。同样,浸提开始后,可溶性蛋白的含量不断增加,在18 h达到最大值888.25 μg/mL,18 h后蛋白含量开始下降。这可能与浸提液的微生物腐败有关。因此,5 h~18 h为可选择的浸提时间范围。
2.4浸提温度对大豆异黄酮和大豆蛋白浸出的影响
浸提温度对大豆异黄酮和大豆蛋白浸出的影响见图2。
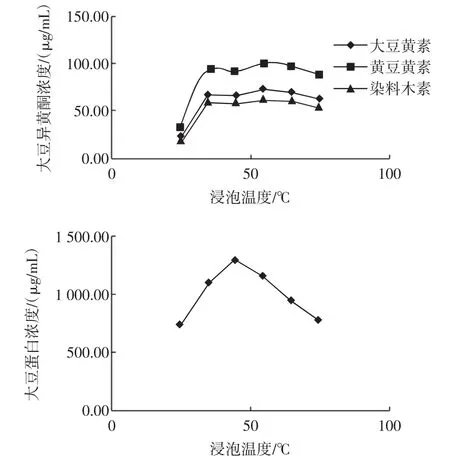
图2 浸提温度对大豆异黄酮和大豆蛋白浸出的影响Fig.2 The effect of soaking temperature on soybean isoflavones and protein leaching
图2显示,随着浸提温度的提高,12 h后,浸提液中3种大豆异黄酮的含量也呈增加趋势,55℃时达到最大值,其中大豆黄素的含量为70.82μg/mL,黄豆黄素的含量为101.88 μg/mL,染料木素的含量为62.53 μg/mL,再提高浸提温度,则3种大豆异黄酮的含量呈下降趋势。同样浸提开始后蛋白含量呈增加趋势,45℃达到最大值1281.50μg/mL,继续提高浸提温度,则蛋白含量呈下降趋势。因此,35℃~55℃为可选择的浸提温度范围。
2.5大豆厚度对大豆异黄酮和大豆蛋白浸出的影响
大豆厚度对大豆异黄酮和大豆蛋白浸出的影响见图3。
图3显示,随着大豆厚度的减小,浸出液中3种异黄酮含量逐渐增加,其中,与50 %厚度相比,10 %厚度的浸提液中,黄豆黄素的含量增加了17.5 %,大豆黄素的含量增加了12.3 %,而染料木素增加却并不明显。大豆蛋白含量也随着大豆厚度的减小而增加,但是,50 %与10 %厚度的含量接近。
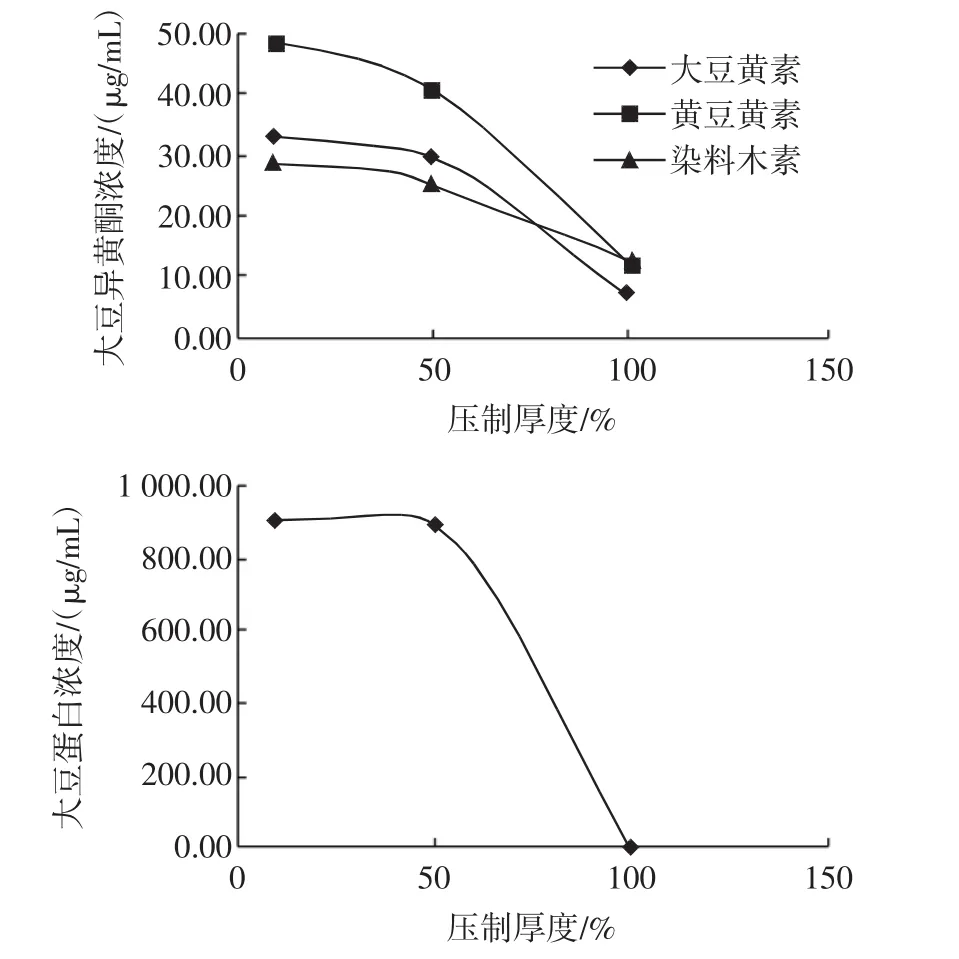
图3 大豆厚度对大豆异黄酮和大豆蛋白浸出的影响Fig.3 The effect of flake thickness on soybean isoflavones and protein leaching
2.6超声波处理时间对大豆异黄酮和大豆蛋白浸出的影响
超声波处理时间对大豆异黄酮和大豆蛋白浸出的影响见图4。
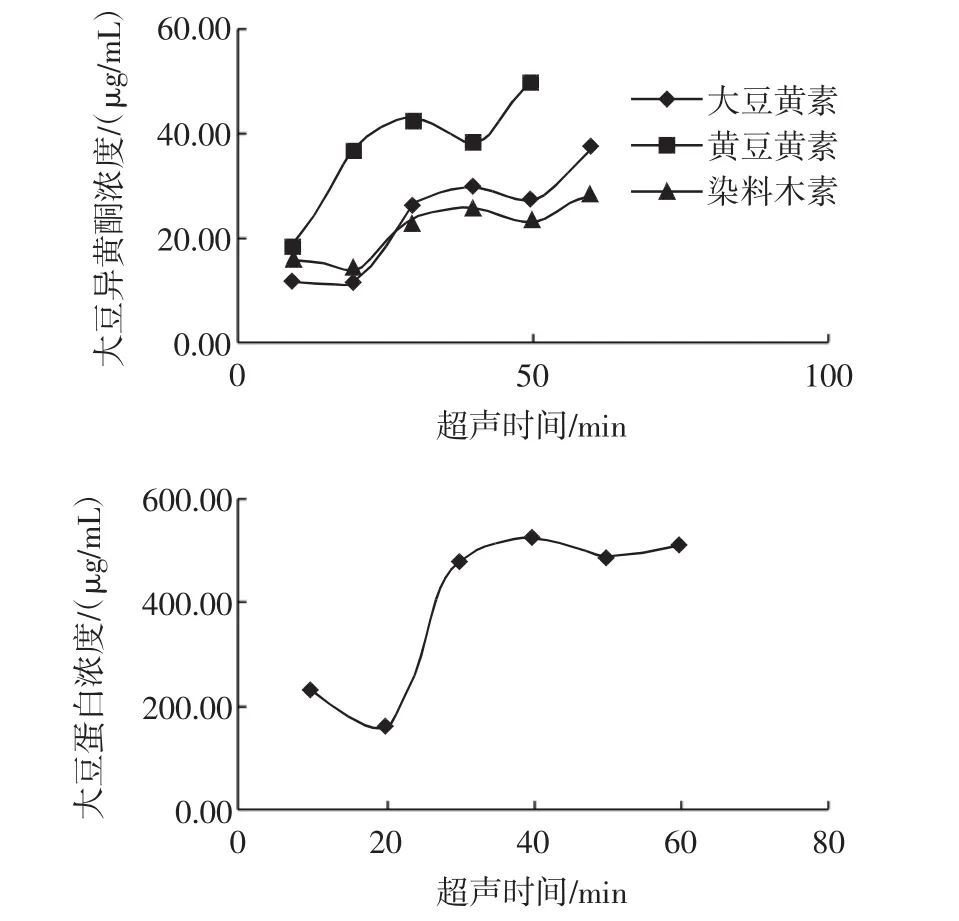
图4 超声波处理时间对大豆异黄酮和大豆蛋白浸出的影响Fig.4 The effect of ultrasonic time on soybean isoflavones and protein leaching
图4显示,随着超声波处理时间的延长,浸提液中大豆异黄酮的含量总体上呈增加趋势,30 min之后,浸提液中大豆蛋白的含量并无显著增加,50 min时,大豆变熟,不利于后续豆制品的制作。因此,20 min~40 min可作为超声波处理选取时间范围。
2.7大豆异黄酮的最佳浸出条件
大豆异黄酮和大豆蛋白浸出正交试验见表2。
从表2可得出大豆异黄酮的最佳浸出条件为大豆黄素A3B3C3D2,影响因素顺序为厚度(B)>温度(C)>超声时间(A)>浸泡时间(D);黄豆黄素A3B3C3D2,影响因素顺序为厚度(B)>温度(C)>超声时间(A)>浸泡时间(D);染料木素A3B3C3D2,影响因素顺序为厚度(B)>温度(C)>超声时间(A)>浸泡时间(D)。可溶性蛋白浸出量最少的最佳浸出条件为A3B1C2D1,影响因素顺序为厚度(B)>温度(C)>浸泡时间(D)>超声时间(A)。
总大豆异黄酮最佳浸出条件为A3B3C3D2,即超声时间40 min,厚度10 %,温度55℃,浸泡时间12 h,影响因素顺序为厚度(B)>温度(C)>超声时间(A)>浸泡时间(D)。采用Design Expert 8.0.5软件进行分析,在该条件下预测值为11.86 mg/15 g,为验证该结果的可靠性,在此参数条件下,进行5组验证试验,实际测得浸出的总大豆异黄酮(大豆蛋白)为12.01(65.04)、9.98 (44.25)、11.35(57.52)、10.21(56.90)、10.92(59.17)mg/15 g,平均值为10.89(56.58)mg/15 g,与预测值偏差仅为-8.2 %,在一般食品分析允许的相对误差范围内(含量<1 %,允许相对误差>5 %),故此预测值可信。按此预处理条件每吨大豆可回收大豆异黄酮790.67 g,大豆蛋白的浸出量在可以接受的范围内,该大豆蛋白采用豆制品加工用凝固剂沉淀后,可回收继续用于后续干豆制品的生产。
3 结论
通过对干豆制品加工用大豆进行预处理(前处理法),最大限度地回收大豆异黄酮,减少在加工过程中因压滤而带来的损失,该方法较从大豆蛋白经凝固和压滤产生的黄浆水中回收大豆异黄酮(后处理法)最大的优点在于提取液水量可控,无大豆蛋白凝固剂残留(如CaSO4、MgCl2),回收成本低,成品质量高,工业化回收生产可行,浸出液可直接用于食品的加工生产。这项技术的研究成果对充分利用大豆食品资源、减少环境污染和降低废水处理成本、提高豆制品生产企业的经济效益都具有重要的参考价值。
参考文献:
[1] Umphress Sabrina T,Murphy Suzanne P,Franke Adrian A,et al. Isoflavone content of foods with soy additives[J]. Journal of food composition and analysis,2005,18(6):533-550
[2] Wang H J, Murphy P A. Isoflavone content in commercial soybean foods[J]. Journal of agricultural and food chemistry, 1994, 42(8): 1666-1673
[3] Levis Silvina,Strickman-Stein Nancy,Doerge Daniel R,et al. Design and baseline characteristics of the soy phytoestrogens as replacement estrogen (SPARE) study-A clinical trial of the effects of soy isoflavones in menopausal women[J]. Contemporary clinical trials, 2010, 31(4):293-302
[4] Gyorgy P,Murata K,Ikehata H. Antioxidants isolated from fermented soybeans[J]. Nature,1964,203:870-872
[5] Zih-Rou Huang,Chi-Feng Hung,Yin-Ku Lin,et al. In vitro and in vivo evaluation of topical delivery and potential dermal use of soy isoflavones genistein and daidzein[J]. International journal of pharmaceutics,2008,364(1):36-44
[6] Mizunuma H,Kanazawa K,Ogura S,et al. Anticarcinogenic effects of isoflavones may be mediated by genistein in mouse mammary tumor virus-induced breast cancer[J]. Oncology,2002,62(1):78-84
[7] Wada K,Nakamura K,Tamai Y,et al. Soy isoflavone intake and breast cancer risk in Japan: from the Takayama study[J]. International journal of cancer,2013,133(4): 952-960
[8] Gilberto Eiji Shiguemoto,Elizeu Antonio Rossi,Vilmar Baldissera,et al. Isoflavone-supplemented soy yoghurt associated with resistive physical exercise increase bone mineral density of ovariectomized rats[J]. Maturitas,2007,57(3):261-270
[9] Lee C H,Lin Y,Jin Ze X,et al. Relative antioxidant activity of soybean isoflavones and their glycosides[J]. Food chemistry,2005,90(4): 735-741
[10] Lund T D,Fleming D E,Dayton J R,et al. Dietary soy phytoestrogens effects on retinal thickness in rats[J]. Nutritional neuroscience,2003, 6(1):47-51
[11] Eliana A P Nahas,Jorge Nahas-Neto,Fabio L Orsatti,et al. Efficacy and safety of a soy isoflavone extract in post-menopausal women: A randomized, double-blind, and placebo-controlled study[J]. Maturitas,2007,58(3):249-258
[12] Nathan Gray. Review backs blood pressure benefits of soy isoflavone [J]. Nutrition, metabolism and cardiovascular diseases,2011,23(2): 34-37
[13]孙君明,丁安林.地理环境对大豆种子中异黄酮含量积累的影响趋势[J].大豆科学,1998,17(4):305-310
[14] Yoshiara L Y,Madeira T B,Delaroza F,et al. Optimization of soy isoflavone extraction with different solvents using the simplex-centroid mixture design[J]. International journal of food sciences and nutrition,2012,63(8):978-986
[15] Niamnuy C,Nachaisin M,Poomsa-ad N,et al. Kinetic modelling of drying and conversation/degradation of isoflavones during infrared drying of soybean[J]. Food chemistry, 2012,133(3):946-952
[16] Goes -Favoni S P,Carrao -Panizzi M C, Beleia A. Changes of isoflavone in soybean cotyledons soaked in different volumes of water[J]. Food chemistry,2010,119(4):1605-1612
[17] Jankowiak L,Trifunovic O,Boom R M,et al. J. The potential of crude okara for isoflavone production[J]. Journal of food engineering, 2014, 124:166-172
[18] Lima F S, Ida E I. Optimisation of soybean hydrothermal treatment for the conversion of β-glucoside isoflavones to aglycones[J]. LWT-food science and technology,2014,56(2):232-239
[19] Fernando Sanches de Lima,Louise Emy Kurozawa,Elza Iouko Ida. The effects of soybean soaking on grain properties and isoflavones loss[J].LWT-foodscienceandtechnology,2014,59(2):1274-1282
[20] Mauricio A,Rostagno Miguel Palma,Carmelo G. Short-term stability of soy isoflavones extracts: Sample conservation aspects [J]. Food chemistry,2005,93(3):557-564
The Extraction of Soybean Isoflavone from the Soybean Used for Dry Soyfoods
GU Jian-ming,JIANG Pan
(Shanghai Key Laboratory of Bio-Energy Crops,School of Life Sciences,Shanghai University,Shanghai 200444,China)
Abstract:The effect of the pretreatment(soaking temperature,soaking time,soybean flake thickness and ultrasonic time)on soybean isoflavone leaching from the soybean used for dry soyfoods,was studied. According to higher content of soybean isoflavone and lower soluble soybean protein in the leaching liquor,opitimising pretreatment parameters(soaking for 12 h at 55℃,ultrasonic for 40 min,thickness 10 %)were obtained by orthogonal experiment L9(34),so 790.67 g of soybean isoflavone per ton was recovered.
Key words:soybean;soybean isoflavone;recovery;food
收稿日期:2015-01-06
作者简介:顾建明(1961—),男(汉),副教授,博士,研究方向:食品营养与加工。
DOI:10.3969/j.issn.1005-6521.2016.08.030
