紫罗兰酮酰胺衍生物的合成与抗肿瘤转移活性研究
2016-05-18陈家浩方海军段宏泉
陈家浩,方海军,秦 楠,2,段宏泉,2
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;2.天津医科大学基础医学研究中心,天津300070)
论著
紫罗兰酮酰胺衍生物的合成与抗肿瘤转移活性研究
陈家浩1,方海军1,秦 楠1,2,段宏泉1,2
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;2.天津医科大学基础医学研究中心,天津300070)
目的:研究紫罗兰酮酰胺衍生物的合成与抗肿瘤转移活性。方法:以α-紫罗兰酮为原料,经卤仿反应、烯丙位氧化反应和酰胺化反应得到目标化合物2a-f和4a-f,所有衍生物均评价其抗肿瘤转移活性。结果:合成得到两个系列共12个紫罗兰酮酰胺衍生物,所有化合物都经过1H NMR、13C NMR和ESI-MS表征了化学结构。与阳性对照化合物LY204002相比,化合物4f具有较强的抗肿瘤转移的活性。结论:紫罗兰酮酰胺衍生物中叔胺基团和3位羰基很可能是发挥抗肿瘤转移作用的必需基团。
紫罗兰酮;酰胺衍生物;抗肿瘤转移
乳腺癌是在女性患者中最常见的恶性肿瘤,是全世界癌症相关死亡率的第二大疾病[1-2]。肿瘤转移是乳腺癌死亡的主要诱因[3-4]。转移是一个多步骤的过程,其包括癌细胞从原发肿瘤脱离、迁移、粘附,进入血液或淋巴循环系统,外渗出循环系统,进入组织并形成转移灶[5-6]。因此,深入了解肿瘤转移的基本机制,寻求抑制肿瘤转移的新策略,发现抗肿瘤转移药物是有效预防和治疗恶性肿瘤转移的关键。近年来,随着研究人员对天然产物成分研究的不断深入,许多天然产物以及其衍生物显示了确切的抗肿瘤转移活性[7]。其中生物碱类化合物活性较强,为抗肿瘤转移药物的发现提供了苗头化合物[8]。土家族传统药物转筋草中含有大量的生物碱成分。课题组前期活性筛选发现转筋草的乙醇提取物在浓度为1 μg/mL和5 μg/mL时,对人乳腺癌细胞MDA-MB-231趋化迁移作用的抑制率分别达到了66%和95%。为此进一步开展了抗肿瘤转移化学成分研究,并分离得到活性化合物紫罗兰酮生物碱,该结构骨架为首次发现的新天然生物碱结构骨架。该化合物具有较强的抑制MDA-MB-231细胞转移活性。其半数抑制浓度IC50为1.6 μmol/L[9]。本文以α-紫罗兰酮为原料,在前期研究的基础上,设计并合成了一系列紫罗兰酮酰胺衍生物,并结合体外活性筛选,期望得到抗肿瘤转移活性更强的衍生物,为抗肿瘤转移创新药物的发现提供工具化合物。
1 材料与方法
1.1 化合物设计思路

1.2 仪器和试剂 Bruker Advance III 400MHz核磁共振仪(TMS内标);循环水式多用真空泵SHB-IIIA;Bruker Esquire 3000离子阱质谱仪;IKA®R ETS-D5加热磁力搅拌器;α-紫罗兰酮纯度为99%,购买于希尔贝思(天津)科技有限公司;柱色谱和薄层色谱用硅胶均系青岛海洋化工厂生产,所用试剂均为分析纯;氘代试剂系ALDRICH公司生产;人乳腺癌细胞系MDA-MB-231,购自中国科学院上海细胞库。
1.3 合成方法
1.3.1 合成路线 目标化合物的合成路线如图1所示。
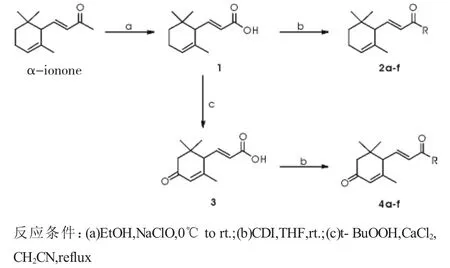
图1 目标化合物的合成路线Fig 1 Synthetic route of target compounds
1.3.2 目标化合物的结构 本文合成的目标化合物结构如表1所示。

表1 目标化合物结构Tab 1 The structure of the title compounds
1.3.3 目标产物2a-f的合成通法 称取1当量化合物1和1.2当量N,N-羰基二咪唑于反应瓶中,加入适量四氢呋喃使其溶解,室温下搅拌1 h后加入1.1当量原料胺,室温搅拌过夜。TLC监测反应完全。向反应液中加入1 N稀盐酸调节pH值为中性,二氯甲烷萃取反应液。再依次用饱和碳酸氢钠溶液、饱和食盐水溶液洗涤后,收集有机相,有机相用无水硫酸镁干燥,过滤,浓缩后得粗品。粗品经硅胶柱层析得到目标化合物。
1.3.4 目标产物4a-f的合成通法
1.3.4.1 目标产物4a-c的合成通法:称取1当量原料和0.2当量无水氯化钙于反应瓶中,加入适量乙腈和5当量过氧叔丁醇,于60℃反应数小时。TLC监测反应完全后,向反应液中加入10%硫代硫酸钠水溶液,以二氯甲烷萃取,再用饱和食盐水洗涤有机相,收集有机相,有机相用无水硫酸镁干燥,过滤,浓缩后得粗品。粗品经硅胶柱层析得到目标化合物4a-c。
1.3.4.2 目标产物4d-f的合成通法:称取1当量化合物3和1.2当量N,N-羰基二咪唑于反应瓶中,加入适量四氢呋喃使其溶解,室温下搅拌1 h后加入1.1当量原料,室温搅拌数小时。TLC监测反应完全后向反应液中加入1 N稀盐酸调节pH值为中性,二氯甲烷萃取反应液。再依次用饱和碳酸氢钠溶液、饱和食盐水溶液洗涤后,收集有机相,有机相用无水硫酸镁干燥,过滤,浓缩后得粗品。粗品经硅胶柱层析得到目标化合物4d-f。
1.4 抗乳腺癌转移活性筛选实验
1.4.1 MTT法筛选衍生物对人乳腺癌MDA-MB-231细胞的非细胞毒浓度 首先测定各化合物对人乳腺癌细胞的毒性,选择非细胞毒性的浓度进行抗肿瘤转移活性筛选(细胞毒性测定结果省略)[10]。
1.4.2 Transwell Chemotaxis方法筛选衍生物的抗肿瘤转移活性
1.4.2.1 趋化小室滤膜包被:置于10 μg/mL浓度的Fibronectin中(溶于无血清RPMI1640培养液)4℃包被过夜,室温晾干,光面朝下,左上剪角后,备用。1.4.2.2 化合物样品与细胞共培养:将MD-MBA-231细胞铺于6孔板,在37℃、5%CO2孵箱内培养24 h使其贴壁,24 h后6孔板内加入化合物样品,并在37℃、5%CO2孵箱内共孵育24 h。
1.4.2.3 趋化实验:将用化合物样品处理过的细胞分别用0.25%的胰蛋白酶消化液消化后,用含10% FBS培养液停止消化,该细胞悬液1 000 r/min离心5 min。弃去上清,加入0.1%的BM液将细胞混匀后,再次1 000 r/min离心5 min后,计数,将细胞密度调成5×105个/mL,置于孵箱内备用。配制趋化因子(EGF)溶液,加于趋化小室的下室,每孔30 μL。盖上包被好的膜,左上剪角光面向下,铺于下室。放置胶垫,固定上室。在上室加入之前准备好的细胞悬液,每孔50 μL。每个化合物样品浓度3个复孔,加好后置于 37℃、5%CO2孵箱内培养3.5 h。3.5 h后取出下室,刮去没有穿过的细胞。把膜置于培养皿中干燥,然后用三步染色试剂盒进行固定与染色。之后将膜用石蜡油固定,显微镜下计数,每孔3~5个视野,各视野细胞数求平均值,3个孔求平均值。计算公式为:抑制率=(1-化合物样品处理的细胞的趋化细胞数/正常细胞的趋化细胞数)×100%
2 结果
2.1 目标化合物的结构表征 化合物2a为无色油状物,产率为45.0%。1H NMR(400 MHz,CDCl3):δ 6.66(dd,J=15.2 Hz,9.6 Hz,1H),5.87(br s,1H),5.76 (d,J=15.2 Hz,1H),5.46 (br s,1H),2.88 (d,J=4.8 Hz,3H),2.94(d,J=9.6 Hz,1H),2.01(m,2H),1.56(d, J=1.2 Hz,3H)。1.47(m,1H),1.18(m,1H),0.90(s, 3H),0.85(s,3H)。13C NMR(100 MHz,CDCl3):δ 166.6, 145.0,132.3,124.7,122.2,53.8,32.4,31.1,27.7,26.8, 26.3,23.0,22.8。ESI-MS m/z:207.3[M+H]+。
化合物2b为无色油状物,产率为40.4%。1H NMR (400 MHz,CDCl3):δ 6.72(dd,J=15.0 Hz,9.7 Hz,1H),6.21(d,J=15.0 Hz,1H),5.47(br s,1H),3.05 (s,6H),2.29(d,J=9.7 Hz,1H),2.03(m,2H),1.58(d, J=1.6 Hz,3H),1.50 (m,1H),1.19 (m,1H),0.92(s, 3H),0.87 (s,3H)。13C NMR (100 MHz,CDCl3):δ 166.8,146.8,132.3,122.2,121.3,54.3,32.4,31.2, 27.7,26.9,23.0,22.9。ESI-MS m/z:222.1[M+H]+。
化合物2c为无色油状物,产率为41.6%。1H NMR (400 MHz,CDCl3):δ 6.65(dd,J=14.8 Hz,9.6 Hz,1H),5.71(d,J=14.8 Hz,1H),5.62(d,J=6.8 Hz, 1H),5.44(br s,1H),4.14(m,1H),2.22(d,J=9.6 Hz, 1H),2.00(d,J=1.6 Hz,1H),1.55(d,J=1.6 Hz,3H), 1.47(m,1H),1.17(d,J=6.4 Hz,6H),1.12(m,1H), 0.90(s,3H),0.84(s,3H)。13C NMR(100 MHz,CDCl3): δ 164.9,144.8,132.4,125.1,122.1,53.8,44.3,32.4, 31.1,27.8,26.8,23.0,22.9,22.8。ESI-MS m/z:236.2 [M+H]+。
化合物2d为无色油状物,产率为26.2%。1H NMR (400 MHz,CDCl3):δ 6.67(dd,J=15.0 Hz,9.6 Hz,1H),6.20(d,J=15.0 Hz,1H),5.47(br s,1H),3.56 (m,4H),2.28(d,J=9.6 Hz,1H),2.03(br s,1H),1.66 (m,2H),1.59(br s,6H),1.49(m,1H),1.19(m,1H), 0.92(s,3H),0.87(s,3H)。13C NMR(100 MHz,CDCl3): δ 165.5,146.2,132.5,122.1,121.7,54.3,32.4,31.3, 27.7,26.9,24.7,23.0,22.9。ESI-MSm/z:262.2[M+H]+。
化合物2e为无色油状物,产率为19.8%。1H NMR (400 MHz,CDCl3):δ 6.75(dd,J=15.0 Hz,9.7 Hz,1H),6.15(d,J=15.0 Hz,1H),5.48(br s,1H),3.59 (m,8H),2.28(d,J=9.7 Hz,1H),2.03(br s,2H),1.57 (d,J=1.4 Hz,3H),1.47(m,1H),1.22(m,1H),0.92(s, 3H),0.86(s,3H)。13C NMR(100 MHz,CDCl3):δ 165.6, 147.7,132.1,122.4,120.5,66.8,54.3,32.5,31.2,27.7, 26.9,23.0,22.9。ESI-MS m/z:264.1[M+H]+。
化合物2f为黄色油状物,产率为18.6%。1H NMR(400 MHz,CDCl3):δ 6.70(dd,J=15.1 Hz,9.6 Hz,1H),6.04(br s,1H),5.75(d,J=15.1 Hz,1H),5.46 (br s,1H),3.40(q,J=5.7 Hz,2H),2.45(t,J=5.9 Hz, 2H),2.25(s,7H),2.02(br s,2H),1.56(d,J=0.92 Hz, 3H),1.46(m,1H),1.17(m,1H),0.91(s,3H),0.85(s, 3H)。13C NMR (100 MHz,CDCl3):δ 165.7,145.2, 132.4,124.7,122.2,57.8,53.8,45.2,36.7,32.5,31.1, 27.7,26.9,23.0,22.9。ESI-MS m/z:265.2[M+H]+。
化合物4a为黄色油状物,产率为23.2%。1H NMR (400 MHz,CDCl3):δ 6.79(dd,J=15.2 Hz,9.4 Hz,1H),5.96(br s,1H),5.91(br s,1H),5.87(d,J= 15.2 Hz,1H),2.89(d,J=4.9 Hz,3H),2.70(d,J=9.4 Hz,1H),2.37(d,J=16.8 Hz,1H),2.10(d,J=16.8 Hz, 1H),1.89(s,3H),1.06(s,3H),1.01(s,3H)。13C NMR (100 MHz,CDCl3):δ 198.8,165.5,160.0,140.4,126.7, 126.6,54.9,47.3,36.7,28.0,27.2,26.4,23.6。ESIMS m/z:222.1[M+H]+。
化合物4b黄色油状物,产率为22.4%。1H NMR (400 MHz,CDCl3):δ 6.82(dd,J=14.8 Hz,9.6 Hz,1H), 6.36(d,J=14.8 Hz,1H),5.98(s,1H),3.10(s,3H), 3.05(s,3H),2.74(d,J=9.6 Hz,1H),2.40(d,J=16.8 Hz,1H),2.12(d,J=16.8 Hz,1H),1.92(d,J=1.2 Hz, 3H),1.08(s,3H),1.02(s,3H)。13C NMR(100 MHz, CDCl3):δ 169.8,165.7,159.8,142.0,126.7,123.5, 55.4,47.4,36.7,28.0,27.2,23.6。ESI-MS m/z:236.1 [M+H]+。
化合物4c为无色油状物,产率为21.7%。1H NMR (400 MHz,CDCl3):δ 6.80 (dd,J=15.2 Hz,9.2 Hz,1H),5.97 (s,1H),5.81 (d,J=15.2 Hz,1H),5.46 (d,J=6.4 Hz,1H),4.15(m,1H),2.70(d,J=9.2 Hz, 1H),2.38 (d,J=16.8 Hz,1H),2.10 (d,J=16.8 Hz, 1H),1.91(d,J=0.8 Hz,3H),1.21(d,J=5.6 Hz,6H), 1.08(s,3H),1.03(s,3H)。13C NMR(100 MHz,CDCl3): δ 198.8,163.8,160.0,140.4,127.0,126.7,54.9,47.3, 41.6,36.8,28.0,27.2,23.7,22.8。ESI-MS m/z:250.2 [M+H]+。
化合物4d为无色油状物,产率为37.9%。1HNMR (400 MHz,CDCl3):δ 6.74(dd,J=14.9 Hz,9.5 Hz,1H),6.34(d,J=15.0 Hz,1H),5.93(br s,1H),3.58 (br s,2H),3.45 (br s,2H),2.70 (d,J=9.5 Hz,1H), 2.35 (d,J=16.8 Hz,1H),2.08 (d,J=16.7 Hz,1H), 1.88(s,3H),1.57(br s,6H),1.04(s,3H),0.98(s,3H)。13C NMR (100 MHz,CDCl3):δ 198.7,164.4,159.9, 141.5,126.6,123.9,55.4,47.4,36.6,27.9,27.1,25.5, 24.5,23.6。ESI-MS m/z:276.3[M+H]+。
化合物4e为无色油状物,产率为37.9%。1H NMR (400 MHz,CDCl3):δ 6.86(dd,J=15.0 Hz,9.4 Hz,1H),6.31(d,J=15.0 Hz,1H),5.98(br s,1H),3.71 (br s,6H),3.55 (br s,2H),2.74 (d,J=9.4 Hz,1H), 2.38 (d,J=16.8 Hz,1H),2.12 (d,J=16.7 Hz,1H), 1.91(s,3H),1.08(s,3H),1.02(s,3H)。13C NMR(100 MHz,CDCl3):δ 198.6,164.5,159.5,143.1,126.8, 122.6,55.4,47.4,36.7,28.0,27.2,23.6,19.2。ESIMS m/z:278.3[M+H]+。
化合物4f为无色油状物,产率为52.4%。1H NMR (400 MHz,CDCl3):δ 6.81(dd,J=15.1 Hz,9.3 Hz,1H),6.19(br s,1H),5.97(s,1H),5.88(d,J=15.1 Hz,1H),3.42 (q,J=5.6 Hz,1H),2.70 (d,J=9.3 Hz, 1H),2.47(t,J=5.8 Hz,1H),2.38(d,J=16.7 Hz,1H), 2.26(s,6H),2.10 (d,J=16.7 Hz,1H),1.90 (s,3H), 1.07(s,3H),1.02(s,3H)。13C NMR(100 MHz,CDCl3): δ 189.7,164.7,159.8,140.5,126.8,126.7,57.6,54.9, 47.3,45.1,36.8,36.7,28.0,27.2,23.6。ESI-MS m/z: 279.1[M+H]+。
2.2 目标化合物的抗肿瘤转移活性评价 各衍生物对EGF诱导的MD-MBA-231乳腺癌细胞趋化转移运动的抑制作用如表2所示。

表2 衍生物对EGF诱导的MDA-MB-231乳腺癌细胞趋化运动抑制作用Tab 2 Inhibiting effects of derivatives on the EGF-induced migration of MDA-MB-231 cells
3 讨论
在抗肿瘤转移活性筛选中,笔者选择了文献和本课题组研究报告[9,11-12]所用的阳性对照化合物LY294002为PI3K抑制剂[13],对本文合成的紫罗兰酮酰胺衍生物筛选结果表明,相比于阳性对照LY294002,化合物4f的抗乳腺癌转移活性较强,这可能和化合物4f含有碱性叔胺基团有关,叔胺基团的碱性强于酰胺基团,能与含有酸性氨基酸残基的蛋白结构域相互作用。同时,化合物4f与2f相比在紫罗兰酮母核3位多了羰基,羰基可以作为氢键受体与蛋白质中的氢键供体基团,如羟基、氨基等基团发生氢键作用。综上所述,先导化合物中叔胺基团和3位羰基很可能是发挥抗肿瘤转移作用的必需基团。这为该类活性天然产物的深入研究提供了重要实验依据。
[1] AL-Hajj M,Wicha M S,Benito-Hernandez A,et al.Prospective identificationoftumorigenicbreastcancercells[J].ProcNatlAcadSci, 2003,100(7):3983
[2] Davis N M,Sokolosky M,Stadelman K,et al.Deregulation of the EGFR/PI3 K/PTEN/Akt/mTORC1 pathwayinbreastcancer: possibilities for therapeutic intervention[J].Oncotarget,2014,5(13): 4603
[3] Lu J,Steeg P S,Price J E,et al.Breast cancer metastasis:challenges and opportunities[J].Cancer Res,2009,69(12):4951
[4] ChiangAC,MassaguJ.Molecular basis of metastasis[J].NEnglJMed, 2008,359(26):2814
[5] Culhane A C,Quackenbush J.Confounding effects in“A six-gene signature predicting breast cancer lung metastasis”[J].Cancer Res, 2009,69(18):7480
[6] Ming A J,Kang Y,Serganova I,et al.Distinct organ-specific metastatic potential of individual breast cancer cells and primary tumors[J].J Clin Invest,2005,115(1):44
[7]姜永莉,刘兆鹏.天然多酚衍生物抗肿瘤侵袭与转移研究进展[J].中国药物化学杂志,2011,21(1):60
[8]严淑,刘宝瑞.七种天然生物碱抗肿瘤作用研究进展[J].现代肿瘤医学,2010,18(6):1227
[9] Jin M N,Ma S N,Zhai H Y,et al.A New megastigmane alkaloid from pachysandra terminalis with antitumor metastasis effect[J].Chem Nat Compd,2015,51(2):311
[10]Wu J,Zhang B,Wu M,et al.Screening of a PKC zeta-specific kinase inhibitor PKCzI257.3 which inhibits EGF-induced breast cancer cell chemotaxis[J].Invest New Drugs,2010,28(3):268
[11]Zhai H Y,Zhao C,Zhang N,et al.Alkaloids from Pachysandra terminalis inhibit breast cancer invasion and have potential for developmentasantimetastasistherapeuticagents[J].JNatProd,2012, 75(7):1305
[12]Wang H L,Qin N,Liu J,et al.Synthesis and antimetastatic effects of E-salignone amide derivatives[J].Drug Dev Res,2014,75(2):76
[13]Yanamandra M,Mitra S,Giri A.Development and application of PI3Kassaysfornoveldrugdiscovery[J].ExpertOpinDrugDiscov,2015, 10(2):171
(2015-11-05收稿)
Study on the ionone amide derivatives synthesis and anti-tumor metastatic effect
CHEN Jia-hao1,FANG Hai-jun1,QIN Nan1,2,DUAN Hong-quan1,2
(1.School of Pharmacy,Tianjin Medical University,Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics(Theranostics),Tianjin 300070,China;2.Research Center of Basic Medical Sciences,Tianjin Medical University,Tianjin 300070,China)
Objective:To study the ionone amide derivatives synthesis and anti-metastatic activities.Methods:Target compounds 2a-f and 4a-f were prepared by haloform reaction,allylic oxidation,amidation reaction from α-ionone as starting material.Results:Twelve ionone amide derivatives were synthesized by organic chemistry reactions.All of the compounds were identified by1H-NMR,13C-NMR and ESI-MS.Compared to the positive control compound LY294002,these results showed that compound 4f had significant anti-metastasis effect.Conclusion:The tertiary amine group and carbonyl group at C-3 position of ionone amide derivatives may be the essential in the anti-tumor metastasis.
ionone;amide derivative;anti-metastasis
R9
A
1006-8147(2016)03-0191-04
国家自然科学基金面上项目基金资助(81373297)
陈家浩(1989-),男,硕士在读,研究方向:天然产物结构改造;通信作者:段宏泉,E-mail:duanhq@tijmu.edu.cn。
