微生物燃料电池在污水生物脱氮中的研究进展
2016-05-17赵慧敏李晓玲赵剑强长安大学环境科学与工程学院陕西西安70054菏泽学院化学化工系山东菏泽7405
赵慧敏,李晓玲,赵剑强(长安大学环境科学与工程学院,陕西 西安 70054;菏泽学院化学化工系,山东 菏泽 7405)
微生物燃料电池在污水生物脱氮中的研究进展
赵慧敏1,2,李晓玲1,赵剑强1
(1长安大学环境科学与工程学院,陕西 西安 710054;2菏泽学院化学化工系,山东 菏泽 274015)
摘要:微生物燃料电池(MFC)是一种新型污水处理技术,其在处理污水的同时能产生电能,引起众多研究者的关注。将MFC应用于含氮污水的处理中便形成了反硝化或同步硝化反硝化MFC系统。本文回顾了MFC生物脱氮的发展历程,并从MFC实验装置的设计构造(空间构型、电极材料、分隔材料)、影响因素(含氮污染物浓度、水力停留时间、溶解氧、碳源与碳氮比、温度、pH值、外电阻)和反硝化细菌的基因表达与多样性等3个方面进行了综述与分析,提出需要从以下方面进行MFC生物脱氮效能的强化:开发具有强电子传输能力和氨氧化催化功能的廉价高效电极材料,优化MFC脱氮的运行条件和探索不同环境下的脱氮机理,通过研究MFC阴极微生物种群构成筛选培育优势反硝化功能菌。
关键词:微生物燃料电池;污水处理;生物脱氮;反硝化;催化;厌氧
第一作者及联系人:赵慧敏(1978—),女,博士研究生,讲师,主要从事水污染控制工程研究。E-mail zhmthreesister@163.com。联系人:赵剑强,教授,博士生导师,从事水污染控制工程研究。
微生物燃料电池(microbial fuel cell,MFC) 能够将产电和去除污染物同时进行,被认为是一种清洁的、绿色的、可持续发展的新型技术。MFC技术利用微生物作催化剂将化学能转化为电能,相对于高能耗、高成本的传统污水处理方式具有较大的经济潜力[1]。目前,国内外研究主要集中在MFC的构型操作、生物菌群、电化学特性等方面。已有MFC投入到生产应用上的实例,如远程监测器、对水体进行毒性检测、筛选菌株或者通过电化学过程回收如氨、金属离子等有用物质[2]。但是,MFC的能量回收较低以及昂贵的质子膜和电极材料等,已成为它扩大化运行的发展障碍。
近年来,将MFC技术与传统生物脱氮工艺相结合引起了更多人的关注。对MFC处理污水方面的研究大都集中在阳极降解各种有机物,如高浓度垃圾渗滤液、石油化工废水等;而对于在阴极降解含氮污染物如处理含硝酸盐、硝基苯和偶氮染料等方面的研究还不是很深入[3]。相对于传统的污水脱氮方法,MFC具有的优势就是降低了对碳源的需求[4],为处理低碳氮比污水提供了一条途径。因此,基于对MFC在污水脱氮方面存在的潜在优势,如催化生物氨氧化过程、未知的生物电化学脱氮机理、培养异养硝化菌、不同外环境下优势菌种的培养与鉴别等,本文从MFC的构型设计、操作运行条件和反硝化菌群等方面进行了综述,提出了今后研究的方向,以期对MFC技术的发展提供一定的参考。
1 MFC生物脱氮的基本原理
MFC是在厌氧或微氧条件下通过反硝化细菌完成氮去除。PARK等[5]首先检测到在生物膜电极上硝酸盐由微生物作用下接收从阴极电极产生的电子被还原为氮气。HOLMES等[6]发现沉积在MFC阴极中的微生物参与了氨氧化和反硝化等反应,证明了阴极氮循环的存在。接着PUIG等[7]通过构建双室MFC证实了从MFC中富集的微生物可以在无碳源的条件下直接将NO3−还原为NO2−。随后程建萍等[8]以硝酸盐溶液为阴极电子受体在阴极室接种纯反硝化单菌株构成生物阴极MFC,平均反硝化速率为2.19mg/(L·d),并证明了MFC阴极溶液中确实存在进行微生物与电极间传递电子的氧化还原介体质。
MFC处理含氮污水的脱氮反应目前仍然是基于传统的生物脱氮原理,即阳极室微生物催化氧化有机物产生电子和质子,电子被阳极捕集并通过外电路转移到阴极,质子通过离子交换膜从阳极室迁移到阴极室,在阴极室中利用微生物作为催化剂使阴极室硝酸盐接受目的。阳极和阴极反应式如式(1)~式(5)[9]。

式中,E0为标准条件下相对于标准氢电极(SHE)的氧化还原电位。
从上述反应式可以看出:反硝化利用阴极电极作为电子受体,可将硝酸盐经历四步还原成氮气,生成1mol氮需要5mol 电子。在MFC反硝化进行生物脱氮的反应过程中,氮的去除不再像传统生物脱氮工艺那样受到碳源的限制,理论上解决了传统硝化反硝化工艺中存在的有机物对硝化过程的制约和反硝化对碳源的需求问题,这一点被认为是生物阴极MFC在脱氮方面的优势所在。但是,基于这一优势的MFC阴极反硝化微生物的培养需要的时间很长,相关报道有180天和240天的连续培养需求[10-11]。已有研究表明以α-变形菌纲脱氮副球菌YF1(Parococcus sp.)构建的纯种生物阴极MFC可将硝态氮直接还原为N2[12]。另有研究表明双室MFC反亚硝化阴极在严格控制氧气进入的情况下存在着亚硝态氮被快速氧化为硝态氮的现象[13]。综合以上可见,MFC的脱氮过程也可能存在有别于传统硝化反硝化机理的未知的一些化学反应,有待进一步的研究。
2 构型设计对MFC生物脱氮的影响
MFC设计构造的差异影响着电子、质子的迁移速率,从而影响着反应器的脱氮效率。研究人员结合MFC和传统生物脱氮反应器的构造,已研发出多种MFC脱氮工艺,均实现了脱氮产电的双重功效。
2.1空间构型
MFC基本结构分为单室、双室和多室型。单室MFC利用空气阴极生物膜进行硝化,氮去除率的提高是通过增大空气阴极的面积来增大空气渗透率[14]。据报道,当以硝酸盐作电子受体构建单室MFC,NO3−-N去除率可达30.35mg/(m3·d)[15]。而单室MFC中有4mg/L的硝酸盐时对其功率密度和库仑效率产生了负面的影响[16-17],这是由于单室MFC中生物反硝化过程与电子的传递过程存在竞争关系,即单室型MFC由于硝酸盐竞争电子供体会导致其输出功率较低。
双室MFC由厌氧的阴极室和阳极室组成,硝酸盐在阴极接受由阳极传递的电子进行电极反硝化去除。CLAUWAERT等[11]采用除碳和反硝化单元分开的双室MFC,每天可去除约0.146kg/m3硝酸盐。VIRDIS等[10]设计了一种环形双室MFC进行同时硝化-电极反硝化,每天约2kg/m3COD和0.41kg/m3硝酸盐得到去除。
为了进一步提高MFC生物脱氮效果。XIE等[18]通过好氧生物阴极MFC和厌氧生物阴极MFC耦合系统,污水中NH4+-N和总N去除率分别达到97.4% 和97.3%。ZHANG等[19]把XIE等构建的系统简化为双阴极MFC,在阳极两侧各加一个好氧和厌氧阴极室,结果发现这个复合多室系统的总N去除率开始下降,只处理了污水中76%的氮。LEE等[20]构建双阴极MFC分别处理氨氮和硝态氮,两氮的去除率分别达97.9%和 89.9%。以上研究说明工艺复杂的多室型MFC系统运行不太稳定,虽然脱氮效果较好,但所需的经济成本却较双室型MFC增加。因此,选择双室型MFC可能仍是实现污水处理和能源回收的较好模式,但单室MFC可能更有助于MFC脱氮技术的工程应用。
2.2电极材料
电极作为电子传递导体是影响MFC性能的关键因素,目前在研究中多采用多孔碳基材料以及纳米碳材料[21],其具有优良的导电性、不易腐蚀、高比表面积和高孔隙率、适合微生物生长、成本低等特性。但碳材料脆性较大,易增加电极的欧姆损失形成较高电阻率,导致直接使用效果不佳。为获取最大输出功率,提高MFC除污产电性能,人们对电极材料做了很多改性和优化的研究,使用催化剂能降低活化能和增强反应速率[22],有效提高MFC阴极性能及脱氮效果。FANG等[23]以硝酸盐作为阴极电子受体,发现使用负载铂(Pt)催化剂的碳阴极能明显提高脱氮速率和输出功率密度。当铂金作为电极材料时易形成PtO层,这可干扰反硝化过程,铂昂贵的价格也限制了其在实际生产中的应用。白立俊等[24]开始采用热处理法制备M-N-C(M=Fe,Co)材料作为MFC阴极催化剂,结果表明比用Pt/C作催化剂MFC的功率密度又提高了10%。
为了更有效地降低经济成本,谢倍珍等[25]以涂布聚四氟乙烯的廉价碳纸构建生物阴极MFC,在1 h内NO3–-N去除率就达到80%,且产电更稳定。但在MFC反应过程中加入催化剂或中间体易使阴极室发生重金属中毒现象,造成环境的二次污染。由于中性红能够在电极表面形成一层性能稳定并对生物分子有较强的电催化作用复合膜,采用中性红修饰的碳毡电极的电化学反应可能对氨氧化过程具有催化作用[26]。试验研究具有强电子传输能力及氨氧化或硝酸盐还原催化功能的廉价高效电极材料仍然是今后的研发方向。
2.3分隔材料
分隔材料需要具有较高的质子传导率,包括质子交换膜、盐桥、玻璃珠、玻璃纤维等。盐桥、玻璃珠、玻璃纤维等分隔方式因大幅度提高电池内阻,降低了MFC产电特性,已逐渐被弃用。质子交换膜产生的内阻较小[27],在MFC中应用广泛。有实验证明质子交换膜厚度越薄,对质子的传递效果越好,MFC脱氮产电的效率越高[28]。现实验室多用美国杜邦公司Nafion质子交换膜,其价格昂贵,不利于MFC技术的大规模应用。
也有人选择一些价廉的离子交换膜[29],但这种膜在液体中易变形或者弯曲,从而造成阻力,使质子从阳极室到阴极室传输速率减缓,这将降低系统的稳定性和电化学性能,在大尺度的MFC装置中易导致系统发生较大的变化。最近开发出了一种陶瓷型阳离子交换膜[30],价格较为低廉,且具有高效离子选择性、高机械强度和持久耐用性,有望未来应用到实际生产中。
3 操作运行条件对MFC生物脱氮的影响
MFC生物脱氮的效果除了受到设计构造等自身因素影响外,还会受到诸如含氮污染物浓度与水力停留时间(HRT)、溶解氧(DO)、碳源与碳氮比(C/N)、温度、外电阻和pH值等各因素的影响。在处理含氮污水时需根据污水性质来优化运行参数,使MFC脱氮产电的性能最佳。
3.1含氮污染物浓度与水力停留时间
在MFC中能量的产生和底物浓度有直接关系,但底物浓度过高时,产电能力便会下将。适当提高含氮污染物的浓度可增强微生物活性,强化MFC的脱氮能力。当污水中含氮污染物在20~120mg/L从低浓度逐步升高时,MFC反硝化脱氮效率随之相应升高[31-32]。有研究表明,含氮污染物如NO3−-N浓度在99.2mg/L时最适宜MFC反硝化细菌的生长[33]。当含氮污染物浓度超过2000mg/L时会抑制MFC的反硝化速率和产电性能,降低了MFC的脱氮能力;MFC反硝化在NO3−-N高于4000mg/L时被完全抑制[34]。
适当延长HRT有利于提高硝酸盐的降解率[35],但随着HRT的延长,污水中NH4+-N去除率会呈现先升高后降低的趋势[36],即HRT过长会使反应器处理能力过剩,消耗更多能量,增加运行成本。有研究表明HRT为12h时,MFC处理污水效果较好,硝酸盐去除率达90%以上[37]。
3.2溶解氧
溶解氧(DO)控制着MFC脱氮和产电之间的电子分配。在较小电流密度区域内,氧是阴极主要电子受体,而当电流密度增加到一定程度后,硝酸盐逐步变为阴极的主要电子受体。说明两者之间存在着一定的竞争关系[38]。
一般认为当DO浓度低于1mg/L时,厌氧反硝化菌才具有反硝化活性。YU等[39]对MFC脱氮工艺研究发现阴极室DO浓度为2mg/L时氮去除率低于20%;DO浓度为0.5mg/L时氮去除率上升到52%。而当DO浓度高达7.8mg/L时,MFC的NO3−-N去除率仅为7.8%[40]。说明高DO浓度会抑制阴极反硝化反应的进行,导致硝酸盐的积累。维持较低的DO浓度有助于MFC提高污水处理脱氮的潜力。
3.3碳源与碳氮比
MFC的一个突出优势就是能够在污水脱氮过程中减少对有机碳源的依赖。具有脱氮功能的MFC阴极室多为自养反硝化菌,所需电子可从阴极电极直接得到,不需要额外添加更多的有机碳源。POUS 等[41]在MFC处理无有机碳源地下水时,硝酸盐去除负荷达到4.09mg/(L·h)。
碳氮比(C/N)通过控制电子的供应影响MFC的反硝化率。当C/N为2时MFC脱氮效果最佳,C/N升高到3时反硝化速率开始下降[42]。有研究发现C/N低至1.88 时,氮的去除率也能够达到76.8%[43]。说明只要满足阴极反应底物所需反硝化的电子数,尽可能低的C/N可能更有利于反硝化反应的进行。本文作者课题组初步研究发现阴极亚硝化反硝化MFC可以实现好氧反硝化菌的富集,好氧反硝化在DO为3mg/L、外阻为50Ω 时可以达到15mg/(L·d)的亚硝酸盐氮去除,为研究好氧反硝化菌提供了一个新的途径。
3.4温度
温度可以对MFC产生直接影响。当反应温度从32℃降到20℃时,MFC输出功率降低了9%[44]。而温度升高时,增强了MFC电子、质子的传递能力,提高了传递效率。有研究[45]发现MFC在35℃时得到最大总氮去除负荷(47±3)g/(m3·d)。
反硝化细菌的最适生长温度在30℃左右[46],温度过高又会影响微生物菌群数量的增长,并不利于MFC脱氮产电性能的提高。另外,车轩等[47]对脱氮硫杆菌Thiobacillus denitrificans研究发现该菌株最适反硝化温度为32.8℃,高于其自身生长最适温度29.5℃。这说明可能对某一种反硝化细菌来说,其最适生长温度与最适反硝化温度不一致。不同的温度区间存在适宜该温度区间的不同菌群,相关的研究还远不足于揭示客观存在。
3.5pH值
pH值是影响MFC产电性能的一个重要参数,直接影响微生物的新陈代谢活性,从而影响电子和质子产生机制。在MFC运行过程中阳极室(酸化)和阴极室(碱化)间会产生一定的pH值梯度,而中性条件下硝酸盐降解效率更高[48]。通常添加碳酸或磷酸缓冲溶液维持阴极室pH值稳定,CLAUWAERT等[11]通过连续中和阴极室pH值明显提高了反硝化速率,维持pH值为7.2时,脱氮速率由先前的0.18kg/(m3·d)升到最高值0.5kg/(m·d)。贾璐维等[49]发现曝气阴极氧气得电子获得较高pH值有利于亚硝化反应器的启动,从而实现MFC阴极同步短程硝化反硝化。另外,MFC硝化过程中释放出的质子也可以起到对pH值的缓冲作用[18]。
3.6外电阻
外电阻主要影响MFC的电子传递和阳极电位。加大外电阻能够改变电子传递的分配比,使大部分的电子消耗在外电路的输送过程中,含氮污染物去除率明显降低[50]。而降低外电阻有利于增强电流密度和提高MFC阴极脱氮效果。ZHANG等[19]将双室MFC的外电阻由712Ω减小到10Ω,总氮去除率由51.9% 升高到68.0%。当外电阻从50Ω降到5Ω时MFC系统中硝酸盐去除速率由0.26mg/(L·h)上升到0.76mg/(L·h)[32],表明较低的外电阻更易使电子供体被氧化,更多的电子传递到阴极,MFC得到了较高的反硝化速率。
以上影响因素中,含氮污染物浓度、水力停留时间、碳源与碳氮比(C/N)等与MFC所处理的含氮污水性质密切相关。在MFC处理污水时,需要针对所需处理污水的不同性质来选择合适的系统运行参数。而溶解氧浓度、温度、pH值与外电阻等环境条件可根据MFC处理污水时实际情况进行动态调整,来维持MFC系统的正常运行。如MFC反应底物为硝态氮或亚硝态氮时,应严格控制阴极室为厌氧或者缺氧状态,确保反硝化反应进行。
4 MFC生物脱氮的反硝化细菌
生物阴极是实现MFC脱氮的主要场合。阴极上的硝化、反硝化微生物具有多样性,既有自养硝化菌、异养硝化菌、异养反硝化菌、好氧反硝化菌,也有食物链上的其他菌群。反硝化细菌还原硝酸盐的过程主要是酶催化反应。参与反硝化反应催化酶由几种特定基因来编码,这些编码反硝化过程相关酶的功能基因通常被用作研究反硝化细菌的靶序列(见表1),其中反硝化功能团中nirS在阴极的生物膜上直接影响到N2O的排放[56]。但对于MFC反硝化生物脱氮工艺来说,单一反硝化细菌不能产生反硝化过程所需的所有酶,有可能需要组合成反硝化菌群共同作用来完成整个反应过程。
与传统反硝化需要异养反硝化菌不同,实现MFC阴极反硝化既有自养反硝化菌也有异养反硝化菌,其从阴极电极接收电子被还原。如PUIG 等[7]就在自养反硝化菌群中发现Oligotropha carboxidovoran占主体,该菌种属γ-变形菌纲亚硝化单孢菌属。而王清萍等[12]以α-变形菌纲脱氮副球菌YF1(Parococcus sp.)(异养菌)构建纯种生物阴极MFC进行脱氮研究,结果表明YF1可将硝酸根直接还原为N2,脱氮率高达100%。GREGORY 等[57]最早证实了MFC中纯菌种地杆菌Geobacter可通过阴极电极接收电子将硝酸盐还原成亚硝酸盐,其他学者从混合培养菌群Geobacter metallireducens也得到了相似的结果[21,58]。有多项研究证实,MFC中反硝化细菌一般属于变形菌门Proteobacteria[59-61]。对MFC中微生物进行监测,发现变形菌门亚硝酸细菌Nitrosomonas能够氧化铵离子到亚硝态氮进而还原亚硝态氮为NO[62]。对长期运行的MFC中的菌群进行富集培养,发现反硝化菌群由最初的β-变形菌纲Betaproteobacteria逐渐驯化演变为γ-变形菌纲Gammaproteobacteria[63]。
阴极反硝化MFC的微生物群落构成具有很大程度的生物多样性,这些种群之间有可能呈互营共生关系,使得分离鉴定的难度增大。混合菌群可能使MFC获得更高的产电效率,但由于混合菌群培养的不确定性易导致MFC系统运行不稳定。富集培养分析鉴别混合菌群中不同菌种的脱氮产电能力,筛选MFC优势反硝化细菌,寻找能够有效处理含氮污水的功能菌群组合,具有广阔的研究前景。
5 结语
近几年,在实验室中关于MFC脱氮产电的研究取得了一定的成功,然而经济成本高、输出功率低、脱氮效率差和系统运行不稳定等因素限制了MFC技术的发展。因此,今后需要对MFC设计构造、电极材料、影响因素及功能菌群等进行更深入系统地研究,以推动MFC技术的不断进步。建议从以下几个方面开展深入研究。
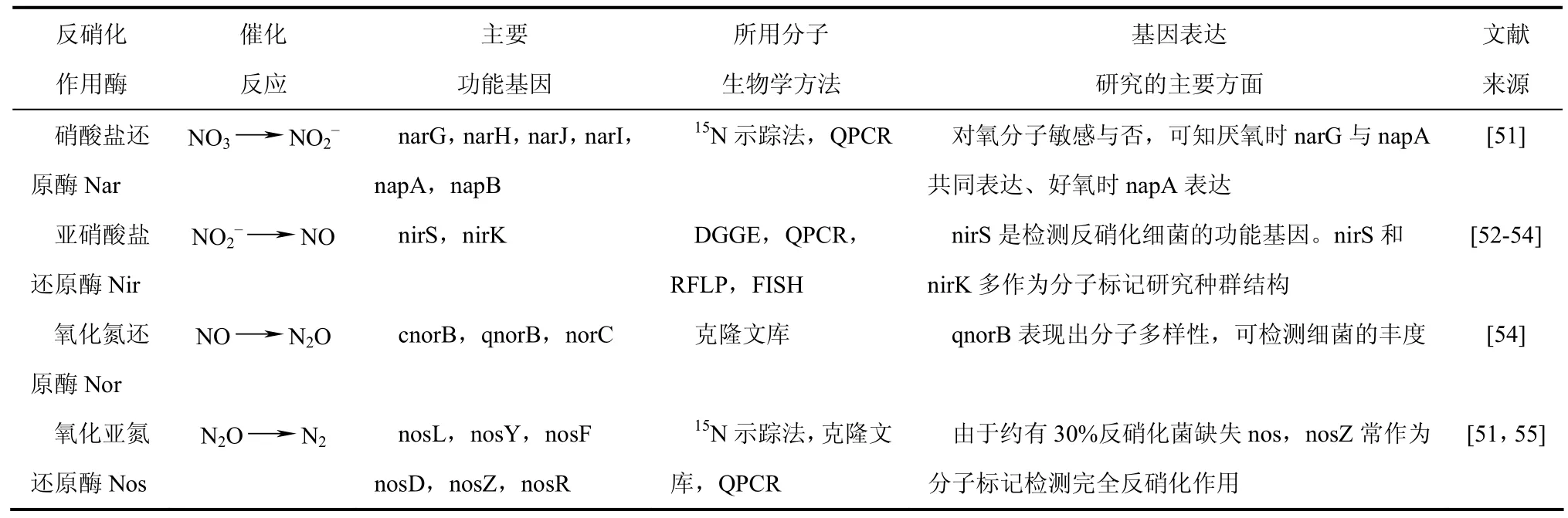
表1 反硝化细菌的功能基因表达
(1)探索具有强电子传输能力和氨氧化催化功能的廉价高效电极材料,如纳米碳材料和过渡金属的络合物、中性红修饰石墨碳毡为生物载体的阴极电极材料,为诸如人工湿地等需要提高污水脱氮性能的工艺提供强化生物脱氮效率新途径。
(2)重视影响MFC生物脱氮的各种环境因素,如溶解氧浓度、pH值、温度及碳氮比等,探讨不同环境条件下MFC的脱氮效果、适用条件及脱氮机理。
(3)结合MFC试验研究温室气体N2O的产生和释放特性,探讨N2O的产生机理及减少N2O排放的控制措施。
(4)深入研究MFC阴极硝化反硝化微生物的种群构成、代谢过程和生物电化学反应,分离筛选一批可富集培养、脱氮产电效率高、适应性强的优势功能菌。
参考文献
[1]LOGANBE,HAMELERSB,ROZENDALR,et al.Microbial fuel cells methodology and technology [J]. Environmental Science Technology,2006,40(17):5181-5192.
[2]LIU H,RAMNARAYANAN R,LOGAN B E. Production of electricity during wastewater treatment using a single chamber microbial fuel cell[J].Environmental Science & Technology,2004,38(7):2281-2285.
[3]LIU X W,LI W W,YU H Q.Cathodic catalysts in bioelectrochemical systems for energy recovery from wastewater[J].Chemical Society Reviews,2014,43(22) :7718-7745.
[4]ZHANG F,HE Z.Integrated organic and nitrogen removal with electricity generation in a tubular dual-cathode microbial fuel cell[J].Process Biochemistry,2012,47(22):2146-2151.
[5]PARK D H,LAIVENIEKS M,GUETTLER M V,et al.Microbial utilization of electrically reduced neutral red as the sole electron donor for growth and metabolite production[J].Applied and Environmental Microbiology,1999,65 (7):2912-2917.
[6]HOLMES D E,BOND D R,O’NEIL R A,et al.Microbial communities associated with electrodes harvesting electricity from a variety of aquatic sediments[J].Microbial Ecology,2004,48(2):178-190.
[7]PUIG S,COMA M,DESLOOVER J,et al.Autotrophic denitrification in microbial fuel cells treating low ionic strength waters[J].Environmental Science & Technology,2012,46(4):2309-2315.
[8]程建萍,孙秋阳,胡淑恒,等.两类阴极菌群微生物料电池降解硝酸盐研究[J].合肥工业大学学报(自然科学版)2014,37(10):1168-1172.
[9]THAUER R K,JUNGERMANN K,DECKER K.Energy conservation in chemotrophic anaerobic bacteria[J].Bacteriological Reviews,1977,41(1):100-180.
[10]VIRDIS B,READ S T,RABAEY K,et al.Biofilm stratification during simultaneous nitrification and denitrification(SND)at a biocathode[J].Bioresource Technology,2011,102(1):334-341.
[11]CLAUWAERT P,RABAEY K,AELTERMAN P,et al.Biological denitrification in microbial fuel cells[J].Environmental Science & Technology,2007,41(9),3354-3360.
[12]王清萍,刘培文,翁秀兰,等.脱氮副球菌YF1微生物燃料电池生物阴极脱氮和产电[J].环境工程学报,2014,8(8):3277-3282.
[13]PUIG S,SERRAA M,VILAR-SANZ A,et al.Autotrophic nitrite removal in the cathode of microbial fuel cells[J].Bioresource Technology,2011,102(6):4462-4467.
[14]YAN H J,REGAN J M.Enhanced nitrogen removal in singlechamber microbial fuel cells with increased gas diffusion areas[J].Biotechnology & Bioengineering,2013,110(3):785-791.
[15]章轶磊,崔康平,孙世群,等.单室不锈钢阳极微生物燃料电池强化反硝化的研究[J].广东化工,2012,39(2):4-7.
[16]汪家权,夏雪兰,陈少华,等.两类微生物燃料电池治理硝酸盐废水的实验研究[J].环境科学学报,2011,31(2):254-259.
[17]SUKKASEM C,XU S T,PARK S,et al.Effect of nitrate on the performance of single chamber air cathode microbial fuel cells[J].Water Research,2008,42(19):4743-4750.
[18]XIE S,OUYANG K,LI L,et al.Researches of membranes as the separators for microbial fuel cells[J].Technology of Water Treatment,2011,37(8):15-18.
[19]ZHANG F,HE Z.Simultaneous nitrification and denitrification with electricity generation in dual-cathode microbial fuel cells [J].Chemistry Technology Biotechnology,2012,87(1):153-159.
[20]LEE K Y,RYU W S,CHO S I,et al.Comparative study on power generation of dual-cathode microbial fuel cell according to polarization methods[J].Water Research,2015,84:43-48.
[21]印霞棐,刘维平.电极对微生物燃料电池同时处理有机废水和含铜重金属废水产电性能的影响[J].化工进展,2015,34(4):1152-1158.
[22]CHENG S A,LIU H,LOGAN B E.Power densities using different cathode catalysts(Pt and CoTMPP)and polymer binders (Nafione and PTFE)in single chamber microbial fuel cells[J].Environmental Science & Technology,2006,40(1):364-369.
[23]FANG C,MIN B,ANGELIDAKI I.Nitrate as anoxidant in the cathode chamber of a microbial fuel cell forboth power generation and nutrient removal purposes[J].Applied Biochemistry Biotechnology,2011,164(4):464-474.
[24]白立俊,王许云,何海波,等.M-N-C阴极催化剂的制备及其在微生物燃料电池中的应用[J].化工学报,2014,65(4):1267-1272.
[25]谢倍珍,刘博杰,杨少强,等.生物阴极式碳纸隔膜微生物燃料池的反硝化和产电性能[J].环境工程学报,2014,8(6):2163-2168.
[26]JEON B Y,SEO H N,KANG S W,et al.Effect of electrochemical redox reaction on biochemical ammonium oxidation and chemical nitrite oxidation[J].Journal of Microbiology & Biotechnology,2010,20(3):485-493.
[27]ZUO Y,CHENG S A,LOGAN B E.Ion exchange membrane cathodes for scalable microbial fuel cells[J].Environmental Science & Technology,2008,42(18):6967-6972.
[28]WATSON V J,SAITO T,HICKNER M A,et al.Polymercoatings as separator layers for microbial fuel cellcathodes[J].Power Sources,2011,196(6):3009-3014.
[29]LI Z Q,ZHANG Y,LEDUC P R,et al.Microbial electricity generation via microfluidic flow control[J].Biotechnology & Bioengineering,2011,108(9):2061-2069.
[30]SANTORO C,ARTYUSHKOVA K,GAJDA I,et al.Cathode materials for ceramic based microbial fuel cells (MFCs)[J].International Journal of Hydrogen Energy,2015,40(42):14706-14715.
[31]梁鹏,张玲,黄霞,等.双筒型微生物燃料电池生物阴极反硝化研究[J].环境科学,2010,31(8):1932-1936.
[32]张立成,于洋,程亚楠,等.硝酸盐质量浓度对微生物燃料电池产电及反硝化的影响[J].沈阳建筑大学学报(自然科学版),2013,29(6):1128-1132.
[33]黄丽巧,易筱箔,韦朝海,等.阴极硝化耦合阳极反硝化实现微生物燃料电池技术脱氮[J].环境工程学报,2015,9(10):5118-5124.
[34]张吉强,郑平,何崭飞,等.废水中硝氮和COD浓度对AD-MFC脱氮产电性能的影响[J].环境工程学报,2014,8(10):4508-4514.
[35]华迪,崔康平,赵莉丽.微生物燃料电池原位修复地下水硝酸盐污染[J].广东化工,2014,41(1):93-94.
[36]杨广伟,姜裙秋,王馄,等.生物产电人工湿地系统对处理生活污水的效能[J].浙江大学学报(工学版),2015,49(6):1186-1192.
[37]MOON H S,SHIN D Y,NAM K,et al.A long-term performance test on an autotrophic denitrification column for application as a permeable reactive barrier[J].Chemosphere,2008,73(5):723-728.
[38]李金涛,张少辉.反硝化微生物燃料电池的基础研究[J].中国环境科学,2012,32(4):617-622.
[39]YU C P,LIANG Z H,DAS A,et al.Nitrogen removal from wastewater using membrane aerated microbial fuel cell techniques[J].Water Research,2011,45(3):1157-1164.
[40]ZHANG Y F,ANGELIDAKI I.Bioelectrode-based approach for enhancing nitrate and nitrite removal and electricity generation from eutrophic lakes[J].Water Research,2012,46(9):6445-6453.
[41]POUS N,PUIG S,BALAGUER M D,et al.Cathode potential and anode electron donor evaluation for a suitable treatment of nitrate-contaminated groundwater in bioelectrochemical systems [J].Chemical Engineering Journal,2014,263:151-159.
[42]张立成,程亚楠,于洋,等.阴极室碳氮比对微生物燃料电池的影响[J].中国给水排水,2014,30(23):98-100.
[43]VIRDIS B,RABAEY K,YUAN Z G,et al.Electron fluxes in a microbial fuel cell performing carbon and nitrogen removal[J].Environmentalence & Technology,2009,43(13):5144-5149.
[44]LIU M,YUAN Y,ZHANG L X,et al.Bioelectricity generation by a Gram-positive Corynebacterium sp. Strain MFC03 under alkaline condition in microbial fuel cells[J].Bioresource Technology,2009,101(6):1807-1811.
[45]赵煜,薄晓,马彦,等.不同温度下微生物燃料电池的运行特性[J].化工进展,2014,33(3):629-633.
[46]LI W Q,ZHANG S H,CHEN G,et al.Simultaneous electricity generation and pollutant removal in microbial fuel cell with denitrifying biocathode over nitrite[J].Applied Energy,2014,126:136–141.
[47]车轩,罗国芝,谭洪新,等.脱氮硫杆菌的分离鉴定和反硝化特性研究[J].环境科学,2008,29(10):2931-2937.
[48]YOU S J,REN N Q,ZHAO Q L,et al.Improving phosphate buffer free cathode performance of microbial fuel cell based on biological nitrification[J]. Biosensors & Bioelectronics,2009,24(12):3698-3701.
[49]贾璐维,赵剑强,胡博,等.MFC强化同步短程硝化反硝化工艺的启动[J].环境工程学报,2015,9(4):1831-1836.
[50]JANG J K,PHAM T H,CHANG I S,et al.Construction and operation of a novel mediator-and membrane-less microbial fuel cell[J].Process Biochemistry,2004,39(8):1007-1012.
[51]CUHEL J,SIMEK M,LAUGHLIN R,et al.Insights into the effect of soil pH on N2O and N2emissions and denitrifier community size and activity[J].Applied & Environmental Microbiology,2010,76 (6):1870-1878.
[52]WAKELIN S,NELSON P N,ARMOUR J D,et al.Bacterial community structure and denitrifier(nir-gene)abundance in soil water and groundwater beneath agricultural land in tropical North Queensland Australia[J].Soil Research,2011,49(1):65-76.
[53]KRISHNANI K K.Detection and diversity of nitrifying and denitrifying functional genes in coastal aquaculture[J].Aquaculture,2010,302(1):57-70.
[54]MORALES S E,COSART T,HOLBEN W E.Bacterial gene abundances as indicators of greenhouse gas emission in soils[J].Isme Journal,2010,4(6):799-808.
[55]RISGAARD-PETERSEN N,LANGEZAAL A M,INGVARDSEN S,et al.Evidence for complete denitrification in a benthic foraminifer[J].Nature,2006,443(7107):93-96.
[56]VILAR-SANZ A,PUIG S,GARCIA-LLEDO A,et al.Denitrifying bacterial communities affect current production and nitrous oxide accumulation in a microbial fuel cell[J].PLoS One,2013,8(5):991-994.
[57]GREGORY K B,BOND D R,LOVLEY D R.Graphite electrodes as electron donors for anaerobic respiration[J].Environmental Microbiology,2004,6(6):596-604.
[58]ZHU G C,ONODERA T,TANDUKAR M,et al.Simultaneous carbon removal,denitrification and power generation in a membrane-less microbialfuel cell[J].Bioresource Technology,2013,146(10):1-6.
[59]NGUYEN V K,HONG S,Park Y,et al.Autotrophic denitrification performance and bacterial community a biocathodes of bioelectro chemical systems with either abiotic or biotic anodes[J].Journal of Bioscience & Bioengineering,2014,119(2):180-187.
[60]KONDAVEETI S,LEE S H,Park H D,et al.Bacterial communities in a bioelectrochemical denitrification system:the effects of supplemental electron acceptors[J].Water Research,2014,51(6):25-36.
[61]SONG H L,ZHU Y,LI J.Electron transfer mechanisms characteristics and applications of biological cathode microbial fuel cells-A mini review[J].ArabianJournal of Chemistry,2015,7:1878-1886.
[62]CHEN G W,CHOI S J,LEE T H,et al.Application of biocathode in microbial fuel cells:cell performance and microbial community[J].Applied Microbiology & Biotechnology,2008,79 (3):379-388.
[63]CHEN G W,CHOI S J,CHA J H,et al.Microbial community dynamics and electron transfer of a biocathode in microbial fuel cells[J].Korean Journal Chemical Engineering,2010,27(5):1513-1520.
Research progress of biological nitrogen removal by microbial fuel cell
ZHAO Huimin1,2,LI Xiaoling1,ZHAO Jianqiang1
(1School of Environmental Science and Engineering,Chang’an University,Xi’an 710054,Shaanxi,China;2Department of Chemistry and Chemical Engineering,Heze University,Heze 274015,Shandong,China)
Abstract:Microbial fuel cell (MFC) is a new technology for wastewater treatment while generating electricity simultaneously. Applying MFC to nitrogen removal makes the system denitrification MFC or simultaneous nitrification and denitrification (SND) MFC. This paper firstly gave an introduction on the development of biological denitrification in MFC system. Then we analyzed factors influencing MFC nitrogen removal efficiency. The analysis was mainly focused on the MFC configuration (space configuration,electrode materials,separation materials),the operation conditions (nitrogen components concentrations,HRT,dissolved oxygen,carbon source and C/N ratio,temperature,pH,external resistance),as well as the gene expression and diversity of denitrifying bacteria in systems. Finally,suggestions were proposed as following:developing high economic and efficient electrode materials with strong electron transfer ability and ammonia oxidation catalytic function,optimizing the operation conditions of the MFC denitrification systems and analyzing nitrogen removal mechanism,and screening efficient denitrification bacteria through the analysis of microbial community structure in MFC denitrification systems.
Key words:microbial fuel cell (MFC); wastewater treatment; biological nitrogen removal; denitrification; catalysis; anaerobic
中图分类号:X 703.1
文献标志码:A
文章编号:1000–6613(2016)04–1216–07
DOI:10.16085/j.issn.1000-6613.2016.04.040
收稿日期:2015-10-23;修改稿日期:2015-12-20。
基金项目:长安大学中央高校基本科研业务费专项(2013G3292017)及陕西省科技发展计划(2014K15-03-02)项目。
