高迁移率蛋白1在糖尿病大鼠视网膜组织中的表达及其机制
2016-05-17徐海月
姜 双,徐海月
作者单位:(121000)中国辽宁省锦州市,锦州医科大学附属第三医院眼科
·实验论著·
高迁移率蛋白1在糖尿病大鼠视网膜组织中的表达及其机制
姜双,徐海月
作者单位:(121000)中国辽宁省锦州市,锦州医科大学附属第三医院眼科
Citation:Jiang S, Xu HY.Expression and mechanism of high mobility group box protein-1 in retinal tissue of diabetic rats.GuojiYankeZazhi(IntEyeSci) 2016;16(5):829-832
摘要
目的:探讨高迁移率蛋白1(high mobility group box 1,HMGB1)在糖尿病大鼠视网膜中的表达及其可能机制。
方法:将SD大鼠60只随机分为糖尿病组和对照组。采用STZ腹腔注射制作糖尿病大鼠模型,糖尿病组大鼠腹腔注射STZ 60mg/kg,对照组腹腔注射同等剂量的生理盐水。分别于1、2和4mo时处死大鼠,摘取视网膜,HE染色观察视网膜结构变化,荧光血管造影观察视网膜血管变化,TUNEL染色观察视网膜细胞凋亡情况,Western Blot检测视网膜中HMGB1和NF-κB的表达。
结果:与对照组相比,糖尿病组大鼠视网膜各层细胞排列紊乱,细胞密度减低,可见微血管病变,以及内、外核层变薄和神经节细胞的凋亡;荧光血管造影见周边毛细血管迂曲,可见血管闭塞及无灌注区;Western Blot检测HMGB1和NF-κB表达呈时间依赖性增高,且两者表达呈正相关(P<0.05)。
结论:HMGB1在糖尿病大鼠视网膜中表达增加,HMGB1可能通过NF-κB信号通路参与了糖尿病视网膜病变的发生。
关键词:糖尿病视网膜病变;高迁移率蛋白1;核转录因子κB
引用:姜双,徐海月.高迁移率蛋白1在糖尿病大鼠视网膜组织中的表达及其机制.国际眼科杂志2016;16(5):829-832
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病严重的微血管并发症之一,严重影响人类健康和生活质量。目前对DR基本病理过程发生的机制仍然不清楚,慢性低度炎症被认为是DR重要的病理生理机制之一[1],免疫细胞异常活化产生的炎症相关因子介导视网膜炎症性损伤是DR发生发展的重要环节[2]。高迁移率蛋白1(high mobility group box 1,HMGB1)是一种晚期炎症因子,它做为一种损伤相关分子模式(damage-associated molecular patterns,DAMPs)通过与其受体结合参与生理和病理过程,包括炎症因子的释放、细胞迁移和血管新生[3-5]。本研究检测通过HMGB1和NF-κB在不同病程糖尿病大鼠视网膜中的表达,以明确其在DR发生中的可能作用。
1材料和方法
1.1材料取4月龄Sprague-Dawley(SD)雄性大鼠60只,体质量为180~220g,由锦州医科大学实验动物中心提供。分笼饲养,严格遵守清洁级动物大鼠喂养条件。实验动物及实验所有条件符合国家科学技术委员会的《实验动物管理条例》。链脲佐菌素(STZ)和FITC-dextran购于美国Sigma公司,HMGB1兔多克隆抗体和NF-κB兔多克隆抗体购于英国Abcam公司,TUNEL试剂盒购于美国Roche。
1.2方法
1.2.1实验分组所有大鼠适应性喂养1wk后,随机分为两组:对照组和糖尿病组各30只。糖尿病组造模前禁食12h,采用0.1%柠檬酸缓冲液(pH=4.5)配置成1%链脲佐菌素(STZ)溶液,大鼠一次性腹腔注射60mg/kg,注药后4h恢复进食。72h后鼠尾静脉测随机血糖,血糖高于16.7mmol/L者为造模成功。对照组腹腔注射同等剂量的生理盐水。
1.2.2 HE染色观察大鼠视网膜组织学变化对照组和糖尿病大鼠均饲养4mo后分别麻醉取眼球,每组各取3只大鼠,4%多聚甲醛固定24h,梯度酒精脱水、透明、石蜡包埋,沿平行眼轴方向进行切片,厚5μm,脱蜡、HE染色、脱水、透明并封片。光镜下观察大鼠视网膜形态学变化。
要尊重学生的主体权利,尽可能多地满足学生的利益诉求,把促进学生的成长和发展作为出发点和目标;要改变教学方式以及师生关系,重新认识学生在教学过程中的地位,要求学生从教学的“边缘”角色转变为教学的参与者,学习变成了教师指导下自主探究的过程。
1.2.3 TUNEL染色观察视网膜中细胞凋亡变化石蜡切片常规脱蜡至水,微波修复,蛋白酶K 37℃孵育30min,滴加Tunel反应液50μL(试剂①5μL+试剂②45μL),置于37℃暗盒中孵育60min,滴加POD 50μL,37℃暗盒中孵育30min,DAB显色,苏木素复染,盐酸酒精分化,返蓝,梯度酒精常规脱水,二甲苯透明,中性树胶封片,倒置显微镜下观察视网膜细胞凋亡情况。
1.2.4 FITC-dextran荧光血管造影视网膜铺片取对照组和糖尿病4mo组各3只大鼠,1%戊巴比妥钠(0.6mL/100g)腹腔内麻醉,麻醉后固定四肢,快速打开胸腔,暴露心脏,心尖部插入注射器针头,剪开右心耳,用37℃的生理盐水进行灌注,灌注至心脏血液全部流出,再用4%多聚甲醛缓慢灌注2~3mL,最后灌注异硫氰酸葡聚糖荧光素(FITC-dextran,分子量200 000)约2~3mL,轻轻挤压心脏帮助灌注,使造影充分。摘除眼球,取出眼前节及玻璃体,小心剥离视网膜,以视盘为中心放射状剪开,将视网膜移至载玻片上,铺平,盖上盖玻片,荧光显微镜下观察视网膜血管情况。
1.2.5 Western Blot检测大鼠视网膜中HMGB1和NF-κB蛋白的表达分别取对照组、糖尿病组1、2、4mo大鼠,每组各8只,取视网膜,每组各裂解并离心后取上清。按BCA法进行蛋白定量和制定样品。经SDS-PAGE电泳后,将蛋白印记转移至PVDF膜上,TBST封闭1h,一抗(HMGB1和NF-kB,稀释比例均为1∶1000)4℃孵育过夜,洗膜后二抗(山羊抗兔,稀释比例1∶1000)常温孵育1h,洗膜后ECL显影。使用β-actin为内参,使用Image J软件测量各蛋白与内参的灰度值,比较各蛋白与内参灰度值的相对量。

2结果
2.1糖尿病大鼠视网膜形态学变化HE染色结果显示,与糖尿病组相比,对照组大鼠视网膜各层细胞排列规则整齐,密度均匀;而糖尿病4mo组大鼠视网膜各层细胞排列紊乱,细胞密度减低,可见微血管病变、血管扩张。随着病程的延长,出现神经节细胞的水肿、变少,以及内、外核层的变薄(图1)。

图1两组大鼠视网膜形态学变化(HE,×400)A:对照组;B:糖尿病4mo组。
2.2 TUNEL染色观察视网膜细胞凋亡情况糖尿病4mo组大鼠与对照组大鼠视网膜相比,可见神经节细胞层出现明显染色阳性的凋亡细胞,凋亡细胞核呈棕褐色或棕黄色,而对照组偶见零散的凋亡细胞(图2)。
2.3 FITC-dextran荧光血管造影视网膜铺片情况对照组视网膜血管自视盘发出的大血管向四周呈放射状分布,毛细血管分布均匀;糖尿病4mo组大鼠视网膜周边毛细血管迂曲,可见血管闭塞及无灌注区(图3)。
2.4大鼠视网膜中HMGB1和NF-κB蛋白的表达经Western Blot检测,与对照组相比,糖尿病1、2、4mo组HMGB1和NF-κB的表达量有统计学差异(P<0.05,表1,图4~5)。随糖尿病时间延长,HMGB1和NF-κB的蛋白表达量逐渐增加,呈明显的时间依赖性。经Pearson相关分析,表明HMGB1与NF-κB的表达呈正相关(r=0.718,P<0.01,图6)。
3讨论
本研究发现,随着糖尿病病程的进展,大鼠视网膜血管逐渐闭塞,且于16wk时出现无灌注区,同时视网膜细胞出现凋亡,以神经节细胞出现最早、程度最重,逐渐扩展到内、外核层。
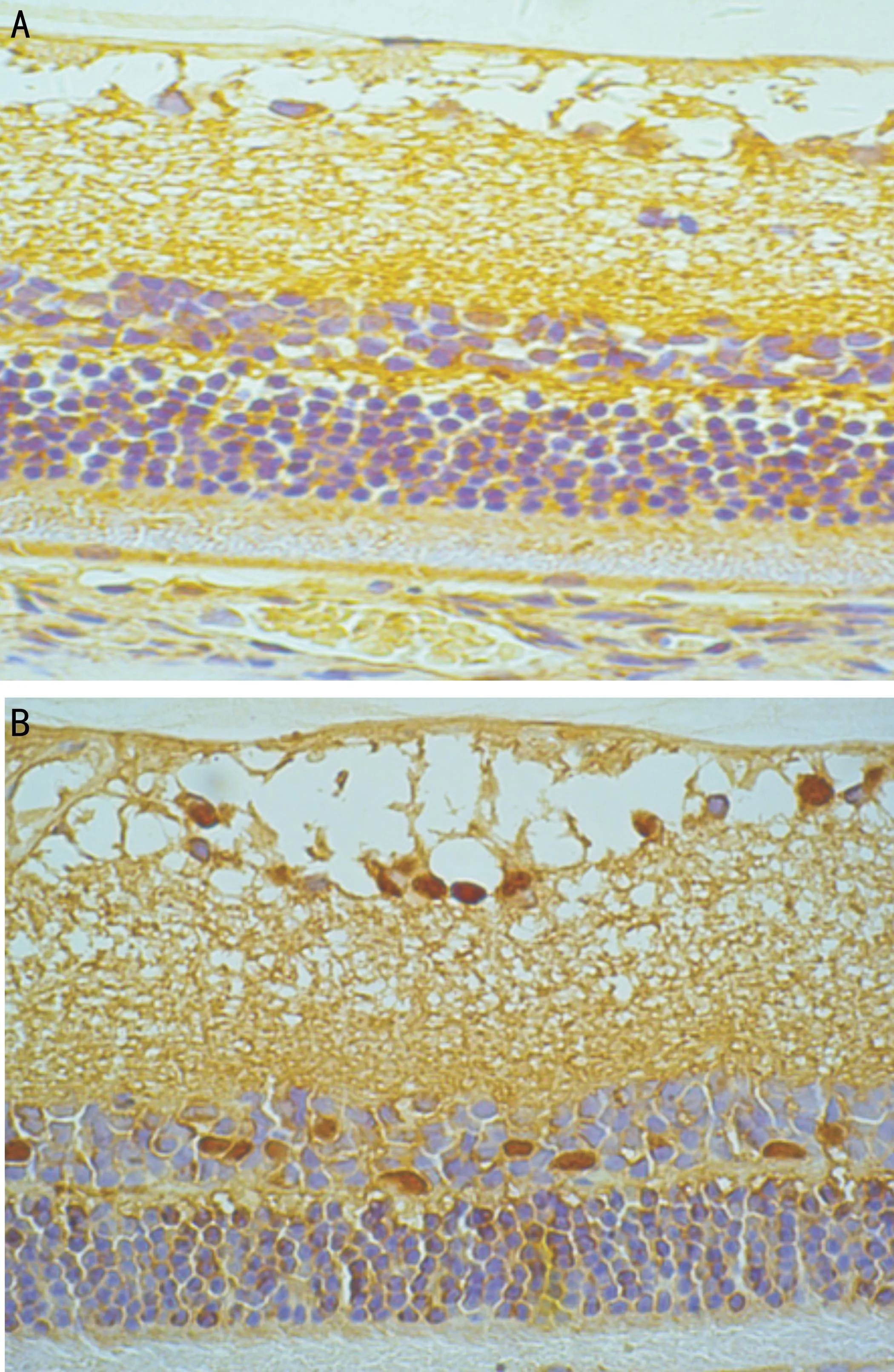
图2TUNEL染色观察视网膜细胞凋亡结果A:对照组;B:糖尿病4mo组。
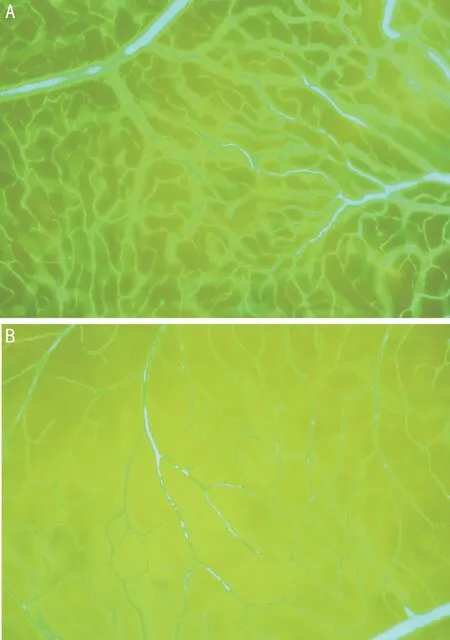
图3大鼠视网膜荧光血管造影结果A:对照组;B:糖尿病4mo组。
HMGB1又称为高迁移率蛋白1,一种染色质结合蛋白,其结构高度保守,在几乎所有类型的细胞中都有表达[6]。在细胞内,HMGB1参与稳定核小体结构,参与DNA的复制、重组、转录和翻译[7-9]。HMGB1可以由受损或坏死的细胞被动分泌,或由有免疫能力的细胞主动分泌[10-11]。HMGB1被公认是一种晚期炎症因子,通过不同机制引发炎症反应[12-14]。近些年又有研究表明它参与新生血管的生成[15-16],在一些组织中促进新生血管的生成[17-19]。
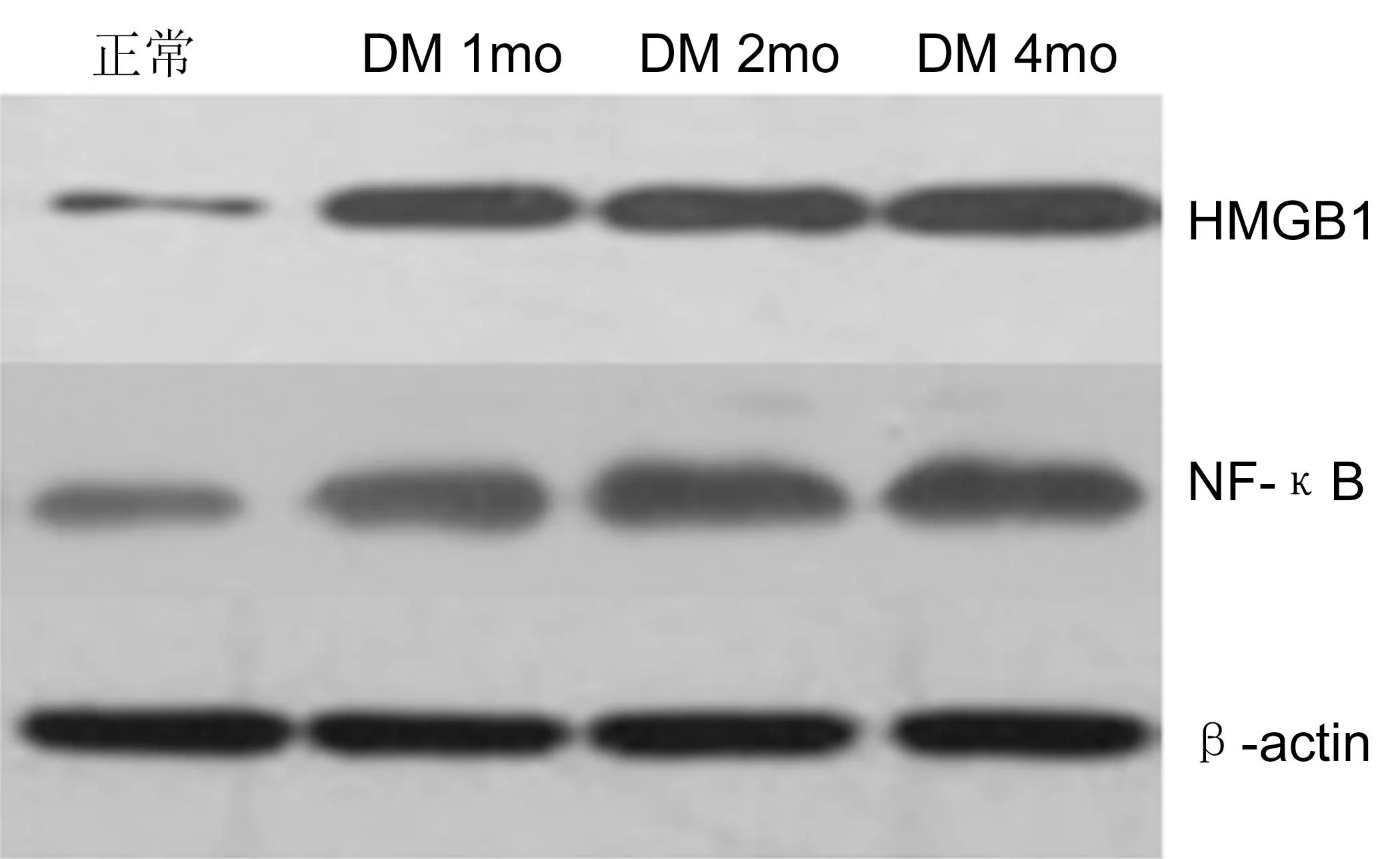
图4大鼠视网膜中HMGB1和NF-κB蛋白的表达。
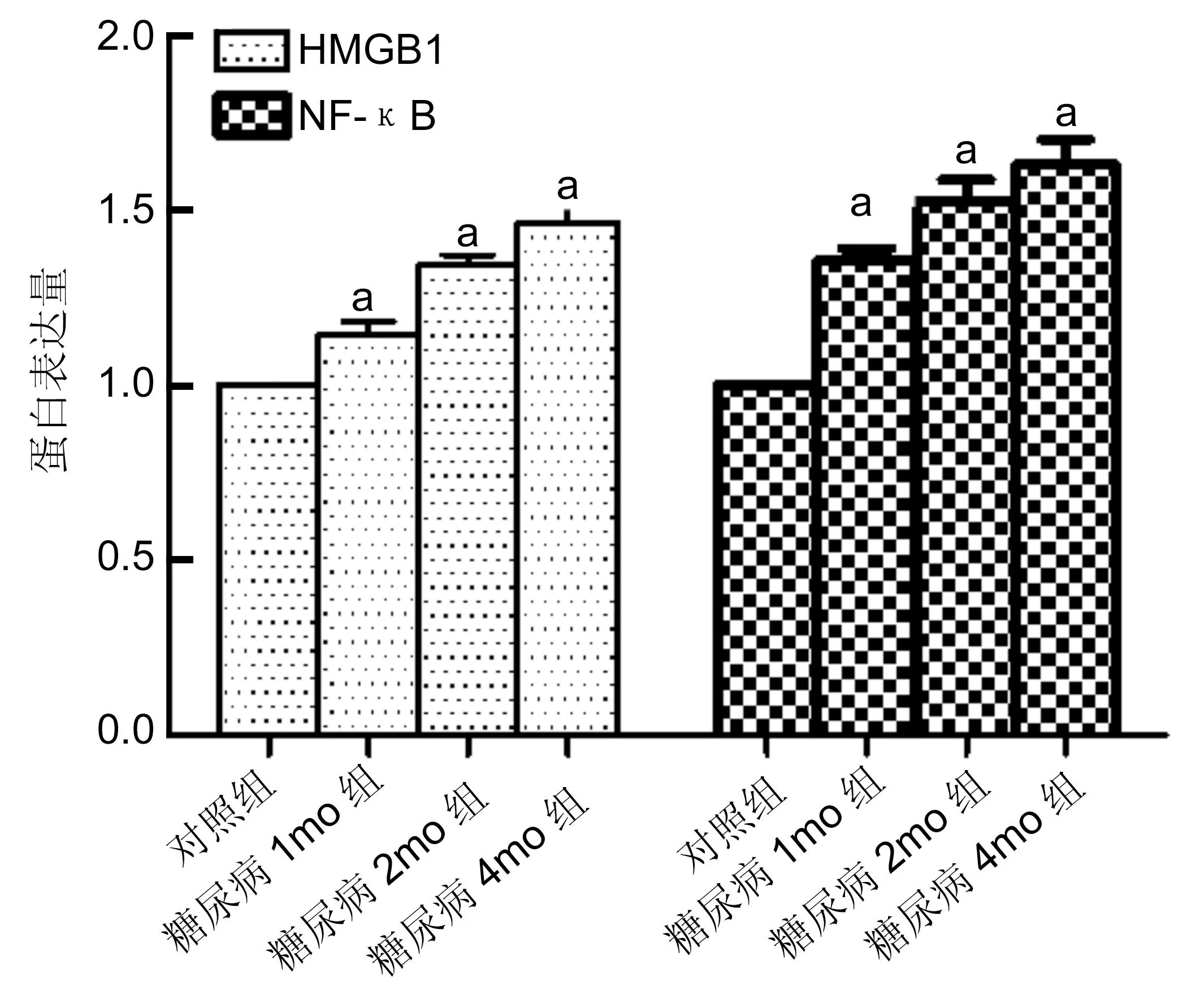
图5大鼠视网膜中HMGB1和NF-κB蛋白表达量的统计学结果aP<0.05vs对照组。

图6HMGB1与NF-κB蛋白表达的相关性分析。
表1大鼠视网膜中HMGB1和NF-κB蛋白的表达


分组HMGB1表达量NF-κB表达量正常对照组11糖尿病1mo组1.16±0.551.24±0.95糖尿病2mo组1.29±0.131.36±0.49糖尿病4mo组1.48±0.101.64±0.09 F7.74842.57P0.0220.00
本研究表明,在糖尿病大鼠视网膜中,HMGB1表达随病程进展而增多,近期有学者在增殖性DR患者的玻璃体和增殖膜中发现,HMGB1的表达明显高于非糖尿病人群,表明HMGB1可能在DR的发病过程中发挥了重要作用,与本研究结果相似[20]。同时有多项研究在细胞层面验证了HMGB1在高糖环境中表达增高:Mudaliar等[21]将血管内皮细胞在正常葡萄糖浓度、高糖浓度、中等升高葡萄糖浓度和葡萄糖波动不同组处理后,发现HMGB1及其受体TLR2和TLR4表达均增加,TLR4的升高更具有意义。另有研究表明[22],在高糖处理的视网膜色素上皮细胞(retinal pigment epithelial cells,RPE)中,HMGB1的表达随高糖处理时间的延长呈逐渐增加的趋势,且由胞核内逐渐向胞浆中转移,这与本研究在动物中的研究结果相似。
但HMGB1引起的信号通路变化尚不十分明确,因此本研究同时检测了NF-κB(p65)的表达,研究发现NF-κB的表达随糖尿病病程的延长呈逐渐增多的趋势,与HMGB1的表达趋势一致,且两者的表达呈显著正相关。提示在DR的发生、发展过程中,HMGB1可能是通过NF-κB信号通路发挥作用的。本研究通过检测对照组大鼠和糖尿病组大鼠视网膜中HMGB1和NF-κB的表达,两者的表达均随病程延长而增加,且两者的表达呈正相关。以上结果表明,HMGB1的表达与DR的发病有关,可能是通过NF-κB信号通路发挥作用的,但具体存在怎样的关系,其具体调节过程怎样,这些尚不十分明确,这也是我们在今后的研究工作中需要解决的问题,需要进一步地探讨和验证。
参考文献
1 Torres PF, Kijlstra A. The role of cytokines in corneal immunopathology.OculImmunolInflamm2001;9(1):9-24
2幸正茂,刘菲,袁进. 角膜碱烧伤的免疫学机制研究进展. 眼科研究2010;28(8):796-800
3 Sims GP, Rowe DC, Rietdijk ST,etal. HMGB1 and RAGE in inflammation and cancer.AnnuRevImmunol2010;28:367-388
4 Andersson U, Tracey KJ. HMGB1 is a therapeutic target for sterile inflammation and infection.AnnuRevImmunol2010;29:139-162
5 Huang W, Tang Y, Li L. HMGB1, a potent proinflammatory cytokine in sepsis.Cytokine2010;51(2):119-126
6 Yang H, Antoine DJ, Andersson U,etal. The many faces of HMGB1:molecular structure-functional activity in inflammation,apoptosis, and chemotaxis.JLeukocBiol2013;93(6):865-873
7 Thomas JO, Stott K. H1 and HMGB1:modulators of chromatin structure.BiochemSocTrans2012;40(2):341-346
8 Thomas JO, Travers AA. HMG1 and 2, and related architectural DNA-binding proteins.TrendsBiochemSci2001;26(3):167-174
9 Stros M. HMGB proteins:interactions with DNA and chromatin.Biochim.BiophysActa2010;1799(1-2):101-113
10 Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation.Nature2002;418(6894):191-195
11 Tang D, Kang R, Xiao W,etal. Nuclear heat shock protein 72 as a negative regulator of oxidative stress (hydrogen peroxide)-induced HMGB1 cytoplasmic translocation and release.JImmunol2007;178(11):7376-7384
12 Dvoriantchikova G, Hernandez E, Grant J,etal. The high-mobility group box-1 nuclear factor mediates retinal injury after ischemia reperfusion.InvestOphthalmolVisSci2011;52(10):7187-7194
13 van Beijnum JR, Buurman WA, Griffioen AW. Convergence and amplification of toll-like receptor (TLR) and receptor for advanced glycation end products (RAGE) signaling pathways via high mobility group B1 (HMGB1).Angiogenesis2008;11(1):91-99
14 Ulloa L, Messmer D. High-mobility group box 1 (HMGB1) protein:friend and foe.CytokineGrowthFactorRev2006;17(3):189-201
15 Mitola S, Belleri M, Urbinati C,etal. Cutting edge:extracellular high mobility group box-1 protein is a proangiogenic cytokine.JImmunol2006;176(1):12-15
16 Schlueter C, Weber H, Meyer B,etal. Angiogenetic signaling through hypoxia:HMGB1:an angiogenetic switch molecule.AmJPathol2005;166(4):1259-1263
17 van Beijnum JR, Buurman WA, Griffioen AW. Convergence and amplification of toll-like receptor (TLR) and receptor for advanced glycation end products (RAGE) signaling pathways via high mobility group B1 (HMGB1).Angiogenesis2008;11(1):91-99
18 Biscetti F, Straface G, De Cristofaro R,etal. Highmobility group box-1 protein promotes angiogenesis after peripheral ischemia in diabetic mice through a VEGF-dependent mechanism.Diabetes2010;59:1496-1505
19 Lin Q, Yang XP, Fang D,etal. High-mobility group box-1 mediates toll-like receptor 4-dependent angiogenesis.ArteriosclerThrombVascBiol2011;31(5):1024-1032
20 Abu EI-Asrar, Siddiquei MM,Nawaz MI.The proinflammatory cytokine high-mobility group box-1 mediates retinal neuropathy induced by diabetes.Mediatorsinflamm2014;2014(10):746415
21 Mudaliar H,Pollock C,Ma J.The role of TLR2 and 4-mediated inflammatory pathways in endothelial cells exposed to high glucose.PlosOne2014;9(10):e108844
22 Chen XL,Zhang XD,Li YY,etal.Involvement of HMGB1 mediated signalling pathway in diabetic retinopathy:evidence from type 2 diabetic rats and ARPE-19 cells under diabetic condition.BrJOphthalmol2013;97(12):1598-1603
Expression and mechanism of high mobility group box protein-1 in retinal tissue of diabetic rats
Shuang Jiang, Hai-Yue Xu
Department of Ophthalmology, the Third Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, Liaoning Province, China
Correspondence to:Shuang Jiang. Department of Ophthalmology, the Third Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, Liaoning Province, China. joa810121@126.com
Received:2016-01-12Accepted:2016-04-13
Abstract
•AIM:To investigate the expression and mechanism of high mobility group box protein-1 (HMGB1) in the retina of diabetic rats.
•METHODS:Sixty SD rats were randomly divided into diabetic group and control group. Diabetic rat model was produced by intraperitioneal injection of 1% STZ with 60mg/Kg weight. The rats in control group received intraperitioneal injection of normal saline with same dosage. After injection, the rats were sacrificed and eyeballs were enucleated for HE staining, the retina fluorescence angiography, TUNEL and Western Blot detection at 1, 2 and 4mo for the expressions of HMGB1 and NF-κB.
•RESULTS:Compared with the control group, the retinal cells disorder, cell densities decreases, microvasculars occlusion were founded with inner and outer nuclear layer thinning and ganglion cell apoptosis. The fluorescence angiography showed that peripheral capillaries became circuitous and vascular occlusion and non-perfusion area could be seen. The expressions of HMGB1 and NF-κB were higher than those of control with time dependence and they had significant positive correlations(P<0.05).
•CONCLUSION:The expression of HMGB1 increases in diabetic rat retina, which may involve in the occurrence of diabetic retinopathy through the NF- κB pathway.
KEYWORDS:•diabetic retinopathy;high mobility group box protein-1;NF-Κb
DOI:10.3980/j.issn.1672-5123.2016.5.09
收稿日期:2016-01-12 修回日期: 2016-04-13
通讯作者:姜双.joa810121@126.com
作者简介:姜双,女,博士,主治医师,研究方向:眼底病。
