病理性近视脉络膜新生血管抗VEGF治疗期间黄斑中心凹下的脉络膜厚度变化
2016-05-17袁建树王育文
袁建树,吴 越,王育文
·临床研究·
病理性近视脉络膜新生血管抗VEGF治疗期间黄斑中心凹下的脉络膜厚度变化
袁建树,吴越,王育文
Citation:Yuan JS, Wu Y, Wang YW.Changes of subfoveal choroidal thickness after treated by Ranibizumab for choroidal neovascularization secondary to pathologic myopia.GuojiYankeZazhi(IntEyeSci) 2016;16(5):905-908
摘要
目的:观察高度近视脉络膜新生血管抗VEGF治疗期间的黄斑中心凹下的脉络膜厚度(subfoveal choroidal thickness,SFCT)变化,确定临床与视力预后相关的脉络膜参数。
方法:前瞻性、开放性研究。临床确诊病理性近视脉络膜新生血管患者50例50眼纳入研究。采用国际标准视力表、糖尿病视网膜病变早期治疗研究(ETDRS)视力表测量矫正视力,同时行眼压、检眼镜、眼底照相、荧光素眼底血管造影(FFA)、光学相干断层扫描(OCT)及三面镜作相应检查。治疗前患眼EDTRS视力表视力0~69个字母,平均视力29.69±13.46个字母。所有患眼行玻璃体腔注射雷珠单抗0.05mL,每月随访,观察抗VEGF治疗期间的黄斑中心凹下的脉络膜厚度变化、确定与视功能相关的脉络膜参数。
结果:所有患者平均玻璃体腔注射2.47±2.23次。末次随访时平均矫正视力较治疗前提高13.62±8.98个字母,差异有统计学意义(t=6.69,P<0.05);治疗前、治疗后1、6、12mo,患眼平均SFCT分别为81.48±61.62、79.63±60.98、77.92±61.26、78.34±59.48μm,较治疗前分别降低了2.09±8.93、3.68±7.42、3.16±6.95μm。治疗后1mo平均SFCT与治疗前比较,差异无统计学意义(t=0.95,P>0.05);治疗后6、12mo平均SFCT与治疗前比较,差异有统计学意义(t=2.34、2.61,P<0.05)。24眼(48%)复发,平均每眼复发1.39±1.23次,SFCT自治疗后1mo的75.7±51.6μm到复发时的84.4±55.9μm(比治疗后1mo的厚度增加11.5%),差异有统计学意义(P<0.05)。26眼(52%)无复发眼,治疗后1mo 85.3±52.7μm,6mo 83.6±50.5μm及12mo 84.2±54.2μm ,各时间点SFCT两两比较,差异均无显著的改变(P>0.05)。随访期间未发现治疗相关的全身及眼部严重并发症。
结论:玻璃体腔注射ranibizumab治疗病理性近视脉络膜新生血管疗效显著、安全性高;抗VEGF治疗(雷珠单抗注射)使病理性近视脉络膜新生血管患眼SFCT下降,而CNV复发时表现为SFCT增厚,SFCT的增厚可能是CNV活动期的评估指标。
关键词:病理性近视;雷珠单抗;CNV;中心凹下脉络膜厚度;光学相干断层扫描;早期治疗研究
引用:袁建树,吴越,王育文.病理性近视脉络膜新生血管抗VEGF治疗期间黄斑中心凹下的脉络膜厚度变化.国际眼科杂志2016;16(5):905-908
0引言
在病理性近视眼中,随着病情进展,各种退行性变化如脉络膜视网膜萎缩、漆裂样纹、葡萄肿的形成、眼轴延长引起血流改变导致的脉络膜血管的减少[1-3]、脉络膜新生血管不断增加。有研究报道10%~11%病理性近视患者在11~12a内发生脉络膜新生血管(CNV),因而CNV是导致病理性近视人群严重视力损害的常见并发症[4]。已有报道称CNV经抗VEGF治疗后显示明显的黄斑中心凹下的脉络膜厚度(subfoveal choroidal thickness,SFCT)降低[5-7],但很少有研究描述病理性近视CNV经抗VEGF治疗后脉络膜厚度的改变,Sayanagi等[8]报道抗VEGF治疗后脉络膜厚度出现了短暂的变薄,在这些研究中由于样本量小和随访期限较短,经治疗后脉络膜的改变仍然不明确,CNV活动期的变化与脉络膜厚度的改变之间的相关性也不甚明确。由于EDI-OCT技术为无创、可重复性好,能更精确的评估脉络膜的横断结构及其厚度,我们根据脉络膜的组织解剖学特点,采用该技术对病理性近视CNV患眼的SFCT进行了测量, 为脉络膜血管渗透性的改变提供客观的、可量化的新证据,明确脉络膜厚度变化与CNV活动的相关性,以期对复发病例进行更早期的干预。
1对象和方法
1.1对象前瞻性、开放性研究。我院2013-08/2014-10确诊为病理性近视黄斑区脉络膜新生血管患者50例50眼纳入本次研究。其中男19例19眼,女31例31眼,年龄27~75(平均61.83±11.98)岁。发病到接受治疗时间为1wk~2a,平均病程为6.94±5.69mo。参照文献[9-11]确定纳入标准:(1)年龄大于18岁;(2)屈光度≥-6.00D,眼轴≥26.5mm,眼底呈现豹纹状、漆裂纹、盘周脉络膜萎缩灶等病理性近视改变;(3)黄斑中心凹下或中心凹旁活动性脉络膜新生血管病灶;(4)3mo前未接受过PDT或抗VEGF治疗。眼底检查可见视盘周边萎缩弧,豹纹状眼底改变,黄斑部可见出血水肿,FFA检查可见CNV渗漏伴或不伴视网膜下出血,OCT检查可见黄斑部视网膜水肿,中心凹下或中心凹旁CNV形成。排除标准:(1)老年性黄斑变性、血管样条纹、外伤、脉络膜炎等其他原因引起的黄斑区脉络膜新生血管;(2)眼表存在未控制的炎症;(3)合并糖尿病性视网膜病变、视网膜静脉阻塞等视网膜血管性疾病;(4)合并葡萄膜炎、视网膜色素上皮撕裂、急性眼内感染、中心性浆液性脉络膜视网膜病变;(5)无法控制的高眼压或青光眼;(6)既往曾接受玻璃体腔注射抗VEGF药物或曲安奈德及3mo内曾接受PDT治疗者;(7)伴有心肺功能不全等全身疾病者;(8)既往曾行近视激光、视网膜脱离术者。
1.2方法所有患者检查视力、眼压、验光、裂隙灯、检眼镜、眼A超、眼B超、三面镜、眼底彩色照相、荧光素眼底血管造影(FFA)和或吲哚青绿眼底血管造影(ICGA)及相干光断层扫描(OCT)。视力均采用国际标准视力表、糖尿病视网膜病变早期治疗研究(ETDRS)视力表检查矫正,由2名经培训的验光师完成。OCT为德国蔡司彩色频域Cirrus HD-OCT,SFCT测量采用EDI技术,以6mm的扫描线对黄斑区后极部进行0°扫描,每张OCT像均由100个扫描图叠加成像。以黄斑区中心凹视网膜最薄点为中心凹标志,SFCT值界定为黄斑中心凹处视网膜色素上皮外界和巩膜层内界之间的垂直距离。OCT由2名独立的指定医生测量,每位医生对每个样本测量3次,取平均值。眼底彩色照相为日本KOWAa-D免散瞳眼底照相机。FFA和(或)ICGA检查采用德国海德堡共聚焦激光眼底造影仪HRA-2,所有眼底彩照和造影检查由2位专门指定医生完成。依据多数研究采用的(1+PRN)治疗方案[10-12],治疗前所有患者签署知情同意书,均被告知治疗可能发生的风险,如结膜下出血、眼压升高、色素上皮撕裂、眼内炎、视网膜脱离、动脉血栓栓塞等。注射后并没有执行严格的每月随访,平均总随访次数为12.5次,无1例失访。每次随访均采用与治疗前相同的设备和方法行视力、眼压、检眼镜和OCT检查。行FFA检查42眼。如OCT检查发现黄斑区视网膜内或视网膜下积液复发,FFA检查发现病灶渗漏或视力下降,变形加重视为需要接受重复注射[10-11]。
统计学分析:采用SPSS 18.0统计软件行统计学分析。各时间点视力、SFCT变化采用配对t检验。以P<0.05为差异有统计学意义。
2结果
2.1一般情况患者平均球镜的屈光不正是-10.9±6.8 (-20.8~-6.0) D,平均眼轴28.9±1.8 (26.3~32.3)mm,中心凹下和中心凹旁CNV分别是39眼(78%) 和11眼(22%)。随访期间抗VEGF治疗次数平均2.47±2.23次。
2.2矫正视力情况治疗前、治疗后1、6、12mo,患眼平均矫正视力分别为32.69±13.12、44.76±14.11、45.31±14.79、46.26±13.57个字母,治疗后1、6、12mo视力较治疗前分别提高了11.69±7.12、12.77±6.91、14.45±8.33个字母,差异均有统计学意义(t=7.18、11.32、8.34,P<0.05);末次随访时平均矫正视力为46.49±14.49个字母,较治疗前提高13.62±8.98个字母,差异有统计学意义(t=6.69,P<0.05)。
2.3 SFCT变化治疗前、治疗后1、6、12mo,患眼平均SFCT分别为81.48±61.62、79.63±60.98、77.92±61.26、78.34±59.48μm,较治疗前分别降低了2.09±8.93、3.68±7.42、3.16±6.95μm。治疗后1mo平均SFCT与治疗前比较,差异无统计学意义(t=0.95,P>0.05);治疗后6、12mo平均SFCT与治疗前比较,差异有统计学意义(t=2.34、2.61,P<0.05)。
2.4 CNV复发情况患者24眼(48%) CNV复发,平均每眼复发1.39±1.23次,SFCT自治疗后1mo的75.7±51.6μm到复发时的84.4±55.9μm(比治疗后1mo的厚度增加11.5%),差异有统计学意义(P<0.05),见图1。26眼(53%)CNV无复发,治疗后1mo 85.3±52.7μm、6mo 83.6±50.5μm及12mo 84.2±54.2μm,各时间点SFCT两两比较,差异均无显著的改变,无统计学差异(P>0.05),见图2。
2.5视网膜水肿情况治疗后大多数患眼视网膜水肿较治疗前消退明显,RPE信号紊乱,少数患眼视网膜水肿消退不明显。期间观察到16例患者出现后极部脉络膜萎缩的变化,其中9例原脉络膜萎缩区域扩大,5例出现CNV周围的萎缩灶或原萎缩灶扩大,2例出现中心凹纤维疤痕形成。
2.6随访情况随访期间未见视网膜脱离、视网膜撕裂、眼压持续升高、眼内炎等与治疗相关的严重并发症,未见全身严重不良反应发生。
3讨论
众所周知,病理性近视患者黄斑区CNV发生、发展的病理基础是眼部异常血管的增生,主要与VEGF因子的调节与表达密切相关。玻璃体腔注射抗血管内皮生长因子药物(intravitreal anti-vascular endothelial growth factor monoclonal antibody ranibizumab,IVR)可以穿透视网膜各层进入脉络膜,引起脉络膜毛细血管窗孔减少,降低脉络膜的渗透性,从而对脉络膜功能产生影响[13-14]。Ranibizumab是抗VEGF单克隆抗体片段,抗VEGF治疗高度近视CNV的长期疗效在国内外已有许多研究报道。
本研究参照国外相关文献制定严格的入选、排除标准及重复注射指标[9-12],对病理性近视CNV患者50例50眼进行ranbizumab注射前后的随访观察,结果显示末次随访时视力较前提高,BCVA从基线的32.69±13.12个字母到1mo的44.76±14.11个字母,6mo的45.31±14.79个字母,12mo的46.26±13.57个字母,提示玻璃体腔注射ranibizumab治疗病理性近视脉络膜新生血管疗效显著,与Ruiz-Moreno等的研究结果相似[15]。
脉络膜作为外层视网膜主要的营养供应来源,其血管系统的正常结构与功能对于视网膜显得尤为重要,观察脉络膜形态有助于进一步了解视网膜脉络膜疾病的病理生理过程。类似中心性浆液性脉络膜视网膜病变患眼玻璃体腔注射贝伐单抗后的脉络膜改变,IVR治疗后患眼的SFCT存在不同程度的变薄,这可能与IVR使脉络膜血管渗透性降低有关。已有研究认为SFCT可反映脉络膜循环的功能及脉络膜毛细血管数量,即SFCT是脉络膜循环功能的一项有效预测指标[16]。Maruko等[17]在息肉样脉络膜血管病变(polypoidal choroidal vasculopathy, PCV)患者中基线的SFCT较正常眼厚,认为脉络膜厚度的增高可能与脉络膜的通透性增加有关。
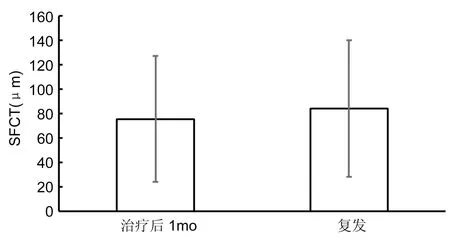
图1复发病例不同时段SFCT值。
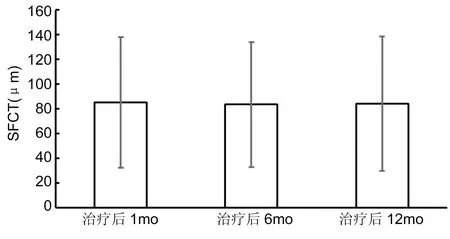
图2未复发病例不同时段SFCT值。
抗VEGF药物使玻璃体腔内VEGF的浓度下降致CNV减退[6,18],SFCT的降低可能是抗VEGF药物通过降低一氧化氮使脉络膜血管收缩,降低脉络膜的通透性[19]。SFCT降低可能进一步降低渗出型改变,脉络膜变薄与视网膜色素上皮萎缩有关。本次研究结果显示高度近视黄斑区CNV在抗VEGF治疗后6mo SFCT降低,支持上述理论。本研究中第一次复发时间平均为5mo左右,复发病例在CNV复发时显示SFCT显著增加,而未复发病例在抗VEGF治疗后6、12mo内SFCT仍无增厚,提示脉络膜渗透性增加和CNV复发时脉络膜的水肿可能会增加脉络膜厚度,我们是否可以推测在复发的病理性近视黄斑区CNV患眼由于VEGF上调使血管扩张、通透性增加,再次导致SFCT的增厚。
本研究结果表明,抗VEGF治疗使病理性近视黄斑区脉络膜新生血管患眼SFCT下降,但随着CNV的复发SFCT会随之增加。病理性近视CNV眼脉络膜厚度的增加可能反映CNV的复发。如果这些结果在今后的研究中被证实,SFCT可能成为一个药物选择和随访评估的相关参数,作为与CNV复发相关的治疗策略,我们需要更大样本量的前瞻性研究来证实。
虽然CNV的活动性可能随着抗VEGF治疗下降,高度近视CNV眼视力丧失的原因可能与其他的病因相关,如高度近视脉络膜萎缩、视网膜下的纤维化和白内障[20],这些情况可能在抗VEGF治疗后视力改善不明显。再者,在高度近视CNV眼中RPE的萎缩更明显[18],这在视功能上使得抗VEGF治疗效果更局限。视力预后与脉络膜厚度改变的相关性可能被其他视力丧失的原因混淆,如高度近视CNV视网膜脉络膜萎缩。
我们的研究结果仍存在一些局限性:(1)患者数量较少,研究的随访周期的变化影响了抗VEGF治疗后视力预后评估的精确性及与之相关的SFCT变化。(2)目前还没有测量脉络膜厚度的精准软件,SFCT的测量由两名独立的观察者采用仪器自带的卡尺手动测量,虽然经数次测量取得平均值,但不可避免会存在一定误差。新的自动分析软件可能会降低偏差并减少测量脉络膜厚度的次数。
参考文献
1 Ikuno Y,Sayanagi K,Soga K,etal.Lacquer crack formation and choroidal neovascularization in pathologic myopia.Retina2008;28(8):1124-1131
2 Avila MP,Weiter JJ,Jalkh AE,etal.Natural history of choroidal neovascularization in degenerative myopia.Ophthalmology1984;91(12):1573-1581
3 Curtin BJ.The posterior staphyloma of pathologic myopia.TransAmOphthalmolSoc1977;75:67-86
4 Silva R.Myopic maculopathy:a review.Ophthalmologiea2012;228(4):197-213
5 Maruko I, Iida T, Oyamada H,etal.Choroidal thickness changes after intravitreal ranibizumab and photodynamic therapy in recurrent polypoidal choroidal vasculopathy.AmJOphthalmol2013;156(3):548-556
6 Cao XS,Peng XY,You QS,etal.Subfoveal choroidal thickness change after intravitreal ranibizumab for idiopathic choroidal neovascularization.Retina2014;34(8):1554-1559
7 Ahn SJ, Kim TW, Ahn J,etal.Subfoveal choroidal thickness in idiopathic choroidal eovascularization.Ophthalmology2014;121(7):1486-1487
8 Sayanagi K,Jo Y,Ikuno Y.Transient choroidal thinning after intravitreal bevacizumab injection for myopic choroidal neovascularization.JClinExpOphthalmol2011;2:165
9 Lain DS,Chan WM,Liu DT,etal.Photodynamic therapy with verteporfin for subfoveal choroidal neovascularisation of pathologic myopia in Chinese eyes:a prospective series of 1 and 2 year follow up.BrJOphthalmol2004;88(10):1315-1319
10 Monés JM,Amselem L,Serrano A,etal.Intravitreal ranibizumab for choroidal neovascularization secondary to pathologic myopia:12-month results.Eye2009;23(6):1275-1280
11 Silva RM,Ruiz-Moreno JM,Rosa P,etal.Intravitreal ranibizumab for myopic choroidal neovascularization:12-month results.Retina2010;30(3):407-412
12 Vadala M, Pece A, Cipolla S,etal. Is ranibizumab effective in stopping the loss of vision for choroidal neovascularisation in pathologic myopia? A long-term follow-up study.BrJOphthalmol2011;95(5):657-661
13 Gaudreault J,Fei D,Beyer JC,etal.Pharmacokinetics and retinal distribution of ranibizumab, a humanized antibody fragment directed against VEGF-A, following intravitreal administration in rabbits.Retina2007;27(9):1260-1266
14 Shimomura Y, Hirata A,Ishikawa S,etal. Changes in choricocapllaris fenestration of rat eyes after intravitreal bevacizumab injection.Graefe’sArchClinExpOphthalmol2009;247(8):1089-1094
15 Silva RM,Ruiz-Moreno JM, Nascimento J,etal.Short-term efficacy and safety of intravitreal ranibizumab for myopic choroidal neovascularization.Retina2008;28(8):1117-1123
16 Kang HM,Kwon HJ,Yi JH,etal.Subfoveal choroidal thickness as a potential predictor of visual outcome and treatment response after intravtreal ranibizumab injection for typical exudative age-related macular degeneration.AmJOphthalmol2014;157(5):1013-1021
17 Maruko I,Iida T,Sugano Y,etal. Subfoveal retinal and choroidal thickness after verteporfin photodynamictherapy for polypoidal choroidal vasculopathy.AmJOphthalmol2011;151(4):594-603,591
18 Hayashi K,Ohno-Matsui K,Shimada N,etal.Long-term pattern of progression of myopic maculopathy:a natural history study.Ophthalmology2010;117(8):1595-1611
19 Peters S,Heiduschka P,Julien S,etal.Ultrastructural findings in the primate eye after intravitreal injection of bevacizumab.AmJOphthalmol2007;143(6):995-1002
20 Saw SM.How blinding is pathological myopia?BrJOphthalmol2006;90(5):525-526
Changes of subfoveal choroidal thickness after treated by Ranibizumab for choroidal neovascularization secondary to pathologic myopia
Jian-Shu Yuan,Yue Wu,Yu-Wen Wang
Foundation item:Medical and Health Research Project from Public Health Department of Zhejiang Province(No.2013KYA186)
Department of Ophthalmology,Ningbo No.6 Hospital,Ningbo 315040,Zhejiang Province, China
Correspondence to:Jian-Shu Yuan. Department of Ophthalmology,Ningbo No.6 Hospital,Ningbo 315040,Zhejiang Province, China. nb6yyk@163.com
Received:2016-02-03Accepted:2016-04-14
Abstract
•AIM:To observe the change of subfoveal choroidal thickness(SFCT) after intravitreal injections of anti-vascular endothelial growth factor monoclonal antibody Ranibizumab in patients with choroidal neovascularization(CNV) secondary to pathologic myopia(PM) and to research the relation between visual acuity and SFCT.
•METHODS:This was a prospective, contrast, open-label study.Fifty pathologic myopia patients with CNV (50 eyes) were recruited in this study. Before the injection,best-corrected visual acuity detected by visual chart from Early Treatment of Diabetic Retinopathy Study(ETDRS),non-contact tonometer,ophthalmoscope,fundus photography, fundus fluorescein angiograph(FFA)and optical coherence tomography(OCT)examination were necessary. All affected eye were treated with intravitreal ranibizumab 0.05mL. Following up for 12mo, the changes of visual acuity and SFCT were compared before and after treatment, also the relation between them.
•RESULTS:All eyes received an average of 2.47±2.23 injections,the final vision of follow-up increased by 13.62±8.98 letters than that before(t=6.69,P<0.05). The SFCT before therapy, 1, 6 and 12mo after treatment were 81.48±61.62, 79.63±60.98, 77.92±61.26 and 78.34±59.48μm and respectively decreased by 2.09±8.93, 3.68±7.42, 3.16±6.95μm compare to pre-treatment.The difference on SFCT at 1mo was not significant compared to before treatment(t=0.95,P>0.05).While after 6 and 12mo,the differences were significant(t=2.34, 2.61;P<0.05). Twenty-four eyes (48%) were with recurrence, mean recurrence times were 1.39±1.23. The SFCT increased from 75.7±51.6μm at 1mo to 84.4±55.9μm(by 11.5%) when recurred, there were significant differences(P<0.05). Twenty-six eyes (52%) were not with recurrence. The SFCT at 1, 6 and 12mo after treatment were 85.3±52.7, 83.6±50.5 and 84.2±54.2μm, there were no significant differences with multiple comparison(P>0.05).There were no serious systemic or local side effects during the follow up.
•CONCLUSION:Intravitreal ranibizumab for CNV secondary to pathologic myopia is safe and can improve the visual acuity.Intravitreal injections of ranibizumab can induce SFCT reduction for CNV secondary to pathologic myopia.We hypothesized that increase of SFCT may be one of evaluation index for CNV activity.
KEYWORDS:•pathologic myopia;ranibizumab;choroidal neovascularization; subfoveal choroidal thickness;optical coherence tomography;Early Treatment of Diabetic Retinopathy Study
DOI:10.3980/j.issn.1672-5123.2016.5.28
收稿日期:2016-02-03 修回日期: 2016-04-14
通讯作者:袁建树.nb6yyk@163.com
作者简介:袁建树,毕业于温州医学院,硕士,主任医师,副院长,研究方向:眼底病、青光眼、白内障。
基金项目:浙江省卫生厅医药卫生一般研究计划(No.2013KYA186)
作者单位:(315040)中国浙江省宁波市第六医院眼科
