Stanniocalcin-1对大鼠神经元缺血性损伤的保护作用
2016-05-16赵蓓姚婕郭生龙
赵蓓,姚婕,郭生龙
·论著·
Stanniocalcin-1对大鼠神经元缺血性损伤的保护作用
赵蓓1a,姚婕2,郭生龙1b
目的:探讨Stanniocalcin-1(STC-1)对神经元缺血性损伤的保护作用及其可能的作用机制。方法:分离培养大鼠大脑皮质神经元,缺氧/缺糖处理构建神经元缺血性损伤模型。构建过表达STC-1的重组逆转录病毒并转染细胞;UCP2 siRNA转染抑制解偶联蛋白2(UCP2)表达;实时荧光定量PCR(qRT-PCR)和Western Blotting检测STC-1和UCP2的mRNA及蛋白表达;乳酸脱氢酶(LDH)方法测定LDH漏出量和噻唑兰(MTT)方法测定细胞生长活力;检测Caspase-3活性。结果:成功建立缺氧/缺糖神经细胞损伤模型。过表达STC-1,缺氧/缺糖损伤的神经元LDH漏出量减少(P<0.01),细胞生长活力显著升高(P<0.05),Caspase-3活性降低(P<0.05),且Bcl-2蛋白表达量增多(P<0.01);另外STC-1下游分子UCP2的mRNA和蛋白表达量显著增加(P<0.01);另外,在过表达STC-1且抑制UCP2的情况下,细胞生长活力明显下降(P<0.05)。结论:STC-1对缺血性损伤的神经细胞起保护作用,可能通过调控UCP2来保护神经细胞。
神经细胞缺血性损伤;Stanniocalcin-1;过表达;解偶联蛋白2
近年来,心脑血管疾病发病率升高,脑卒中已成为第二大死因[1-4]。它具有高发病率、高病死率、高致残率的特点[5-7]。目前,脑卒中引起的缺血性神经细胞损伤无有效治疗。人类斯钙素(stanniocalcin-1,STC-1)于1995年发现[8],不同的细胞都有表达,包括神经细胞、脂肪细胞和巨核细胞甚至癌细胞[9-11]。有文献称STC-1在脑神经元中表达量较高[12],并且对神经元的缺氧性损伤具有保护作用[13],但STC-1通过调控哪些分子保护神经元,还没有明确的报道。因此本实验探讨过表达STC-1对缺血性损伤神经元的保护作用及可能的分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 怀孕16 d的Wistar大鼠,由中国医学科学院实验动物中心提供。
1.1.2 主要试剂和设备 DMEM培养基购自美国Gibco公司;乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒购自上海碧云天生物技术公司;小牛血清及马血清购自中国医学科学院天津血研所;Caspase-3检测试剂盒购自上海浩然生物技术有限公司;MTT购自上海生工公司;反转录试剂盒购自赛默飞世尔科技公司;SYBR Premix Ex Taq II购自大连宝生物工程有限公司;解偶联蛋白2(uncou-pling protein-2,UCP2)兔多抗、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)兔多抗、GAPDH兔多抗购自北京博奥森生物技术有限公司;STC-1羊多抗购自美国Santa Cruz Biotechnology公司;Earle's液购自森贝伽(南京)生物公司。高速常温离心机、移液器购自德国Eppendoff公司;蛋白凝胶成像系统、普通PCR仪购自美国Bio-Rad公司;超净工作台购自北京医疗设备厂产品。电泳仪购自英国Syngene公司;紫外分光光度计购自美国Thermo Scientific公司。
1.2 方法
1.2.1 大脑皮质神经元的培养和鉴定 于无菌条件下取出怀孕16 d大鼠的胎鼠,将其大脑皮质分离并置于预冷的DMEM培养基中,加入0.25%胰蛋白酶在37℃孵育30 min,然后用移液枪反复吹打,使细胞分离,形成密度为1.0×109/L的细胞悬液,接种于涂有多聚-D-赖氨酸的24孔板上,置于37℃、5%CO2细胞培养箱中培养,培养基为含血清的DMEM培养基(内含:10%小牛血清、10%马血清、1×105U/L青霉素、1× 105U/L链霉素,pH 7.2~7.4)。24 h细胞贴壁后换液除去死细胞。第6天加入10 μmol/L阿糖胞苷培养24 h抑制非神经元的生长。培养第9天的细胞4%多聚甲醛于室温下固定25 min,PBS清洗后0.2%Triton X-100室温作用30 min,加入5%脱脂奶粉的PBS溶液封闭30 min,兔抗鼠MAP2多抗(1∶100)4℃过夜孵育,PBS清洗后加入FITC标记的羊抗兔二抗(1∶100),37℃孵育1 h,荧光显微镜下观察。本实验严格按照国家卫生和医学研究委员会对实验用动物护理和使用的指导方针,并经我院实验动物伦理委员会批准。
1.2.2 神经元缺氧/缺糖损伤及MTT测定 取培养9 d的神经元细胞,分为2组:缺氧/缺糖损伤组和正常组。将缺氧/缺糖损伤组的原培养液换为无糖Earle’s液,培养皿放入通入95%N2和5%CO2混合气体的缺氧罐内;正常组换成含糖的Earle’s液,各培养8 h,然后取出培养皿,弃去Earle’s液,换为无血清的DMEM,置于培养箱中培养16 h。
MTT测定:将要检测的细胞按照每孔为1×105个细胞量接种于96孔板,每孔加入MTT溶液(5 g/L)20 μL,置于37℃、5%CO2的培养箱中培养4 h后,小心弃掉孔内培养液,每孔再加入二甲基亚砜150 μL,室温下振荡10 min,于OD值为490 nm处测量各孔的吸光度值,设置4个重复,取其平均数作为实验结果。
1.2.3 载体构建及病毒感染 据报道T29H细胞表达STC-1的量比较高,因此TRIZOL法提取8×105个T29H细胞的总RNA,反转成cDNA。扩增STC-1基因全长的上游引物:5’-ATGGATCCATGCTCCAAAACTCAGCAGTGCTTC-3’(粗体代表BamHI酶切位点);下游引物:5’-CGGAATTCTTATGCACTCTCATGGGATGTGCG-3’(粗体代表EcoRI酶切位点)。PCR扩增条件:预变性94℃2 min,变形94℃30 s,退火56℃1 min,延伸72℃2 min,35个循环,延伸72℃10 min。将扩增产物加到1%的琼脂糖凝胶中进行电泳,回收且双酶切,与用同样双酶切过的pBabe/嘌呤霉素逆转录病毒载体连接,转化到DH5a细胞中,筛选阳性克隆,按照质粒小提试剂盒说明书提取质粒并用上述酶双酶切,琼脂糖凝胶电泳结果正确的阳性克隆送上海英骏生物技术有限公司测序。将测序正确的质粒转染进293T细胞产生逆转录病毒,获取含病毒的上清液并贮存于-70℃。用病毒溶液感染缺氧/缺糖损伤的神经元,感染24 h后用嘌呤霉素(1.5 μg/mL)筛选细胞5 d,获得过表达STC-1的细胞。
1.2.4 细胞转染 为了获得过表达STC-1且抑制UCP2的细胞,利用Turbofect转染试剂将UCP2的小干扰RNA(siRNA:5’-GCUAAAGUCCGGUUACAGATT-3’)和非特异性siRNA分别转染到过表达STC-1的细胞中,抑制UCP2的表达。分为3组:只过表达STC-1的缺氧/缺糖损伤的神经元(pBabe-STC-1)组、过表达STC-1+抑制UCP2处理的缺氧/缺糖损伤的神经元(pBabe-STC-1+UCP2 siRNA)组、过表达STC-1+转染非特异性siRNA(STC-1+非特异性siRNA)组。
1.2.5 实时荧光定量PCR(qRT-PCR) 收集要进行检测的细胞,用TRIZOL裂解细胞提取细胞总RNA,利用反转录试剂盒将总RNA反转录成cDNA,进行qRTPCR的基因扩增检测,见表1。qRT-PCR反应程序:预变性94℃10 min;58℃1 min,72℃1 min,共40个循环;后延伸72℃10 min。反应体系(20 μL):cDNA模板1 μL,上下游引物各0.5 μL,SYBR Premix Ex Taq II 10 μL和灭菌蒸馏水8 μL。

表1 qRT-PCR引物
1.2.6 蛋白免疫印记(Western Blot)裂解细胞,提取其中的蛋白质,测定浓度,加上样Buffer,置于沸水中5 min,取20 μg蛋白质样品进行SDS-PAGE电泳,转移到PVDF膜后,用相应一抗4℃孵育过夜包括UCP2兔多抗、Bcl-2兔多抗、GAPDH兔多抗、STC-1羊多抗,稀释度均为1∶500,PBS洗3次去除多余的抗体,室温孵育二抗2 h包括羊抗兔二抗和小鼠抗羊二抗,二抗稀释度为1∶1 000,通过凝胶成像系统观察结果。
1.2.7 过表达STC-1的免疫荧光检测 过表达后的细胞用4%多聚甲醛室温作用25 min,PBS清洗,用0.2% Triton X-100的PBS溶液室温作用30 min,加入5%脱脂奶粉的PBS溶液封闭25 min,STC-1羊多抗(1∶100)4℃过夜孵育,PBS清洗后加FITC标记的鼠抗羊二抗(1∶100),37℃孵育1 h,DAPI作用15 min,荧光显微镜下观察。培养第9天的细胞做相同处理,作为对照组。1.2.8 LDH和Caspase-3活性检测 收集培养上清液,依据文献[14],按照试剂盒的说明测定培养液中LDH和Caspase-3的活性。
1.3 统计学处理
采用SPSS16.0统计软件进行分析,计量资料以(均数±标准差)表示,t检验,单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 皮质神经元的鉴定和神经元缺血性损伤上调STC-1的表达
MAP2的免疫荧光鉴定显示神经元细胞体及树突均有着色,在随机视野的150个细胞中,纯度达90%以上(图1A)。MTT法测定细胞活力显示正常组和缺氧/缺糖损伤组细胞活力分别为(0.560±0.020)、(0.230± 0.003),后者低于前者(P<0.05),表明缺氧/缺糖性处理成功。正常组和缺氧/缺糖损伤组的STC-1 mRNA表达量分别为(1.01±0.02)、(1.89±0.05),蛋白表达量分别为(1.02±0.05)、(2.02±0.25),差异有统计学意义(P<0.05),这提示缺氧/缺糖损伤可引起神经元STC-1表达量上调(图1B)。

图1 皮质神经元鉴定和神经元缺血性损伤上调STC-1的表达
2.2 STC-1在细胞中过表达
本实验构建STC-1的过表达载体,包装成逆转录病毒感染细胞,并检测细胞中STC-1的mRNA和蛋白含量是否过表达。实验分组:①实验组(pBabe-STC-1):过表达STC-1的缺血性损伤的神经元;②对照组:正常神经元;③阴性组(pBabe):用含有空载体的逆转录病毒感染缺氧/缺糖损伤的神经元。对照组、阴性组和实验组的STC-1的mRNA表达量分别为(0.90± 0.05)、(1.90±0.80)、(7.60±1.50),STC-1蛋白表达量分别为(1.06±0.04)、(2.03±0.50)、(8.30±0.31),实验组的STC-1表达量较阴性组明显升高(P<0.01),见图2A。另外,STC-1免疫荧光实验结果显示STC-1过表达后其在细胞内的分布明显增多,见图2B-C,说明STC-1的过表达实验成功。
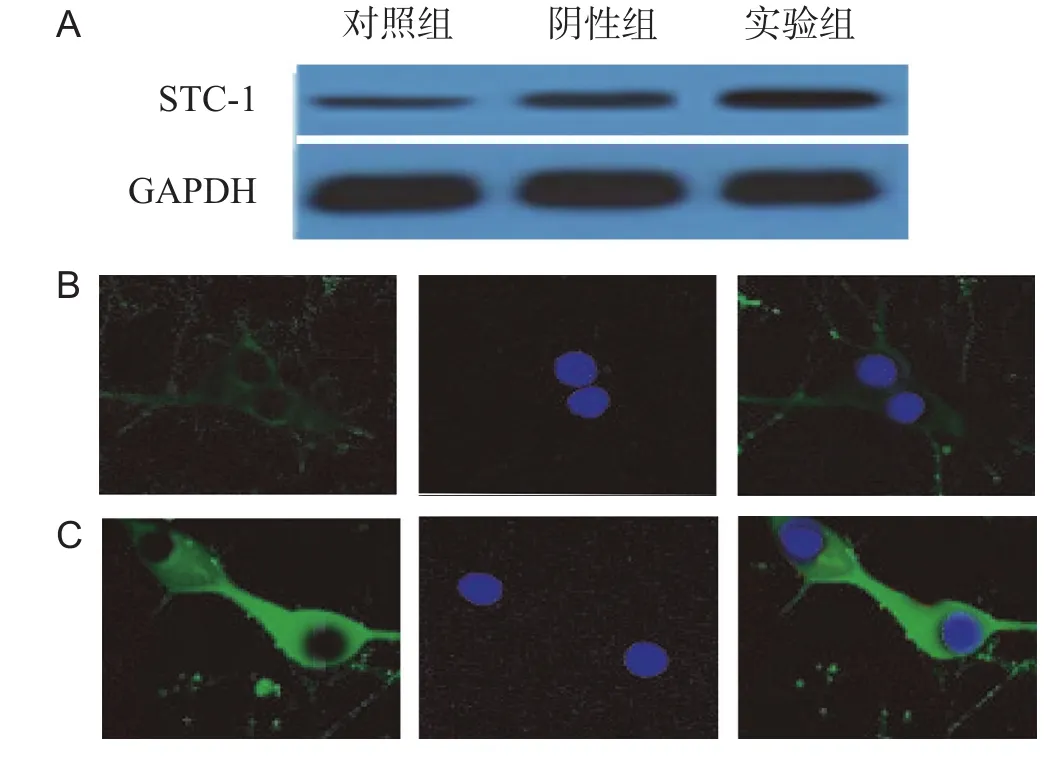
图2 病毒转染后各组STC-1的表达情况
2.3 STC-1过表达对神经细胞起到保护作用
对照组、阴性组和实验组的细胞活力分别为(0.48±0.03)、(0.27±0.01)、(0.40±0.01),实验组的细胞活力明显高于阴性组(P<0.05)。另外对照组、阴性组和实验组的LDH漏出量分别是(6.25±0.60)、(18.62± 0.80)、(8.53±0.20),实验组的LDH漏出量明显少于阴性组(P<0.01)。
2.4 STC-1过表达使Caspase-3活性降低及Bcl-2蛋白水平升高
对照组、阴性组和实验组的Caspase-3活性分别为(0.08±0.01)、(0.29±0.03)、(0.11±0.02),实验组的Caspase-3活性较阴性组降低(P<0.05)。对照组、阴性组和实验组的Bcl-2蛋白相对表达量分别是(1.10±0.02)、(1.96±0.06)、(5.86±0.04),实验组的Bcl-2蛋白表达量较阴性组显著升高(P<0.01)(图3A)。这表明,过表达STC-1可对神经元的缺氧/缺糖损伤起到保护作用。
2.5 STC-1过表达使UCP2表达量升高而减少神经元的缺氧/缺糖损伤
为了探讨STC-1对缺氧/缺糖损伤的神经细胞保护作用的机制,本实验进一步检测其下游蛋白分子UCP2的表达变化。对照组、阴性组和实验组的UCP2 mRNA表达量分别为(1.30±0.06)、(1.96±0.30)、(5.90± 0.20),实验组高于阴性组(P<0.01)。对照组、阴性组和实验组的UCP2蛋白水平表达量分别为(1.07±0.06)、(2.10±0.20)、(6.20±0.50),对照组的UCP2蛋白水平表达量较阴性组升高(P<0.01,图3B),与mRNA检测结果一致。同时,在STC-1过表达的情况下,本实验利用siRNA干扰UCP2的表达,通过MTT方法检测细胞活力。qRT-PCR结果显示,pBabe组和(pBabe-STC-1+ UCP2 siRNA)组STC-1 mRNA水平表达量分别为(1.85±0.05)、(6.05±1.20),后者显著高于前者(P<0.01);(STC-1+非特异性siRNA)组和(pBabe-STC-1+ UCP2 siRNA)组UCP21mRNA水平表达量分别为(5.95±0.50)、(2.36±0.89),(pBabe-STC-1+UCP2 siRNA)组低于(STC-1+非特异性siRNA)组,有显著性差异(P<0.01)。说明STC-1过表达成功且UCP2干扰实验成功。MTT检测结果显示,(STC-1+非特异性siRNA)组细胞活力(0.47±0.03)显著高于(pBabe-STC-1+ UCP2 siRNA)组(0.23±0.06),差异有统计学意义(P<0.05),所以下调UCP2可抑制过表达STC-1后对神经细胞的保护作用。因此推测,STC-1可能通过对UCP2的调控来起到保护神经细胞的作用。

图3 各组BCl-2(A)、UCP2(B)蛋白表达
3 讨论
神经元是构成神经系统最主要的部分,如何保护神经元免受损伤是现代医学研究一直试图解决的问题[15-17]。STC-1对多种细胞都有保护作用,尤其在缺血性损伤中。有研究表明,心肌细胞低氧可诱发STC-1表达上调,并且起到保护心肌细胞免受缺氧损伤的作用[18,19]。也有报道表明,在肺脏和肾脏中,缺血也会通过上调STC-1的表达来保护细胞[20,21]。本实验通过对大鼠胎鼠大脑皮质细胞缺氧/缺糖处理建立神经元缺血性损伤模型,检测到STC-1表达量呈上调趋势,过表达STC-1,检测细胞生长活力和LDH漏出量发现细胞生长活力增强并且LDH漏出量减少,表明STC-1对神经元的缺血性损伤有保护作用。
Caspase-3在细胞凋亡途径中起重要作用,它的启动会造成细胞凋亡[22-25]。当细胞表面死亡受体发生活化后,Caspase-3相继促使下游反应发生,使很多细胞重要的蛋白质,例如细胞骨架蛋白等,发生裂解,破坏这些蛋白质正常的生理功能,从而导致细胞凋亡,因此,Caspase-3被称为死亡蛋白酶,是哺乳动物凋亡的关键蛋白酶[26-29]。本实验中,过表达STC-1检测到缺氧/缺糖损伤的神经元中Caspase-3的活性降低,使细胞免受凋亡。另外Bcl-2也是细胞凋亡过程中的一类调节因子,它的作用与Caspase-3相反,起抑制细胞凋亡的作用。本实验中,过表达STC-1上调Bcl-2的表达,与Caspase-3的调控相反,说明缺氧/缺糖损伤的神经元凋亡过程受到抑制。
UCP2是解偶联蛋白家族之一,位于线粒体内膜,使线粒体氧化与磷酸化脱偶联,导致能量以热的形式散发,因其与氧自由基生成以及钙代谢等方面有极大的关系而备受关注[30-33]。而UCP2有减少自由基生成的功能[34-37]。有文献表明,STC-1在很多系统中通过诱导UCPs的表达抑制超氧化物生成[38]。神经元缺血会产出大量的氧自由基[6],本实验发现,过表达缺氧/缺糖损伤的神经细胞中的STC-1,可使UCP2的表达量上升,从而保护缺氧/缺糖性损伤的神经元。
目前,关于脑卒中引起的缺血性神经元损伤的研究还不是很成熟。本实验构建缺氧/缺糖损伤的神经细胞,过表达STC-1可以增强缺氧/缺糖神经元的生长活力并且降低细胞凋亡,表明STC-1对细胞具有一定的保护作用;可能通过UCP2抑制氧自由基的生成和调控凋亡相关蛋白来保护神经细胞免受缺血性损伤。综上,STC-1可作为治疗缺血性神经疾病的潜在靶标分子,其保护作用及机制有待进一步研究。
[1]Sarti C,Rastenyte D,Cepaitis Z,et al.International trends in mortality from stroke,1968 to 1994[J].Stroke,2000,31:1588-1601.
[2]Szabo SM,Levy AR,Rao SR,et al.Increased risk of cardiovascular and cerebrovascular diseases in individuals with ankylosing spondylitis:A population-based study[J].Arthritis Rheumatism,2011,63:3294-3304.
[3]Tan CE,Glantz SA.Association between smoke-free legislation and hospitalizations for cardiac,cerebrovascular,and respiratory diseases a meta-analysis[J].Circulation,2012,126:2177-2183.
[4]Chen Y,Graziano JH,Parvez F,et al.Arsenic exposure from drinking water and mortality from cardiovascular disease in Bangladesh:prospective cohort study[J].BMJ,2011,342:d2431.
[5]Banerjee C,Snelling B,Hanft S,et al.Bilateral cerebral infarction in the setting of pituitary apoplexy:a case presentation and literature review [J].Pituitary,2014,18:352-358.
[6]Sanderson TH,Reynolds CA,Kumar R,et al.Molecular mechanisms of ischemia-reperfusion injury in brain:pivotal role of the mitochondrial membranepotentialin reactiveoxygen speciesgeneration[J].Mol Neurobiol,2013,47:9-23.
[7]李荣,赵幸娟,田红梅.河南省脑卒中病情恶化2568例危险因素分析[J].神经损伤与功能重建,2015,10:289-290.
[8]Hasilo CP,McCudden CR,Gillespie JR,et al.Nuclear targeting of stanniocalcin to mammary gland alveolar cells during pregnancy and lactation[J].Am J Physiol Endocrinol Metab,2005,289:E634-642.
[9]Serlachius M,Zhang KZ,Andersson LC.Stanniocalcin in terminally differentiated mammalian cells[J].Peptides,2004,25:1657-1662.
[10]Fujiwara Y,Sugita Y,Nakamori S,et al.Assessment of Stanniocalcin-1 mRNA as a molecular marker for micrometastases of various human cancers[J].Int J Oncol,2000,16:799-804.
[11]Shirakawa M,Fujiwara Y,Sugita Y,et al.Assessment of stanniocalcin-1 as a prognostic marker in human esophageal squamous cell carcinoma [J].Oncol Rep,2012,27:940-946.
[12]Zhang KZ,Westberg JA,Paetau A,et al.High expression of stanniocalcin in differentiated brain neurons[J].Am J Pathol,1998,153:439-445.
[13]Yeung HY,Lai KP,Chan HY,et al.Hypoxia-inducible factor-1-mediated activation of stanniocalcin-1 in human cancer cells[J].Endocrinology, 2005,146:4951-4960.
[14]Koh JY,Choi DW.Quantitative determination of glutamate mediated cortical neuronal injury in cell culture by lactate dehydrogenase efflux assay[J].J Neurosci Methods,1987,20:83-90.
[15]Cho WJ,Joo SP,Kim TS,et al.Pituitary apoplexy presenting as isolated third cranial nerve palsy with ptosis:two case reports[J].J Korean Neurosurg Soc,2009,45:118-121.
[16]Wang GX,Li GR,Wang YD,et al.Characterization of neuronal cell death in normal and diabetic rats following exprimental focal cerebral ischemia[J].Life Sci,2001,69:2801-2810.
[17]杨清平,陈海光,李学兰.护理干预对脑卒中后抑郁病人神经功能康复的影响[J].护理学杂志,2004,19:62-63.
[18]Westberg JA,Serlachius M,Lankila P,et al.Hypoxic preconditioning induces elevated expression of stanniocalcin-1 in the heart[J].Am J Physiol Heart Circ Physiol,2007,293:H1766-1771.
[19]Al-Shudiefat AA,Sharma AK,Bagchi AK,et al.Oleic acid mitigates TNF-alpha-induced oxidative stress in rat cardiomyocytes[J].Mol Cell Biochem,2013,372:75-82.
[20]Block GJ,Ohkouchi S,Fung F,et al.Multipotent stromal cells are activated to reduce apoptosis in part by upregulation and secretion of stanniocalcin-1[J].Stem Cells,2009,27:670-681.
[21]Shi X,Wang J,Qin Y.Recombinant adeno-associated virus-delivered hypoxia-inducible Stanniocalcin-1 expression effectively inhibits hypoxiainduced cell apoptosis in cardiomyocytes[J].J Cardiovasc Pharmacol, 2014,64:522-529.
[22]Brentnall M,Rodriguez-Menocal L,De Guevara RL,et al.Caspase-9,caspase-3 and caspase-7 have distinct roles during intrinsic apoptosis[J]. BMC Cell Biol,2013,14:32-32.
[23]Fang J,Song XW,Tian J,et al.Overexpression of microRNA-378 attenuates ischemia-induced apoptosis by inhibiting caspase-3 expression in cardiac myocytes[J].Apoptosis,2012,17:410-423.
[24]Kang JW,Kim JH,Song K,et al.Kaempferol and quercetin,components of Ginkgo biloba extract(EGb 761),induce caspase-3-dependent apoptosis in oral cavity cancer cells[J].Phytother Res,2010,24:S77-S82.
[25]D'amelio M,Cavallucci V,Cecconi F.Neuronal caspase-3 signaling: not only cell death[J].Cell Death Differ,2010,17:1104-1114.
[26]Kaufmann T,Strasser A,Jost PJ.Fas death receptor signalling:roles of Bid and XIAP[J].Cell Death Differ,2012,19:42-50.
[27]Snigdha S,Smith ED,Prieto GA,et al.Caspase-3 activation as a bifurcation point between plasticity and cell death[J].Neurosci Bull,2012, 28:14-24.
[28]Ye Y,Li Z,Xing D.Nitric oxide promotes MPK6-mediated caspase-3-like activation in cadmium‐induced Arabidopsis thaliana programmed cell death[J].Plant Cell Environ,2013,36:1-15.
[29]D’Amelio M,Sheng M,Cecconi F.Caspase-3 in the central nervous system:beyond apoptosis[J].Trends Neurosci,2012,35:700-709.
[30]Diano S,Horvath TL.Mitochondrial uncoupling protein 2(UCP2)in glucose and lipid metabolism[J].Trends Mol Med,2012,18:52-58.
[31]Toda C,Diano S.Mitochondrial UCP2 in the central regulation of metabolism[J].Best Pract Res Clin Endocrinol Metab,2014,28:757-764.
[32]Sparks LM,Xie H,Koza RA,et al.A high-fat diet coordinately downregulates genes required for mitochondrial oxidative phosphorylation in skeletal muscle[J].Diabetes,2005,54:1926-1933.
[33]Allister EM,Robson-Doucette CA,Prentice KJ,et al.UCP2 regulates the glucagon response to fasting and starvation[J].Diabetes,2013,62: 1623-1633.
[34]Sheikh-Hamad D.Mammalian stanniocalcin-1 activates mitochondrial antioxidant pathways:new paradigms for regulation of macrophages and endothelium[J].Am J Physiol Renal Physiol,2010,298:F248-254.
[35]Souza BMd,Assmann TS,Kliemann LM,et al.The role of uncoupling protein 2(UCP2)on the development of type 2 diabetes mellitus and its chronic complications[J].Arq Bras Endocrinol Metabol,2011,55:239-248.
[36]Tian XY,Wong WT,Xu A,et al.Uncoupling protein-2 protects endothelial function in diet-induced obese mice[J].Circ Res,2012,110:1211-1216.
[37]Salminen A,Kaarniranta K,Kauppinen A.Crosstalk between oxidative stress and SIRT1:impact on the aging process[J].Int J Mol Sci,2013, 14:3834-3859.
[38]Huang L,Belousova T,Chen M,et al.Overexpression of stanniocalcin-1 inhibits reactive oxygen species and renal ischemia/reperfusion injury in mice[J].Kidney Int,2012,82:867-877.
(本文编辑:王晶)
Protective Effect of Stanniocalcin-1 on Neuron of Rats after Ischemic Injury
ZHAO Bei1a,YAO Jie2,GUO Sheng-long1b.1.a.Department of Medical Insurance,b.Department of Neurology,Shaanxi Provincial People’s Hospital,Xi’an 710068,China;2.Department of Neurology,The Second Affiliated Hospital of Xi’an Jiao Tong University,Xi’an 710004,China
Objective:To investigate the protective effect of Stanniocalcin-1(STC-1)on neurons after ischemic injury.Methods:The neurons were isolated from rat cortex and cultured.The cultured neurons were then subjected to anoxic and glucose-deprived injury.The retroviral of STC-1 overexpression was constructed and transfected into the neurons,which were also transfected with uncoupling protein 2(UCP2)siRNA to inhibit the UCP2 expression.The relative mRNA and protein expression levels of STC-1 and UCP2 were detected by qRTPCR and Western Blotting.The amount of LDH leakage was determined by LDH method,and cell growth and viability was determined by MTT method.The activity of Caspase-3 was detected.Results:The model of nerve cells with anoxic and OGD was constructed successfully.The up-regulation of STC-1 was verified,the amount of LDH leakage(P<0.01)and Caspase-3 activity were significantly reduced(P<0.05)whereas cell growth activity (P<0.05)and the protein expression of Bcl-2 were significantly increased with STC-1 overexpression(P<0.01). Moreover,the expression of UCP2,a downstream gene of STC-1,was also increased by STC-1 overexpression (P<0.01).The cell growth activity was obviously reduced with STC-1 overexpression and UCP2 inhibition(P<0.05).Conclusion:STC-1 may protect neurons against ischemic injury through regulating UCP2.
R741;R743.3
A DOI 10.16780/j.cnki.sjssgncj.2016.04.001
1.陕西省人民医院a.医保办 b.神经内科西安 710068
2.西安交通大学医学院第二附属医院神经内科西安 710004
2015-08-31
郭生龙huiqingguohn@163. com
