双断根嫁接对甜瓜幼苗低温适应性的影响
2016-05-14黄远张朝霞程菲孔秋生别之龙
黄远 张朝霞 程菲 孔秋生 别之龙
甜瓜是一种重要的园艺作物,中国是甜瓜生产和消费第一大国。多数学者认为甜瓜起源于亚洲和非洲的热带地区,遗传特性决定了甜瓜喜温不耐寒的特点,苗期是甜瓜对温度最敏感、对产量影响最大的时期之一。甜瓜早春设施栽培中经常面临低温逆境,因此,提高甜瓜幼苗对低温的适应性、减轻冷害的影响是甜瓜设施栽培中亟待解决的突出问题。
嫁接是甜瓜生产中广泛使用的一种栽培技术,能显著提高植株对土传病害和各种非生物胁迫的抗性。目前,甜瓜嫁接生产中使用最广泛的是插接法和双断根嫁接法,双断根嫁接是在插接的基础上去掉砧木老根系,在嫁接愈合的同时诱导砧木产生新根系的嫁接方法[1]。研究表明,不同的嫁接方法对黄瓜幼苗的耐低温性有显著影响,双断根嫁接苗较插接苗的低温适应性更强[2]。然而,目前在甜瓜上尚无相关的研究。通过比较甜瓜插接和双断根嫁接苗对低温处理的响应,探讨双断根嫁接对甜瓜幼苗低温适应性的影响和生理机制,以期为甜瓜双断根嫁接育苗技术在早春设施栽培中的推广应用提供科学依据。
1 材料与方法
1.1 试验时间和地点
材料培养、生长和生理参数的测定于2011年10月到2012年3月在园艺植物生物学教育部重点实验室进行。
1.2 试验材料
以甜瓜品种伊丽莎白239(Cucumis melo L.)、南瓜砧木品种小拳王(Cucurbita maxima × Cucurbita moschata)为材料,分别由国家蔬菜工程技术研究中心和河北唐山恒丰种业有限公司提供。
1.3 嫁接及低温处理
砧木和接穗种子经55℃温汤浸种后于30℃恒温催芽,发芽后分别播种于50孔和72孔穴盘中。2011年10月1日伊丽莎白239甜瓜自嫁砧木种子播种,10月6日小拳王南瓜砧木种子播种,10月10日播种伊丽莎白239甜瓜接穗苗,10月14日进行嫁接。采用插接(仅去掉接穗的根系)和双断根嫁接(接穗和砧木的根系均去掉)2种方法进行嫁接,共得到4种嫁接材料(接穗/砧木),分别为E/E(伊丽莎白/伊丽莎白)插接苗;E/E(伊丽莎白/伊丽莎白)双断根嫁接苗;E/X(伊丽莎白/小拳王)插接苗;E/X(伊丽莎白/小拳王)双断根嫁接苗。11月17日待幼苗3叶1心时,将其移入人工气候箱(P1500GS-B型,武汉瑞华仪器设备有限责任公司)中,在昼夜温25℃/20℃、光周期12 h、湿度75%条件下适应2 d后,分别进行常温(25℃/20℃)和低温(10℃/5℃)处理,每个处理设置3个重复,每重复36株。低温处理后每天统计嫁接苗的冷害指数,共统计7次。低温处理7 d后,测定嫁接苗的形态和生理参数。
1.4 测定方法
①冷害指数 参照Semeniuk[3]的标准对幼苗进行分级,0级:生长正常,未受冷害;1级:仅少数叶片边缘有轻度的皱缩萎蔫;2级:半数以下的叶片萎蔫死亡;3级:半数以上的叶片萎蔫死亡;4级:植株全部死亡。冷害指数=(1×S1+2×S2+3×S3+4×S4+0×S0)/(低温处理总株数×4),式中S为相应冷害级的苗数。
②植株生长 每处理取18株苗(每重复6株),用去离子水将植株根部和叶片清洗干净。用米尺测定株高,游标卡尺测量嫁接部位以上1 cm处茎粗,剪下叶片测定叶面积(LI-3100C)。将植株从嫁接部位切断,分成地上部和根系两部分,分别装袋并放入烘箱以105℃杀青15 min,70℃烘干至恒质量,用电子分析天平分别测定地上部及根系干质量。
③生理参数 参考李合生[4]的方法,根系活力采用TTC染色法测定,叶绿素(a+b)含量采用乙醇提取后进行测定。丙二醛(MDA)含量的测定采用硫代巴比妥酸法进行[5]。超氧化物歧化酶(SOD)活性的测定参照Meloni等[6]的方法。采用原子吸收分光光度计法(Varian spectra AA 220)测定叶片Mn、Cu和Zn的含量。其中,叶片Mn、Cu和Zn含量测定的是干样中的含量,其余含量测定的是鲜样中的含量。
1.5 数据处理
试验数据采用Excel 2003 软件进行作图和分析,SAS 8.0软件进行显著性分析(P<0.05)。
2 结果与分析
2.1 冷害指数和生长
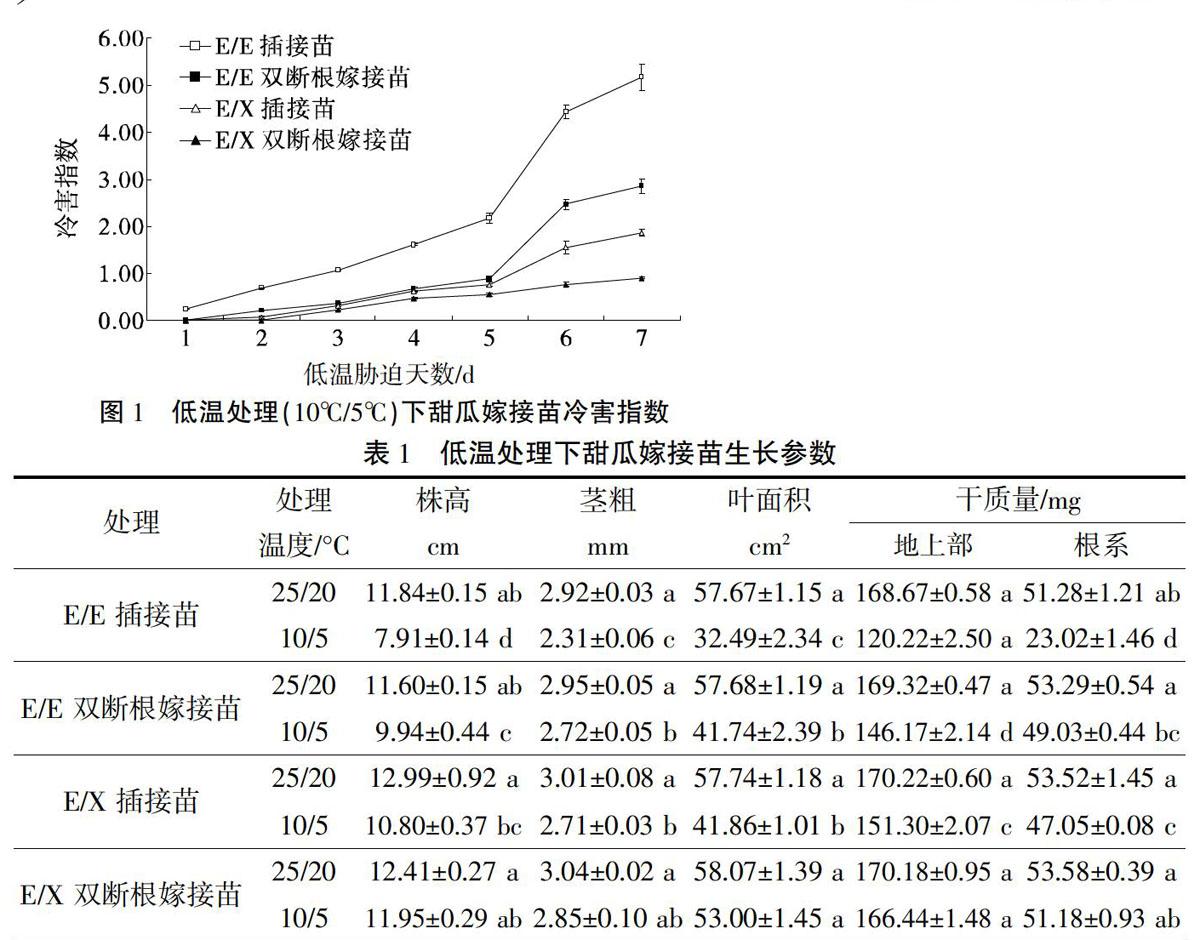
如图1所示,随着低温处理时间延长,甜瓜不同嫁接苗的冷害症状加剧,低温处理第7天时,E/E插接苗叶片冷害症状最严重。与E/E插接苗比较,E/E双断根嫁接苗明显缓解了低温对甜瓜的伤害。E/X双断根嫁接苗冷害指数明显低于E/X插接苗。除E/X双断根嫁接苗外,与正常温度(25℃/20℃)比较,低温(10℃/5℃)处理显著降低了甜瓜嫁接苗的株高、茎粗、叶面积、地上部和根系干质量。不同嫁接方法相比,双断根嫁接法嫁接的甜瓜幼苗的生长受低温抑制程度小于插接法嫁接的甜瓜幼苗(表1)。
2.2 叶绿素含量和根系活力
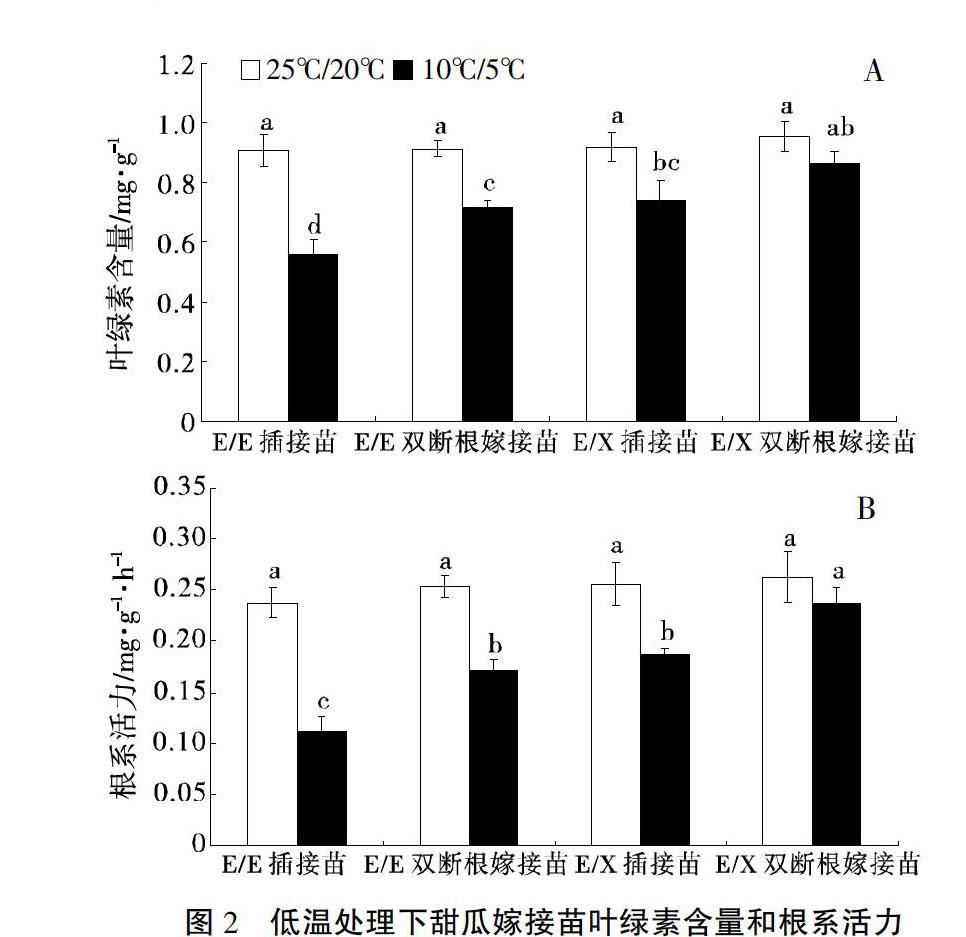
如图2所示,除E/X双断根嫁接苗外,与正常温度处理(25℃/20℃)比较,低温(10℃/5℃)处理显著降低甜瓜嫁接苗的叶绿素含量和根系活力,E/E插接苗叶绿素含量和根系活力下降幅度最大,达到38.50%和52.85%。不同嫁接方法相比,嫁接组合中双断根嫁接法嫁接的甜瓜幼苗的叶绿素含量和根系活力高于插接法嫁接的甜瓜幼苗。
2.3 SOD活性和MDA含量
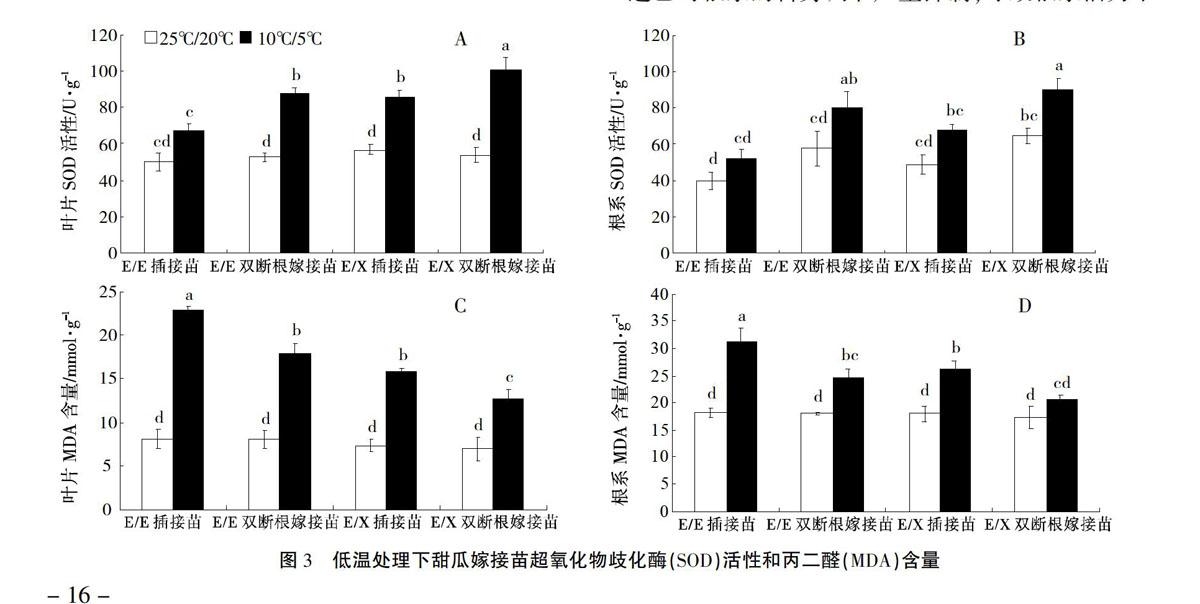
正常温度(25℃/20℃)处理下,甜瓜不同嫁接苗叶片中SOD活性无显著差异,低温(10℃/5℃)处理下除E/E插接苗叶片中SOD活性增加幅度较小外,其他嫁接苗叶片SOD活性显著增加(图3)。E/X双断根嫁接苗叶片中SOD活性上升幅度显著大于 E/E双断根嫁接苗和E/X插接苗,不同嫁接方法相比,双断根嫁接苗叶片中SOD活性显著高于插接苗。正常温度下,双断根嫁接苗根系中SOD活性高于插接苗,但无显著性差异。低温处理后,双断根嫁接苗根系中SOD活性显著上升,而插接苗根系中SOD活性上升幅度较小,与正常温度处理比较差异不显著。除E/X双断根嫁接苗根系外,与正常温度相比,低温处理显著增加了叶片和根系中MDA的含量。不同嫁接方法的甜瓜幼苗相比,双断根嫁接苗叶片中MDA的含量增加幅度明显低于插接苗。
2.4 叶片Cu、Zn、Mn含量
正常温度(25℃/20℃)处理下,甜瓜不同嫁接苗叶片中Cu、Zn含量差异不显著,双断根嫁接法嫁接的甜瓜幼苗叶片Mn含量显著高于以插接法嫁接的甜瓜幼苗(表2)。低温处理下(10℃/5℃),甜瓜不同嫁接苗Cu、Zn、Mn含量呈下降趋势,双断根嫁接法嫁接的甜瓜幼苗叶片Cu、Mn含量显著高于插接法嫁接的甜瓜幼苗,Zn含量无显著差异。
3 讨论与结论
本研究结果表明,与甜瓜自嫁苗比较,砧木嫁接显著增加了甜瓜的耐低温性,与前人研究类似[7~9]。本研究从冷害指数和植株生长参数方面证明双断根嫁接显著增加甜瓜的低温适应性,与韩晓燕等[2]在黄瓜上的研究结果一致,其研究发现与常温处理相比,低温胁迫下津春2号自根苗和黑籽南瓜嫁接苗均受到不同程度伤害,但低温胁迫下嫁接苗受到的伤害显著低于自根苗,其中断根嫁接苗表现最好。
叶绿素是植物进行光合作用的重要物质,其含量的高低在某种程度上与光合作用效能高低相关,因此,可以用植物体内叶绿素含量变化反映其生长状态。本研究中,低温胁迫显著降低了甜瓜叶绿素含量,表明植物的光合作用受到了不良影响,这与吕星光等[8]的研究结果类似。低温下甜瓜叶片的叶绿素含量降低可能与叶绿素降解加剧而合成能力降低有关。植物根系是活跃的吸收器官和合成器官,根系活力直接影响地上部的营养状况,且与植物抗逆性有密切关系[7]。低温胁迫后甜瓜嫁接苗的根系活力显著低于正常温度条件下的,说明低温胁迫已对根系的自身调节产生抑制,导致根系活力下降。双断根嫁接甜瓜幼苗较强的耐低温适应性与其具有较高的叶绿素含量和根系活力有关。
低温等逆境条件下,植物细胞中活性氧产生及清除的平衡被破坏,自由基积累导致细胞膜系统首先遭受伤害,造成膜脂过氧化,膜结构被破坏[10]。MDA是膜脂过氧化分解的主要产物,常用来表示细胞膜脂过氧化程度,同时反映植物遭受逆境胁迫的程度大小[7]。植物本身对活性氧的伤害有精细而复杂的防御体系,即内源性保护酶促清除系统,以保护细胞的正常功能。SOD是植物在逆境胁迫下清除体内活性氧的关键酶,其活性与植物的抗逆性有重要的关系[11]。试验发现,低温处理下双断根嫁接法嫁接的甜瓜幼苗叶片中SOD活性显著高于插接法嫁接的甜瓜幼苗,双断根嫁接进一步减少了低温对甜瓜幼苗细胞造成的氧化伤害和膜脂过氧化物质MDA的积累,提高甜瓜幼苗的耐低温性。Cu和Mn是SOD同工酶的辅基,植物体内Cu和Mn浓度增加可增强SOD活性[12]。本研究中双断根嫁接法嫁接的甜瓜幼苗叶片中Cu和Mn含量高于插接法嫁接的甜瓜幼苗。因此,低温胁迫下双断根嫁接甜瓜幼苗较强的SOD活性与其较高的Cu和Mn含量有关。
综上所述,低温处理显著抑制了甜瓜苗的生长,降低了植株的根系活力,影响了根系对Cu、Zn和Mn的吸收,叶绿素含量下降,氧化伤害加剧。然而,低温处理下双断根嫁接能显著增加甜瓜叶绿素含量,提高根系对Cu和Mn的吸收,增强抗氧化酶SOD活性和根系活力,从而提高甜瓜对低温的适应性。双断根嫁接操作方便、嫁接速度快,因此是甜瓜早春设施栽培中值得推广的一种嫁接育苗方法。
参考文献
[1] 许勇,宫国义,刘国栋,等.西瓜嫁接新技术——双断根嫁接法[J].中国西瓜甜瓜,2002(4):33-34.
[2] 韩晓燕,别之龙.不同温度处理对嫁接黄瓜幼苗生理特性的影响[J].农业工程学报,2008,24(增刊2):219-224.
[3] Semeniuk P, Moline H E, Abbott J A. A comparison of the effects of ABA and an antitranspirant on chilling injury of coleus, cucumbers, and dieffenbachia[J]. J Am Soc Hortic Sci, 1986, 111: 866-868.
[4] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[5] Sudhakar C, Lakshmi A, Giridarakumar S. Changes in the antioxidant enzyme efficacy in two high yielding genotypes of mulberry (Morus alba L.) under NaCl salinity [J]. Plant Sci, 2001, 161: 613-619.
[6] Meloni D A, Oliva M A, Martinez C A, et al. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress [J]. Environ Exp Bot, 2003, 49: 69-76.
[7] 吕星光,周梦迪,李敏.低温胁迫对甜瓜嫁接苗和自根苗生长及生理特性的影响[J].中国蔬菜,2016(5):53-57.
[8] 吕星光,周梦迪,李敏.低温胁迫对甜瓜嫁接苗及自根苗光合及叶绿素荧光特性的影响[J].植物生理学报,2016,52 (3):334-342.
[9] 董玉梅,焦自高,王崇启,等.低温弱光胁迫对网纹甜瓜嫁接苗与自根苗某些物质含量的影响[J].山东农业大学学报:自然科学版,2005,36(1):67-69.
[10] Suzuki N, Koussevitzky S, Mittler R O N, et al. ROS and redox signalling in the response of plants to abiotic stress [J]. Plant Cell Environ, 2012, 35(2): 259-270.
[11] Alscher R G, Erturk N, Health L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants [J]. J Exp Bot, 2002, 53: 1 331-1 341.
[12] 李涛,于贤昌.Cu2+,Zn2+和Mn2+对冷胁迫下嫁接黄瓜幼苗叶片提取液SOD活性的影响[J].园艺学报,2007,34(4):895-900.
