巴西橡胶树HbEPSPS基因逆境响应功能解析
2016-05-14张宇潘敏李晓娜王萌杨叶朱朝华郑服丛
张宇 潘敏 李晓娜 王萌 杨叶 朱朝华 郑服丛


摘 要 草甘膦除草剂的靶标酶为5-烯醇式丙酮莽草酸-3-磷酸合成酶(EPSPS)。为研究HbEPSPS基因在橡胶树中的逆境响应功能,分析其在草甘膦、机械伤害、白粉菌侵染和不同激素处理下的表达模式。结果表明:草甘膦、机械伤害和IAA处理诱导HbEPSPS显著上调;干旱、ABA、SA和ETH处理亦能诱导HbEPSPS显著上调;H2O2处理橡胶树叶片中HbEPSPS表达呈现双峰规律;白粉菌侵染叶片,HbEPSPS表达显著下调。不同部位表达分析结果表明,HbEPSPS基因在花中表达量最高,其次是树皮和叶,在胶乳中表达量最低。此结果表明,HbEPSPS基因在橡胶树草甘膦药害和激素信号响应中具有重要作用,为研究其在橡胶树抗逆机制中的作用奠定良好基础。
关键词 巴西橡胶树 ;草甘膦 ;HbEPSPS ;表达分析
中图分类号 S794.1 文献标识码 A Doi:10.12008/j.issn.1009-2196.2016.09.008
Abstract The target enzyme of herbicide Glyphosate is 5-enolpyruvylshikimate-3-phosphatesynthase (EPSPS). In order to study the function of HbEPSPS in stress response of rubber tree, we analyzed HbEPSPS expression patterns in rubber tree treated with glyphosate, mechanical wounding, powdery mildew infection and different hormones. Results show that glyphosate, mechanical wounding and IAA treatment induced significant upregulation of HbEPSPS; drought, ABA, SA and ETH treatment also upregulated HbEPSPS expression obviously. In rubber tree leaves treated with H2O2, HbEPSPS expression showed a bimodal pattern. Rubber tree leaves infected with powdery mildew had a significant downregulation of HbEPSPS expression. Expression analysis in different parts of rubber tree showed that HbEPSPS was most highly expressed in flower, followed by the bark and leaves, the lowest in latex. This study indicates that HbEPSPS plays an important role in the response to glyphosate phytotoxicity and hormone signal, which lay a good foundation for further study of the stress resistance mechanism in rubber tree.
Keywords Hevea brasiliensis ; glyphosate ; HbEPSPS ; expression analysis
5-烯醇式丙酮酸-3-磷酸莽草酸合成酶(5-enolpyruvylshikimate-3-phosphatesynthase, EPSPS)催化莽草酸-3-磷酸(S3P)和磷酸烯醇式丙酮酸(PEP)生成烯醇式丙酮酸-3-磷酸莽草酸(EPSP)[1]。草甘膦(Glyphosate)除草剂抑制EPSPS的活性,从而阻断芳香族氨基酸的生物合成,影响植物体内蛋白质、生长素等的前体、黄酮、质体醌及酚类和生物碱的次生代谢途径[2]。目前,已在拟南芥[3]、烟草[4]、棉花[5]、油菜[6]及大豆[7]等物种中克隆了EPSPS基因,并做了相关的基因功能研究。已有研究结果表明,在草甘膦胁迫下植物通过提高部分EPSPS基因的表达量来降低药害[8]。EPSPS基因在植物不同组织和不同激素处理下表达有显著差异[9-10]。在外界胁迫条件下,植物抗逆性相关物质如黄酮、木质素和生物碱等在植株中大量积累[11]。但目前关于橡胶树EPSPS基因在不同环境胁迫方面研究较少。
橡胶树是中国的经济作物之一,其在生长过程中容易受到外界环境的影响,如在干旱时发生病虫害,降低胶乳产量,甚至导致其死亡[12];白粉病侵染使橡胶树叶片脱落,生长受抑制[13];外源茉莉酸(JA)能够诱导乳管分化和乳汁的生物合成[14-15];乙烯利刺激橡胶树增产[16]。笔者已经证明,草甘膦诱导橡胶树叶片畸形[17]。本研究以橡胶树品种CATAS7-33-97为材料,采用qPCR方法分析已克隆巴西橡胶树EPSPS基因(登录号:JQ914660.1)在不同组织、不同激素处理、干旱、伤害和白粉菌处理条件下的表达情况,为进一步解析橡胶树HbEPSPS基因结构和草甘膦抗性等逆境响应机理提供理论依据。
1 材料与方法
1.1 材料
以中国热带农业科学院橡胶研究所培育的巴西橡胶树(Hevea brasiliensis Muell. Arg.)品种热研7-33-97芽接苗、成龄开割树和GT1种子的实生苗为材料,芽接苗和实生苗种植于海南大学环境与植物保护学院(儋州校区)实验基地(草炭土与粘土体积比为3∶1的育苗袋中)。
1.2 方法
1.2.1 RNA提取和cDNA合成
根据天根多糖多酚植物总RNA试剂盒说明书提取各处理样品的RNA,分别用超微量核酸蛋白分析仪检测RNA浓度、纯度和1%甲醛变性胶电泳检测RNA的完整性,再用Thermo Scientific RevertAid First Strand cDNA Synthesis Kit试剂盒进行反转录[18]。
1.2.2 HbEPSPS基因的表达分析
(1)选取均匀一致且稳定期的芽接苗,采用有效成分含量为41%的草甘膦异丙胺盐水剂稀释2 400倍处理,分别采集未喷药前叶片、喷药前半黄半绿叶片、小于7 cm畸形叶、大于7 cm畸形叶和新生的恢复叶。
(2)干旱处理采用CATAS7-33-97芽接苗为材料,断水10 d,分别采取叶子样品,对照保持水分[19]。
(3)机械伤害采用镊子夹伤叶片,在0、0.5、1、2、6和12 h采取叶片样品,以未处理的植株作为对照。
(4)激素处理采用CATAS7-33-97芽接苗为材料,分别是200 μmol/L脱落酸(ABA)、100 μmol/L吲哚乙酸(IAA)、3 mmol/L赤霉素(GA3)、5 mmol/L水杨酸(SA)、1.0%乙烯利(ETH)、200 mmol/L茉莉酸(JA)和2%过氧化氢(H2O2),分别在0、0.5、2、6、10、24、48和72 h采取叶片样品,所有药剂用0.05%乙醇进行溶解,对照植株喷施0.05%乙醇水溶液[20]。
(5)白粉菌处理以巴西橡胶树GT1种子的实生苗为材料,进行白粉菌侵染,然后分别采集0、1、3、5和7级叶片;同时采集15年生的成龄开割树CATAS7-33-97的叶片、胶乳、花和树皮样品[21]。
以HbACTIN为内参基因,设计荧光定量引物NEPSPSF(5'-GAGTCACCATAGAACACAGT-3')和HbEPSPS(5'-CCAGCGTCATAGCAACAT-3'),分析HbEPSPS基因的表达量。
1.2.3 统计分析
实验测定为3次重复,采用SAS9.1.3软件对数据进行单因素方差分析和多重比较分析,采用Excel 2013软件进行数据处理,使用origin 2015软件进行作图。
2 结果与分析
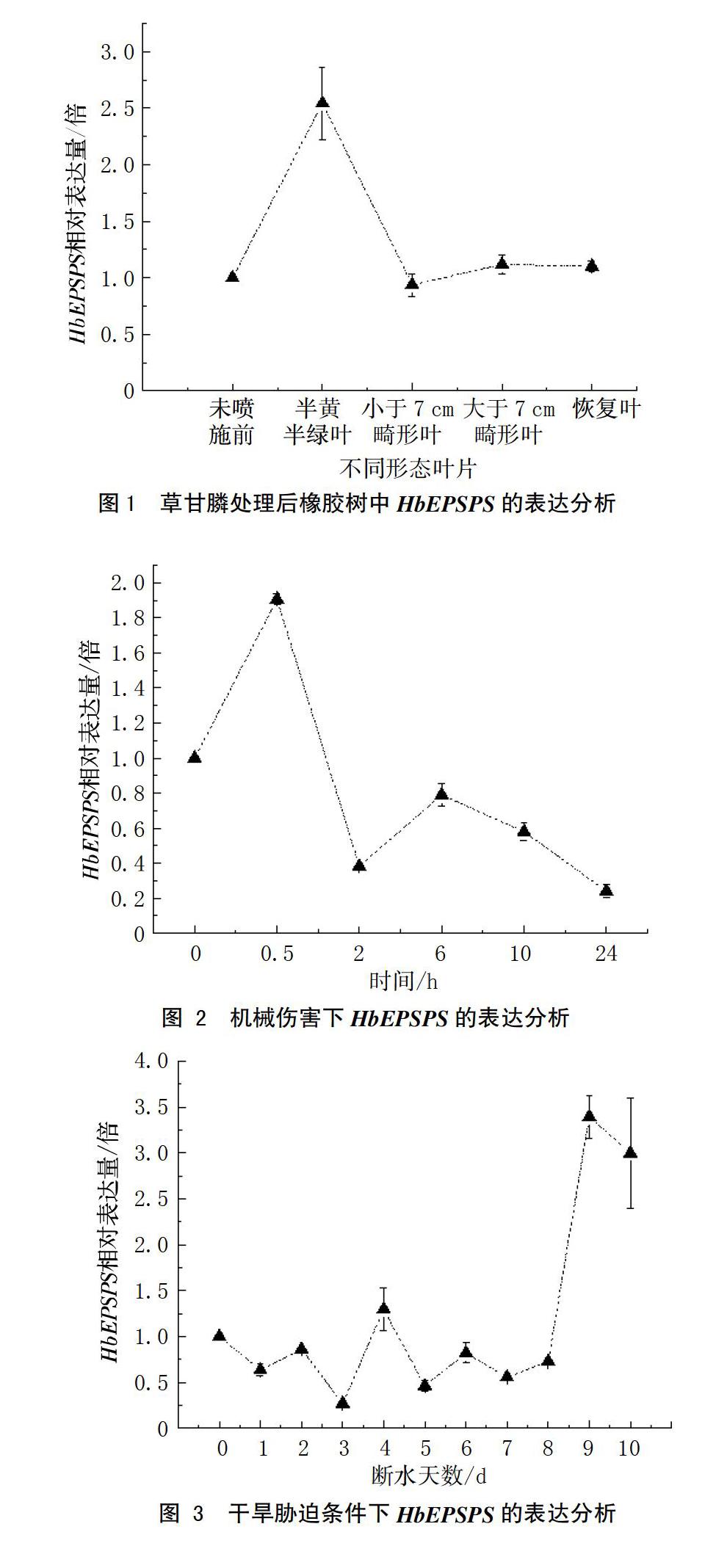
2.1 草甘膦处理后橡胶树中HbEPSPS的表达分析
从图1可知,草甘膦处理橡胶树芽接苗后,叶片呈现半黄半绿、畸形叶片等表型,叶片处于半黄半绿时,HbEPSPS的表达量显著提高,是对照的2.5倍,而畸形叶、恢复叶与对照无显著差异。
2.2 机械伤害下HbEPSPS的表达分析
由图2可以看出,机械伤害处理0.5 h时,HbEPSPS基因的表达量达到最高峰,是对照的1.8倍。随着处理时间的延长,该基因的表达量显著下调,至处理12 h时表达量达到最低点。说明HbEPSPS基因可能参与了橡胶树机械伤害的早期胁迫响应机制。
2.3 干旱胁迫条件下HbEPSPS的表达分析
由图3可知,干旱处理橡胶树芽接苗9 d时,HbEPSPS基因的表达量显著上调并达到最高值,是处理前的3.4倍,随后表达量有所下降,但变化不显著。从图3中不断变化的HbEPSPS基因表达情况可看出,该基因参与橡胶树干旱胁迫响应过程。
2.4 白粉菌侵染下HbEPSPS的表达分析
由图4可以看出,相对于未处理时,橡胶树叶片中HbEPSPS基因的表达水平在白粉菌侵染作用下显著下调。随着病害程度的加重,HbEPSPS基因的表达量先显著上升,再显著下降,最后又显著上升,但表达量始终低于处理前。
2.5 不同组织中HbEPSPS的表达分析
从图5可以看出,HbEPSPS基因在所有组织中显著表达,其中在花中表达量最高,是胶乳的4倍,其次是树皮和叶,在胶乳中表达量最低。
2.6 不同激素和H2O2处理下HbEPSPS的表达分析
由图6可以看出,ABA处理橡胶树叶片后,HbEPSPS基因的表达量在处理的48 h内呈现上升趋势,在处理后48 h达最高值,相当于对照的2.4倍。在SA处理作用下,HbEPSPS基因表达量持续上升,在处理后72 h达最高峰,是对照的2.5倍。ETH处理后24 h内,HbEPSPS基因的表达量较对照显著下调,48 h时其表达量显著上调,达到最大值,是对照的2.5倍。JA处理下,HbEPSPS基因表达量差异显著,在0.5 h时表达量达最高,随后该基因的表达量显著下降,至24 h达到最低值。IAA处理橡胶树叶片后,HbEPSPS基因表达量在处理后2 h达最高值,是对照的25倍,随后显著下降,随着时间的延长,该基因的表达量无显著性变化。在H2O2处理的橡胶树叶片中,HbEPSPS基因表达量在0.5 h 显著上调,但随后便显著下降。在处理后10 h再次显著上升,达到表达最高值,是对照的15倍。由此可知,ABA、SA、ETH、JA和IAA均能诱导橡胶树叶片中HbEPSPS基因的表达量发生变化。推测橡胶树HbEPSPS基因可能参与橡胶树不同的激素信号传导途径。
3 讨论与结论
目前,关于EPSPS基因的研究大部分集中在草本植物抗除草剂机制的领域[3-7]。有研究者发现,在草甘膦胁迫下,植物为适应正常芳香族氨基酸的合成,EPSPS基因的表达量会增加,并通过此原理获得了抗草甘膦细胞株[22]。在橡胶树中,HbEPSPS基因在草甘膦处理后叶片处于半黄半绿时表达量显著升高,其他不同叶片状态下表达量较对照无差异,与草甘膦促使银杏中EPSPS基因表达量的升高一致[10]。
激素和各种环境胁迫能够诱导EPSPS基因的表达量升高,如在矮牵牛中,紫外光、低温和激素均能使诱导EPSPS表达的转录因子ZPT2-2在花器官中表达量升高[23-24]。还有研究结果表明,外界的环境压力能够在莽草酸途径下合成黄酮类等前体物质[25]。本研究中,机械伤害和IAA处理前期能诱导HbEPSPS基因表达在橡胶树上显著上调;在干旱、ABA、SA和ETH处理后期能诱导HbEPSPS基因表达显著上调;H2O2处理时,HbEPSPS基因表达量既在处理前期又在处理后期显著表达;白粉菌侵染橡胶树叶片下,HbEPSPS基因表达量较对照显著下调。因此,橡胶树叶片中HbEPSPS基因在环境压力下表达量受影响可能与芳香族氨基酸途径有关,说明HbEPSPS基因能够迅速应答外界环境胁迫,起到调控作用。
HbEPSPS基因在橡胶树花中表达量最高,其次是树皮和叶,在胶乳中表达量最低,这一结果与矮牵牛中EPSPS基因在花瓣中的表达量最高一致[26-27]。但在木本植物喜树中,EPSPS基因在叶中表达量最高,与本实验结果不一致[28]。出现这种表达差异的原因可能是由于EPSP基因在不同的组织中发生转录的起始位点不同。
因此,了解HbEPSPS基因的结构及逆境响应机制,将为橡胶树抗除草剂、抗逆机理及橡胶树抗性品种培育提供理论依据。
参考文献
[1] Herrmann K M, Weaver l M. The shikimate pathway[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50(1): 473-503.
[2] Amerhein N, Deus B, Gehrke P, et al. The siteof the inhibition of the shikimate pathway by glypho-sate:II. Interference of glyphosate with chorismate formation in vivo and in vitro[J]. Plant Physiology, 1980, 66(5):830-834.
[3] Klee H, Muskopf Y G. Cloning of an Arabidopsis thaliana gene encoding 5-enolpyruvylshikimate-3-phosphate synthase:Se-quence analysis and manipulation to obtain glyphosate-tolerant plants[J]. Molecular and General Genetics, 1987, 210(3):437-442.
[4] Wang Y, Jones J, Weller S, et al. Expression and stability of amplified genes encoding 5-enolpyruvylshikimate-3-phosphate synthase in glyphosate-tolerant tobacco cells[J]. Plant Molecular Biology, 1991, 17(6): 1 127-1 138.
[5] 章郑专,汤磊鹏,王 钰,等. 抗草甘膦基因aroA转化陆地棉胚性愈伤组织的研究[J]. 棉花学报,2014,26(3):237-243.
[6] 芦宝琳. 抗草甘膦基因甜菜遗传转化的研究[D]. 哈尔滨:黑龙江大学,2012.
[7] 高 越,刘 辉,陶 波. 抗草甘膦野生大豆筛选及其抗性生理机制研究[J]. 大豆科学,2013,32(1):76-79.
[8] 刘东军,张 锐,郭三堆,等. 棉花品系Y18对草甘瞵应激反应机理的研究[J]. 中国生物工程杂志,2008,28(10):55-59.
[9] 童旭宏,吴玉香,祝水金. 陆地棉EPSPS基因的克隆及其组织特异性表达分析[J]. 棉花学报,2009,21(4):259-264.
[10] 程 华,李琳玲,王 燕,等. 银杏EPSPS基因克隆及表达分析[J]. 西北植物学报,2010,30(12):2 365-2 372.
[11] Hermann K M. The shikimate pathway: early steps in the biosynthesis of aromatic compounds[J]. Plant Cell, 1995, 7(3):907-919.
[12] 王立丰,王纪坤,安 锋,等. 巴西橡胶树HbCytb561的克隆及表达分析[J]. 热带作物学报,2015,36(11):1 965-1 970.
[13] 刘 静. 橡胶树白粉病的研究进展[J]. 热带农业科技,2010,33(3):1-5.
[14] Rizhong Z, Cuifang D, Xiaoyuan L, et al. Vacuolar-type inorganic pyrophosphatase located on the rubber particlein the latex is an essential enzyme in regulation of the rubberbiosynthesis in Hevea brasiliensis[J]. Plant Science, 2009, 176(5): 602-607.
[15] Tian C L, Ye F, Wang L, et al. Nitric oxide inhibits ghrelin-induced cell proliferationand ERK1/2 activation in JAR1 cells[J]. Endocrine, 2010, 38(3): 412-416.
[16] 庄海燕,安 锋,张硕新,等. 乙烯利刺激橡胶树增产机制研究进展[J]. 林业科学,2010,46(4):120-125.
[17] 潘 敏,王 萌,李晓娜,等. 草甘膦对巴西橡胶树芽接苗叶片形态和生理指标的影响[J]. 热带作物学报,2016,37(1):59-64.
[18] 覃 碧,王 萌,林雨见,等. 巴西橡胶树HbMlo9基因克隆及其序列特征分析[J]. 热带农业科学,2013,33(8): 47-52.
[19] Wang L F. Physiological and molecular responses to drought stress in rubber tree(Hevea brasiliensis Muell. Arg.)[J]. Plant Physiol Biochem, 2014, 83(2):243-249.
[20] Qin B, Zheng F, Zhang Y. Molecular cloning and characterization of a Mlo gene in rubber tree(Hevea brasiliensis)[J]. J Plant Physiol, 2015, 175(1):78-85.
[21] Wang L F, Wang M, Zhang Y. Effects of powdery mildew infection on chloroplast and mitochondrial functions in rubber tree[J]. Trop Plant Pathol, 2014, 39(3): 242-250.
[22] 徐 杰,蒋世云,傅凤鸣,等. EPSP合酶的研究进展[J]. 生物技术通报,2014,6(6):40-50.
[23] Papanikou E, Brotherton J E, Widholm J M. Length of time in tissue culture can affect the selected glyphosate resistance mechanism[J]. Planta, 2004, 218(4): 589-598.
[24] Krol A R, Plas L H. Developmental and wound-, cold-, desiccation-, ultraviolet-B-stress-induced modulations in the expres-sion of the petunia zinc finger transcription factor gene ZPT2-2[J]. Plant Physiology, 1999, 121(4): 1 153-1 162.
[25] Hermann K M. The shikimate pathway:early steps in the biosynthesis of aromatic compounds[J]. Plant Cell, 1995, 7(3): 907-919.
[26] Benfey P N, Takatsuji H, Ren L, et al. Sequence requirements of the 5-enolpyruvylshikimate-3-phosphatesynthase 5[prime]-upstream region for tissue-specific expression in flowers and seedlings[J]. Plant Cell, 1990, 2(9): 849-856.
[27] Gasser C S, Winter J A, Hironaka C M, et al. Structure, expression, and evolution of the 5-enolpyruvylshikimate-3-phosphate synthase genes of petunia and tomato[J]. The Journal of Biological Chemistry, 1988, 263(24): 4 280-4 287.
[28] Gong Y, Liao Z, Chen M, et al. Characterization of 5-enolpyruvylshikimate 3-phosphate synthase genefrom Camptotheca acuminata[J]. Biologia Plantarum, 2006, 50(4): 542-550.
