两种离子化技术气相色谱-质谱法测定橄榄油中甾醇烯类物质的比较
2016-05-12魏雪缘沈伟健余可垚陆慧媛
魏雪缘, 沈伟健, 余可垚, 张 建, 陆慧媛, 吴 斌,
沈崇钰2, 赵增运2, 柳 菡2, 邓晓军3, 王岁楼1*
(1. 中国药科大学药学院, 江苏 南京 210009; 2. 江苏出入境检验检疫局食品实验室,
江苏 南京 210001; 3. 上海出入境检验检疫局动植物与食品检验检疫技术中心, 上海 200135)
研究论文
两种离子化技术气相色谱-质谱法测定橄榄油中甾醇烯类物质的比较
魏雪缘1,2,沈伟健2,余可垚2,张建2,陆慧媛2,吴斌2,
沈崇钰2,赵增运2,柳菡2,邓晓军3,王岁楼1*
(1. 中国药科大学药学院, 江苏 南京 210009; 2. 江苏出入境检验检疫局食品实验室,
江苏 南京 210001; 3. 上海出入境检验检疫局动植物与食品检验检疫技术中心, 上海 200135)
摘要:分别采用电子轰击(EI)和正化学电离(PCI)两种离子源技术建立了气相色谱-质谱联用法(GC-MS)同时测定橄榄油中3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾二烯3种甾醇烯含量的方法,并对这两种方法进行了比较。样品经石油醚溶解,硅胶柱净化后,分别采用GC-EI/MS和GC-PCI/MS分时段选择离子监测模式进行测定,以3,5-胆甾二烯为内标进行定量。结果表明,两种方法的线性、准确度、精密度、灵敏度均较好。3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾二烯分别在0.024~0.48、0.02~0.50和0.03~0.75 mg/L浓度范围内线性关系良好(r>0.999)。在3个加标水平下,GC-EI/MS和GC-PCI/MS的平均回收率分别为88.7%~99.5%、87.1%~109.2%,两种检测方法的相对标准偏差(RSD, n=6)均不超过8.3%。定量限(S/N=10)分别为0.03 mg/kg(EI), 0.03~0.10 mg/kg(PCI)。通过对两种方法的比较研究发现,EI能提供更多碎片离子和结构信息,而PCI中则主要为准分子离子及反应气加合离子。应用于样品中甾醇烯的测定时,PCI的选择性和抗干扰能力明显优于EI。两种方法可相互补充和替代应用于日常检测中。
关键词:气相色谱-质谱;甾醇烯;电子轰击电离;正化学电离
甾醇烯是植物油中的Δ5-甾醇在脱色、水蒸气洗涤和高温除臭等精炼工序中发生脱水反应生成的一类化合物[1-3]。精炼植物油中甾醇烯种类众多,其中以β-谷甾醇脱水生成的3,5-豆甾二烯(stigmasta-3,5-diene)含量最为丰富,此外含量较高的还有3,5-菜甾二烯(campesta-3,5-diene)和3,5,22-豆甾三烯(stigmasta-3,5,22-triene),分别由菜油甾醇和豆甾醇脱水形成[3-5]。橄榄油是以油橄榄树的果实为原料制取的油脂,分为初榨橄榄油、精炼橄榄油和混合橄榄油三大类[6]。初榨橄榄油未经精炼处理,甾醇烯含量较低(<0.01 mg/kg),而精炼橄榄油中3,5-豆甾二烯含量通常在0.3~0.9 mg/kg范围内[2]。目前,国内外已将甾醇烯含量作为判断初榨橄榄油是否掺假的重要指标,欧盟(EU)规定初榨橄榄油中3,5-豆甾二烯的限量为0.05 mg/kg[7],我国国标《橄榄油、油橄榄果渣油》中规定初榨橄榄油中豆甾二烯的含量应不超过0.15 mg/kg[6]。
目前,文献中报道的用于植物油中甾醇烯测定的方法主要有气相色谱-氢火焰离子检测法(GC-FID)[8]、高效液相色谱-紫外检测法(HPLC-UV)[9,10]及气相色谱-质谱联用技术(GC-MS)[11]。GC-FID灵敏度低且干扰多,因此应用受到一定限制[4,5,8]。由于甾醇烯类物质结构相似,采用传统的反相色谱难以完全分离。于瑞祥等[9]研究发现采用反相C30柱,以乙腈-甲基叔丁基醚(75∶25, v/v)为流动相等度洗脱,可实现3,5-胆甾二烯、3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾二烯4种甾醇烯的基线分离。但色谱法属于初筛方法,出现阳性结果还需进一步确证[12]。相比于色谱法,GC-MS的选择性好,可减少其他组分对测定的干扰以保证检测结果的可靠性。GC-MS的离子源有电子轰击电离(EI)和化学电离(CI)两种,目前已报道的GC-MS应用于植物油中甾醇烯测定均采用EI离子源[3,11]。通过EI离子源可获取丰富的碎片离子信息,但易受样品基体干扰,从而影响方法的选择性[13,14]。CI源有正化学(PCI)和负化学(NCI)离子源两种,但NCI对没有电负性基团的化合物无响应,不适合用于甾醇烯的测定。PCI是一种软电离技术,碎片离子少,准分子离子峰和反应气加合离子峰丰度高。与EI相比,由于对柱流失和基质基本没有响应,因此选择性更好[15]。与NCI相比,应用范围更为广泛,选择甲烷作为反应气时可用于甾醇烯的测定。
本文选择3,5-胆甾二烯(cholesta-3,5-diene)作为内标,分别建立了GC-EI/MS和GC-PCI/MS同时测定橄榄油中3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾二烯3种甾醇烯含量的方法,并对这两种离子源技术进行了比较。
1实验部分
1.1仪器、试剂与材料
7890A/5975C气相色谱-质谱联用仪(配有EI源,美国Agilent公司), 6890N/5973 Inert气相色谱-质谱联用仪(配有PCI源,美国Agilent公司), XW-80A微型旋涡混合仪(上海沪西分析仪器厂有限公司), Hei-VAP旋转蒸发仪(德国Heidolph公司)。带活塞的砂芯玻璃层析柱(15 cm×10 mm i.d.,称取(10.0±0.1) g硅胶至玻璃层析柱中,在木板上轻轻敲实使硅胶填料填充均匀,上层加入约4 g无水硫酸钠)。
石油醚(分析纯,沸程60~90 ℃,南京化学试剂有限公司),正己烷(色谱纯,美国Burick & Jackson公司),硅胶(60~100目,国药集团化学试剂有限公司,使用前于160 ℃烘4 h以上,冷却后调整硅胶的含水量为2%(质量分数),混匀,备用),无水硫酸钠(分析纯,南京化学试剂有限公司,使用前于650 ℃灼烧4 h以上)。
3,5-胆甾二烯标准品(100 mg,纯度>93%)购自美国Sigma-Aldrich公司,3,5-豆甾二烯和3,5-菜甾二烯混合标准溶液(200 mg/L, 3,5-豆甾二烯和3,5-菜甾二烯的纯度分别为75%和6%)和3,5,22-豆甾三烯标准溶液(100 mg/L,纯度>95%)均来源于挪威Chiron AS公司。
橄榄油样品由江苏出入境检验检疫局提供。
1.2标准溶液的配制
称取3,5-胆甾二烯标准品10 mg(精确至0.1 mg)至10 mL容量瓶中,加正己烷溶解并定容,配制成质量浓度为1.0 g/L的标准储备液,再使用正己烷逐级稀释配制成1.0 mg/L的标准溶液,于4 ℃冰箱中保存。
用正己烷将200 mg/L的3,5-豆甾二烯和3,5-菜甾二烯混合标准品原液、100 mg/L的3,5,22-豆甾三烯标准品原液分别逐级稀释配制成质量浓度为20和2.0 mg/L、10和1.0 mg/L的标准溶液。
准确吸取系列体积的3,5-豆甾二烯和3,5-菜甾二烯的混合标准溶液、3,5,22-豆甾三烯标准溶液置于进样瓶中,各加入100 μL质量浓度为1.0 mg/L的3,5-胆甾二烯内标溶液,加正己烷稀释至1 mL,制成3,5-菜甾二烯质量浓度分别为0.024、0.060、0.12、0.24和0.48 mg/L, 3,5,22-豆甾三烯质量浓度分别为0.02、0.05、0.1、0.2和0.5 mg/L,3,5-豆甾二烯的质量浓度分别为0.03、0.075、0.15、0.30和0.75 mg/L的系列标准工作液,其中内标浓度均为0.1 mg/L。
1.3样品前处理
参照国家标准《动植物油脂、植物油中豆甾二烯的测定第2部分:高效液相色谱法》[16]及相关文献[9,11],选择样品前处理方法如下:称取0.5 g(精确至0.001 g)橄榄油样品于试管中,加入100 μL内标溶液(1.0 mg/L)。用5 mL石油醚溶解后倒入层析柱中,再用2×2.5 mL石油醚润洗试管,洗涤液一并倒入层析柱中。当石油醚液面到达上层无水硫酸钠顶部时,立即用40 mL石油醚洗脱目标组分,洗脱液收集于平底烧瓶中,并于45 ℃水浴中旋转蒸发至干。加入1 mL正己烷溶解瓶内剩余残渣,待测。
1.4实验条件
1.4.1GC-EI/MS技术参数
色谱柱:J & W DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm);程序升温条件:初始温度为60 ℃,以50 ℃/min的速率升温至270 ℃,再以2 ℃/min的速率升温至280 ℃,保持7 min;载气:高纯He(纯度≥99.999%);流速:1 mL/min;进样口温度:300 ℃;进样量:1 μL;进样方式:脉冲不分流进样,1.5 min后开分流阀。
离子源:EI;电离能量:70 eV;接口温度:280 ℃;离子源温度:230 ℃;四极杆温度:150 ℃;溶剂延迟:7 min;扫描方式:选择离子监测(SIM),各甾醇烯的质谱分析参数如表1所示。

表 1 4种甾醇烯的相对分子质量、保留时间(及其窗口)和GC-EI/MS监测离子信息
* Quantitative ions.
1.4.2GC-PCI/MS技术参数
色谱柱:DB-17MS石英弹性毛细管柱(30 m×0.25 mm×0.25 μm);程序升温条件:初始温度为60 ℃,以50 ℃/min的速率升温至270 ℃,再以2 ℃/min的速率升温至280 ℃,保持3 min;载气:高纯He(纯度≥99.999%);流速:1 mL/min;进样口温度:300 ℃;进样量:1 μL;进样方式:脉冲不分流进样,1.5 min后开分流阀。
离子源:PCI;反应气:甲烷(纯度≥99.99%);电离能量:123.7 eV;接口温度:280 ℃;离子源温度:250 ℃;四极杆温度:150 ℃;溶剂延迟:7 min;扫描方式:SIM;各甾醇烯的质谱分析参数如表2所示。
2结果与讨论
2.1监测离子的选择
在建立的色谱分离条件下,分别采用GC-EI/MS和GC-PCI/MS对4种甾醇烯的混合标准溶液进行全扫描(scan,m/z50~450),得到总离子流图(TIC)及其质谱图。选择m/z较大和相对丰度较高的特征性碎片离子作为监测离子,具体信息见表1和2。
GC-EI/MS中,甾醇烯在高能电子束的轰击下,
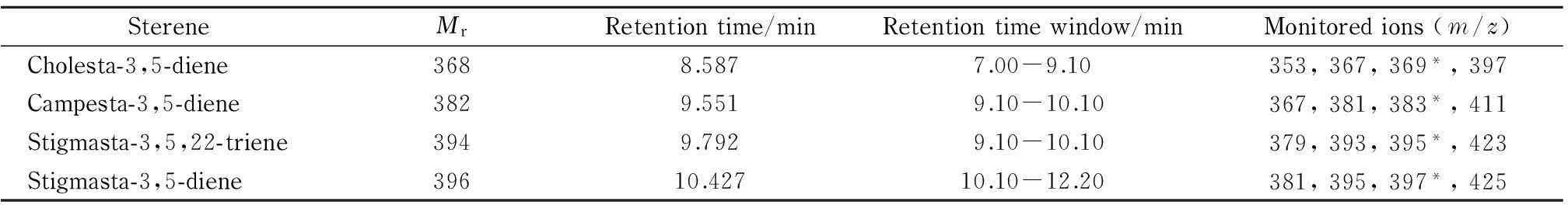
表 2 4种甾醇烯的相对分子质量、保留时间(及其窗口)和GC-PCI/MS监测离子信息
* Quantitative ion.
产生一系列的碎片离子。以3,5-豆甾二烯为例,根据碎片离子推测可能的裂解机理如图1所示。3,5-豆甾二烯结构中具有共轭双键,分子离子很稳定,因此,EI质谱图中可观察到m/z396分子离子峰,而且在所有的碎片离子中,分子离子峰M+的丰度最强。分子离子M+丢失甲基和长侧链分别形成m/z381和m/z255的碎片离子,m/z255的碎片离子五元环开裂产生碎片离子m/z213[17,18]。其他甾醇烯结构与3,5-豆甾二烯相似,裂解机理相似。

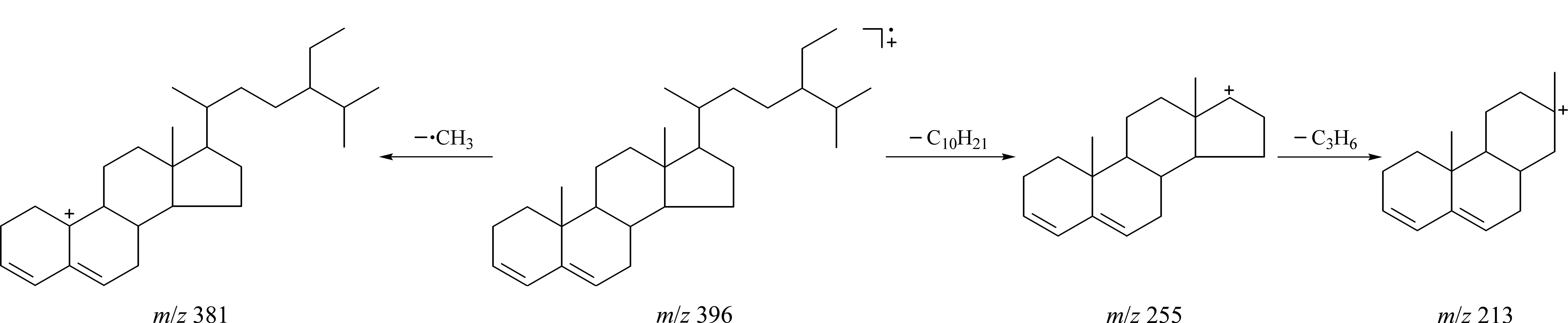
图 1 推测的3,5-豆甾二烯的裂解途径(EI)Fig. 1 Speculative pathway of fragment ions formed from stigmasta-3,5-diene in EI mode

图 2 混合标准溶液(3,5-胆甾二烯 0.1 mg/L, 3,5-菜甾二烯 0.06 mg/L, 3,5,22-豆甾三烯 0.5 mg/L, 3,5-豆甾二烯 0.75 mg/L)的选择离子监测图Fig. 2 SIM chromatograms of a mixed standard solution (cholesta-3,5-diene 0.1 mg/L, campesta-3,5-diene 0.06 mg/L, stigmasta-3,5,22-triene 0.5 mg/L, stigmasta-3,5-diene 0.75 mg/L) a. GC-EI/MS; b. GC-PCI/MS.Peak identifications: 1. cholesta-3,5-diene; 2. campesta-3,5-diene; 3. stigmasta-3,5,22-diene; 4. stigmasta-3,5-diene.
2.2方法学指标的比较
2.2.1线性范围、检出限及定量限
将1.2节配制的系列混合标准工作溶液分别按上述GC-EI/MS和GC-PCI/MS条件进行分析测定,4种甾醇烯混合标准溶液的选择离子监测图见图2。以各组分定量离子与内标定量离子峰面积的比值(Y)对其质量浓度(X, mg/L)进行线性回归,得到线性回归方程及相关系数(见表3)。3种甾醇烯的线性相关系数(r)均大于0.999,说明各甾醇烯在其相应的质量浓度范围内线性关系良好。
在已知阴性的橄榄油样品(特级初榨橄榄油)中分别添加多个水平的目标组分,根据S/N=3和S/N=10分别确定GC-EI/MS和GC-PCI/MS中各甾醇烯的检出限和定量限,结果见表3。采用GC-EI/MS, 3种甾醇烯的检出限和定量限均分别为0.01和0.03 mg/kg。GC-PCI/MS中,3,5-菜甾二烯和3,5-豆甾二烯的检出限和定量限与GC-EI/MS中相同,但3,5,22-豆甾三烯的灵敏度略低于GC-EI/MS,检出限和定量限分别为0.03和0.10 mg/kg。GC-EI/MS和GC-PCI/MS中各甾醇烯的定量限均不超过0.10 mg/kg,满足相关标准中规定的限量要求[6,7]。

表 3 3种甾醇烯的线性范围、回归方程、相关系数(r)、检出限及定量限
Y: peak area ratio of the quantitative ion of the analyte to the internal standard;X: mass concentration of the analyte, mg/L.
2.2.2加标回收率与精密度
称取已知阴性橄榄油样品(特级初榨橄榄油)0.5 g,分别添加高、中、低3个水平的3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾二烯的标准溶液,按照1.3节方法制备加标样品溶液并分别于已建立的GC-EI/MS和GC-PCI/MS实验条件下测定,每个添加水平平行测定6次,以内标法定量计算各甾醇烯的加标回收率及相对标准偏差,结果见表4。
由表4可见,采用GC-EI/MS,各甾醇烯在3个添加水平下的回收率为88.7%~99.5%,相对标准偏差为2.2%~6.9%;在GC-PCI/MS中,各甾醇烯的回收率范围为87.1%~109.2%,相对标准偏差为3.3%~8.3%。上述数据说明所建立的两种方法均准确、可靠。
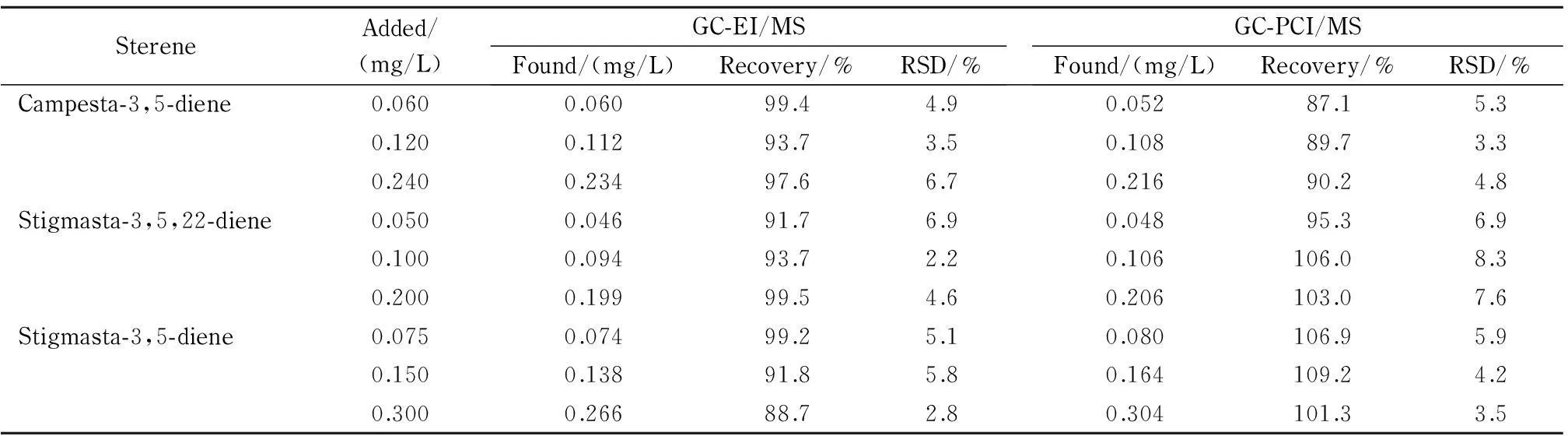
表 4 特级初榨橄榄油中3种甾醇烯的加标回收率与相对标准偏差(n=6)
2.2.3稳定性
取同一加标样品溶液于4 ℃冰箱中分别放置0、6、12、24、48 h后,在已建立的色谱-质谱条件下进行分析测定,重复测定3次,内标法定量。GC-EI/MS测定结果显示,3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾三烯含量的RSD分别为2.7%、3.3%和2.8%。GC-PCI/MS测定结果表明,3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾三烯含量的RSD分别为2.3%、4.2%和1.6%。说明样品溶液于4 ℃冰箱中放置48 h内稳定性良好。
2.3选择性
橄榄油主要由甘油三酯、角鲨烯、维生素、多酚及色素等组成,其中甘油三酯约占99%(质量分数)。目前常用的从橄榄油中分离甾醇烯的方法主要有皂化法[2]和硅胶层析法[9-11],鉴于皂化法具有操作繁琐、重复性差等缺点,本实验采用硅胶层析法进行净化。根据甾醇烯与甘油三酯极性的差异,在硅胶柱中采用石油醚洗脱使非极性的甾醇烯与极性较大的甘油三酯基质分离,同时硅胶还可吸附橄榄油中的色素及其他极性杂质,从而达到净化的目的。
对按照上述前处理操作处理的阴性橄榄油样品(不加内标)分别采用GC-EI/MS和GC-PCI/MS进行测定,选择离子监测图见图3。比较二者,可以很明显地看出GC-PCI/MS谱图比较干净,其他组分对测定的干扰小,从而在根本上排除假阳性的可能;而在GC-EI/MS谱图中,目标物附近出现大量杂峰且基线噪音波动大。从选择性来看,PCI受柱流失和基质组分的干扰小,选择性明显优于EI。
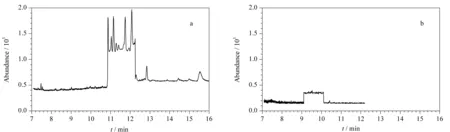
图 3 特级初榨橄榄油样品的(a)GC-EI/MS和(b)GC-PCI/MS选择离子监测图Fig. 3 SIM chromatograms of a blank olive oil sample obtained in (a) GC-EI/MS and (b) GC-PCI/MS
2.4实际样品的测定
应用所建立的两种方法分别对初榨橄榄油(4个)、精炼橄榄油(2个)和混合橄榄油(2个)等实际样品中3种甾醇烯的含量进行了测定和比较,每个样品平行测定3次,结果见表5。采用配对t检验法对两组数据结果进行统计学分析,t检验结果表明3种甾醇烯的含量差异均无统计学意义(P>0.05),因此认为两种方法的测定结果基本一致。
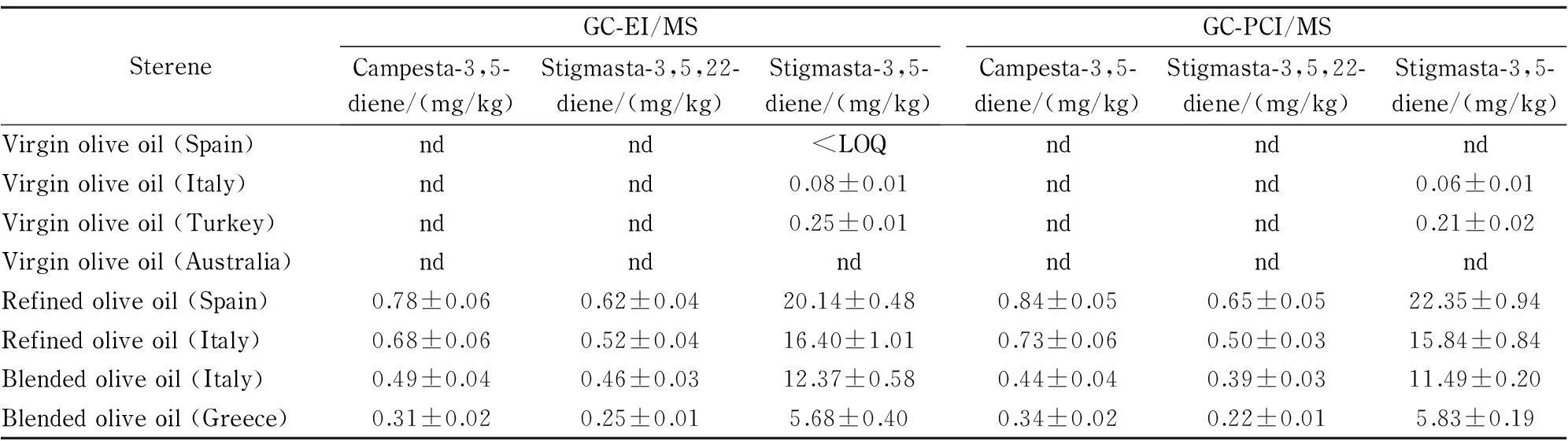
表 5 橄榄油中甾醇烯含量的测定结果(n=3)
nd: not detected; 3结论 本文以3,5-胆甾二烯为内标,分别建立了GC-EI/MS和GC-PCI/MS测定橄榄油中3,5-菜甾二烯、3,5,22-豆甾三烯和3,5-豆甾二烯3种甾醇烯的含量,并对两种离子源技术进行了比较。结果表明,两种方法均简单快速,准确度和灵敏度高,稳定性好,均能满足相关标准中对甾醇烯的限量要求检查。甾醇烯类物质结构中含有共轭双键,分子离子峰在EI中很稳定,因此在EI中不仅可获得分子碎片信息,还可获得相对分子质量信息。而甾醇烯在PCI中产生的离子则主要为质子化分子离子和加合物分子离子,对柱流失无响应,受基质组分干扰小,选择性和抗干扰能力优于EI。应用于实际样品测定时,两种方法的测定结果基本一致,因此,二者相互结合应用于日常橄榄油中甾醇烯类物质的测定,可有效提高定性和定量结果的可靠性。 参考文献: [1]Kasim N S, Gunawan S, Ju Y H. Food Chem, 2009, 117(1): 15 [2]Verleyen T, Szulczewska A, Verhe R, et al. Food Chem, 2002, 78(2): 267 [3]Crews C, Pye C, Macarthur R. Food Res Int, 2014, 60: 117 [4]Moreda W, Perez-Camino M C, Cert A. J Chromatogr A, 2001, 936(1/2): 159 [5]Cert A, Moreda W, Perez-Camino M C. J Chromatogr A, 2000, 881(1/2): 131 [6]GB 23347-2009 [7]Official Journal of the European Union. Commission Implementing Regulation (EU) No 1348/2013 of 16 December 2013 Amending Regulation (EEC) No 2568/91 on the Characteristics of Olive Oil and Olive-Residue Oil and on the Relevant Methods of Analysis. (2013-12-17) [2015-10-25]. http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L: 2013: 338: 0031: 0067:EN:PDF [8]Cert A, Moreda W. J Chromatogr A, 1998, 823(1): 291 [9]Yu R X, Yang R Y, Zhang X, et al. Chinese Journal of Analytical Chemistry, 2012, 40(12): 1902 于瑞祥, 杨瑞钰, 张欣, 等. 分析化学, 2012, 40(12): 1902 [10]Xu X H, Zhang X, Yu R X, et al. Food Science, 2015, 36(16): 141 徐向华, 张欣, 于瑞祥, 等. 食品科学, 2015, 36(16): 141 [11]Yu R X, Yang R Y, Fang X M, et al. China Oils and Fats, 2012, 37(6): 81 于瑞祥, 杨瑞钰, 方小明, 等. 中国油脂, 2012, 37(6): 81 [12]Shen W J, Xu J Z, Yang W Q, et al. Chinese Journal of Chromatography, 2007, 25(5): 753 沈伟健, 徐锦忠, 杨雯荃, 等. 色谱, 2007, 25(5): 753 [13]Shen W J, Mao Y M, Wu B, et al. Chinese Journal of Analytical Chemistry, 2010, 38(7): 941 沈伟健, 毛应民, 吴斌, 等. 分析化学, 2010, 38(7): 941 [14]Ma L L, Zhou J Y, Zhang C C, et al. Journal of Yunnan University, 2010, 32(3): 333 马莉莉, 周金玉, 张承聪, 等. 云南大学学报, 2010, 32(3): 333 [15]Cao X W, Zou K, Xu D, et al. Rock and Mineral Analysis, 2013, 32(1): 22 曹孝文, 邹宽, 徐丹, 等. 岩矿测试, 2013, 32(1): 22 [16]GB/T 25224.2-2010 [17]Zhong Q L, Zhu Z X, Wu H Q, et al. Journal of Instrumental Analysis, 2012, 31(8): 987 钟巧莉, 朱志鑫, 吴惠琴, 等. 分析测试学报, 2012, 31(8): 987 [18]Miao M, Yan X J, Xu J L, et al. Journal of Chinese Mass Spectrometry Society, 2009, 30(3): 139 缪妙, 严小军, 徐继林, 等. 质谱学报, 2009, 30(3): 139 A comparative study of two ionization techniques in gas chromatography-mass spectrometric determination of sterenes in olive oil WEI Xueyuan1,2, SHEN Weijian2, YU Keyao2, ZHANG Jian2, LU Huiyuan2,WU Bin2, SHEN Chongyu2, ZHAO Zengyun2, LIU Han2, DENG Xiaojun3, WANG Suilou1* (1. College of Pharmacy, China Pharmaceutical University, Nanjing 210009, China;2. Food Laboratory, Jiangsu Entry-Exit Inspection and Quarantine Bureau, Nanjing 210001, China;3. Technical Center for Animal Plant and Food Inspection and Quarantine, Shanghai Entry-Exit Inspection and Quarantine Bureau, Shanghai 200135, China) Abstract:The gas chromatography-mass spectrometric (GC-MS) method with two different ionization techniques, electron impact (EI) and positive chemical ionization (PCI), have been developed for the simultaneous determination of three sterenes in olive oil. The olive oil sample was dissolved in petroleum ether, followed by cleanup on a silica gel column and finally analyzed by GC-EI/MS and GC-PCI/MS in selected ion monitoring mode. The quantitation was performed by internal standard calibration with cholesta-3,5-diene as internal standard. These two methods were compared in terms of linearity, accuracy, precision and sensitivity. Good linearities were obtained with correlation coefficients (r) higher than 0.999 for campesta-3,5-diene in the range of 0.024 to 0.48 mg/L, stigmasta-3,5,22-triene in the range of 0.02 to 0.50 mg/L and stigmasta-3,5-diene in the range of 0.03 to 0.75 mg/L. The accuracy test was carried out at three spiked levels in extra virgin olive oil. The average recoveries ranged from 88.7% to 99.5% (EI) and 87.1% to 109.2% (PCI), with relative standard deviations (RSDs, n=6) not higher than 8.3%. Limits of quantification (LOQs, S/N=10) were 0.03 mg/kg (EI) and 0.03-0.10 mg/kg (PCI). Comparative analysis showed a large number of fragment ions could be obtained in EI mode while quasi-molecular ions or other adduct molecular ions were the most abundant ion formed in the PCI mode. Besides, PCI has a better selectivity than EI when applied to real samples. In conclusion, these two ionization techniques are complementary and alternative in the routine analysis of sterenes in olive oil. Key words:gas chromatography-mass spectrometry (GC-MS); sterenes; electron impact ionization (EI); positive chemical ionization (PCI) 中图分类号:O658 文献标识码:A 文章编号:1000-8713(2016)04-0429-07 基金项目:国家质检总局科技计划项目(2015IK141);江苏省“333工程”项目(BRA2014330);上海长三角科技合作项目(15395810100). *收稿日期:2015-12-16 DOI:10.3724/SP.J.1123.2015.12016 *通讯联系人.E-mail:cpuwsl@126.com. Foundation item: Science and Technology Project of AQSIQ (No. 2015IK141); “333 Project” of Jiangsu Province (No. BRA2014330); Science and Technology Project of Shanghai Yangtze River Delta (No. 15395810100).
