SIRT1在结直肠癌组织中的表达及其与MDR-1的关系
2016-05-10王静崔敏张骞李红张燕曹璋
王静,崔敏,张骞,李红,张燕,曹璋
(1滨州医学院,山东滨州256603;2无棣县人民医院;3滨州市人民医院)
SIRT1在结直肠癌组织中的表达及其与MDR-1的关系
王静1,2,崔敏3,张骞1,李红1,张燕1,曹璋1
(1滨州医学院,山东滨州256603;2无棣县人民医院;3滨州市人民医院)
目的 探讨沉默信息调节因子1(SIRT1)在结直肠癌组织中的表达及其与多药耐药相关蛋白1(MDR-1)的关系。方法 选择结直肠癌患者162例,取手术切除的癌组织,采用免疫组化Envision法观察SIRT1、MDR-1的阳性表达,分析结直肠癌组织SIRT1阳性表达与患者临床病理参数及MDR-1阳性表达的关系。结果 结直肠癌组织中SIRT1、MDR-1阳性表达率分别为66.0%(107/162)和59.3%(96/162)。结直肠癌组织SIRT1阳性表达与患者性别、肿瘤组织分化程度、临床分期及淋巴结转移无关(P均>0.05),与肿瘤长径有关(P<0.05)。结直肠癌组织SIRT1阳性表达与MDR-1阳性表达呈正相关(r=0.506,P<0.01)。结论 结直肠癌组织中SIRT1阳性表达较高,其阳性表达与MDR-1阳性表达呈正相关关系。
结直肠癌;沉默信息调节因子1;多药耐药相关蛋白1;免疫组织化学
近年来我国结直肠癌的发病率、病死率呈明显上升趋势[1]。目前结直肠癌的治疗以手术为主,术后辅以化疗[1,2]。部分患者术后化疗可发生多药耐药,多药耐药相关蛋白1(MDR-1)可能在其中发挥重要作用[3]。沉默信息调节因子1(SIRT1)是哺乳动物NAD+依赖的组蛋白脱乙酰基酶,可参与多个信号转导途径的调节。近年研究发现,SIRT1在肿瘤的发生、发展过程中具有重要作用[4~6]。本研究探讨结直肠癌组织中SIRT1表达及其与患者临床病理参数及MDR-1的关系,旨在为结直肠癌患者术后的靶向治疗提供依据。
1 资料与方法
1.1 临床资料 选择2010年11月~2012年5月在滨州医学院附属医院行结直肠癌根治术患者162例,均经术后组织病理检查明确诊断。其中,男87例、女75例,年龄19~88岁、中位年龄56岁;肿瘤长径1.2~7.5 cm、平均5 cm;临床分期:Ⅰ、Ⅱ期60例,Ⅲ、Ⅳ期102例;组织分化程度:高分化34例,中分化61例,低分化67例;有淋巴结转移102例,无淋巴结转移60例。所有患者术前未行放化疗。
1.2 结直肠癌组织SIRT1及MDR-1表达检测 采用免疫组化Envision法。 取手术切除的结直肠癌组织标本,经10%甲醛溶液固定,石蜡包埋,4 μm厚切片。切片常规脱蜡、水化,置于pH 6.0的枸橼酸盐缓冲液中微波加热修复,H2O2封闭,滴加适量稀释的鼠抗人SIRT1多克隆抗体及鼠抗人MDR-1单克隆抗体,抗体稀释浓度分别按1∶200、1∶300,4 ℃孵育过夜,PBS冲洗3次,加入二抗,室温孵育1 h,DAB显色及苏木素复染,脱水,透明,封片,显微镜下观察。以PBS代替一抗作阴性对照,以已知阳性反应切片作为阳性对照。 参照文献[7,8]对SIRT1、MDR-1阳性表达进行判定。SIRT1阳性染色主要定位于细胞核及细胞质,呈棕褐色颗粒;随机观察5个高倍镜视野,各计数500个细胞,阳性细胞≥30%为阳性,<30%为阴性。MDR-1阳性染色定位于细胞膜和细胞质,呈棕黄色颗粒;随机观察5个高倍镜视野,各计数500个细胞,阳性细胞≥30%为阳性,<30%为阴性。同时分析SIRT1阳性表达与MDR-1阳性表达的关系。
1.3 统计学方法 采用SPSS13.0统计软件。计数资料比较采用χ2检验。相关性分析采用Pearson相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 结直肠癌组织SIRT1阳性表达与患者临床病理参数的关系 162例结直肠癌患者SIRT1阳性表达率为66.0%(107/162)。SIRT1阳性表达与结直肠癌患者性别、肿瘤组织分化程度、临床分期及淋巴结转移无关(P均>0.05),与肿瘤长径有关(P<0.05)。见表1。
2.2 结直肠癌组织SIRT1阳性表达与MDR-1阳性表达的关系 162例结直肠癌患者MDR-1阳性表达96例,SIRT1、MDR-1同时阳性表达者72例,同时阴性表达者31例。Pearson相关分析显示,SIRT1阳性表达与MDR-1阳性表达呈正相关(r=0.506,P<0.01)。见表2。
3 讨论
结直肠癌的发生、发展是一个受多基因、多步骤调控的复杂过程[2]。SIRT1是sirtuin家族中研究最多的成员之一,具有多种生物学作用[9~11]。有研究发现,SIRT1可参与多个肿瘤信号转导途径的调节,但其在肿瘤发生、发展过程中的作用存在争议,既有对肿瘤起促进作用的报道,又有对肿瘤起抑制作用的报道[12~19],其原因可能与组织不同有关。Firestein等[12]在对APCmin/+小鼠的研究过程中发现,过表达SIRT1可通过对β连环蛋白去乙酰化,使β连环蛋白重新定位于细胞质,继而β连环蛋白在致癌过程中的活性被抑制,进而发挥抑癌作用。本研究结果显示,SIRT1在结直肠癌组织中的阳性表达率为66.0%, 其阳性表达与患者性别、肿瘤组织分化程度、淋巴结转移及临床分期无关,仅与肿瘤长径有关,提示SIRT1可能参与结直肠癌的发展过程,靶向抑制SIRT1表达可能抑制结直肠癌细胞的增殖。
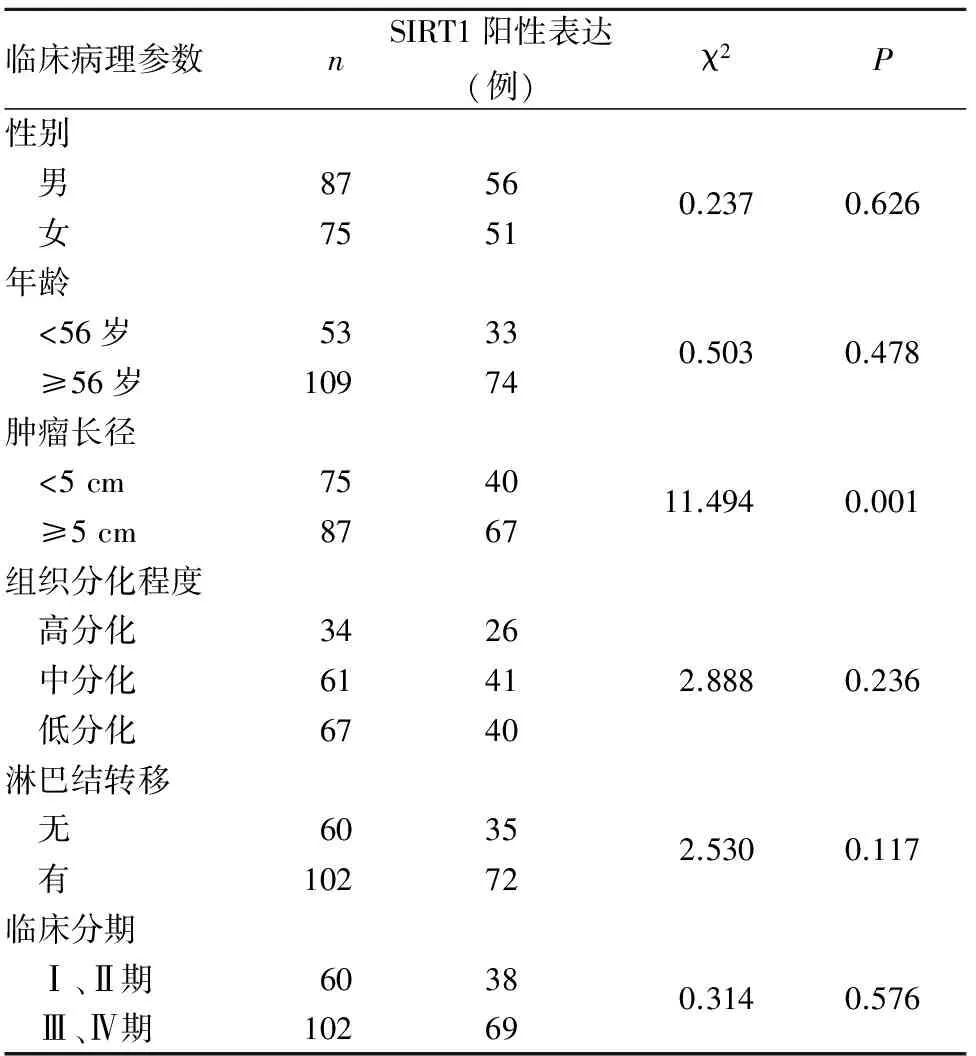
表1 结直肠癌组织SIRT1阳性表达与患者临床病理参数的关系

表2 结直肠癌组织SIRT1与MDR-1表达的关系
目前,结直肠癌的治疗仍以手术治疗为主,术后辅以放化疗。术后化疗过程中,肿瘤细胞发生多药耐药成为临床治疗的一大难题。肿瘤多药耐药是指某种化疗药物作用于肿瘤细胞后,肿瘤细胞不仅对该种药物产生耐药,而且对未接触过的、结构和机制均不同的多种抗肿瘤药物也可产生交叉耐药。因此,临床常联合检测多药耐药基因产物,以期能更客观地反映肿瘤细胞对化疗药物的耐药性。MDR-1编码一种ATP依赖型膜转运蛋白,可将进入癌细胞内的抗癌药物泵出癌细胞,从而减少细胞内化疗药物蓄积导致的癌细胞耐药,可间接反映肿瘤的多药耐药情况[20,21]。故寻找可能的靶点或指标来逆转化疗耐药对患者预后具有重要意义[20~23]。Akiyama等[24]通过对抗血管生成靶向上皮细胞的研究发现,与正常上皮细胞相比,肿瘤上皮细胞高表达MDR-1基因及其产物蛋白会对紫杉酚产生耐药。本研究结果显示,结直肠癌组织中MDR-1阳性表达96例。Pearson相关分析显示,结直肠癌组织SIRT1阳性表达与MDR-1阳性表达呈正相关关系,提示SIRT1蛋白表达增加的结直肠癌患者可能易对MDR-1相关的烷化剂、铂类、丝裂霉素等抗癌药物产生耐药。
综上所述,结直肠癌组织中SIRT1阳性表达较高,其阳性表达与肿瘤多药耐药有关;联合检测SIRT1、MDR-1阳性表达可为结直肠癌的靶向治疗提供依据。
[1] Chen W, Zheng R, Zeng H, et al. The updated incidences and mortalities of major cancers in China, 2011[J]. Chin J Cancer, 2015,34(11):502-507.
[2] Yiu AJ, Yiu CY. Biomarkers in colorectal cancer[J]. Anticancer Res, 2016,36(3):1093-1102.
[3] Dizdarevic S, Peters AM. Imaging of multidrug resistance in cancer[J]. Cancer Imaging, 2011(11):1-8.
[4] Qiu G, Li X, Che X, et al. SIRT1 is a regulator of autophagy: Implications in gastric cancer progression and treatment[J]. FEBS Lett, 2015,589(16):2034-2042.
[5] Kozako T, Suzuki T, Yoshimitsu M, et al. Anticancer agents targeted to sirtuins[J]. Molecules, 2014,19(12):20295-20313.
[6] Houtkooper RH, Pirinen E, Auwerx J. Sirtuins as regulators of metabolism and healthspan[J]. Nat Rev Mol Cell Biol, 2012,13(4):225-238.
[7] Cao Z, Song JH, Kang YH, et al. Genetic and expression analysis of the SIRT1 gene in gastric cancers [J]. J Gastric Cancer, 2010,10(3):1551-1556.
[8] Wen F, He S, Sun C, et al. PIK3CA and PIK3CB expression and relationship with multidrug resistance in colorectal carcinoma[J]. Int J Clin Exp Pathol, 2014,7(11):8295-8303.
[9] Gonfloni S, Iannizzotto V, Maiani E, et al. P53 and Sirt1: routes of metabolism and genome stability[J]. Biochem Pharmacol, 2014,92(1):149-156.
[10] Ryall JG. The role of sirtuins in the regulation of metabolic homeostasis in skeletal muscle[J]. Curr Opin Clin Nutr Metab Care, 2012,15(6):561-566.
[11] Cha EJ, Noh SJ, Kwon KS, et al. Expression of DBC1 and SIRT1 is associated with poor prognosis of gastric carcinoma[J]. Clin Cancer Res, 2009,15(13):4453-4459.
[12] Firestein R, Blander G, Michan S, et al. The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth[J]. PLoS One, 2008,3(4):e2020.
[13] Song S, Luo M, Song Y, et al. Prognostic role of SIRT1 in hepatocellular carcinoma[J]. J Coll Physicians Surg Pak, 2014,24(11):849-854.
[14] Cao YW, Li YC, Wan GX, et al. Clinicopathological and prognostic role of SIRT1 in breast cancer patients: a meta-analysis[J]. Int J Clin Exp Med, 2015,8(1):616-624.
[15] Yu DF, Jiang SJ, Pan ZP, et al. Expression and clinical significance of Sirt1 in colorectal cancer[J]. Oncol Lett, 2016,11(2):1167-1172.
[16] Jung YR, Kim EJ, Choi HJ, et al. Aspirin targets SIRT1 and AMPK to induce senescence of colorectal carcinoma cells[J]. Mol Pharmacol, 2015,88(4):708-719.
[17] Zhang X, Chen S, Cheng M, et al. The expression and correlation of SIRT1 and Phospho-SIRT1 in colorectal cancer[J]. Int J Clin Exp Med, 2015,8(1):809-817.
[18] Lv L, Shen Z, Zhang J, et al. Clinicopathological significance of SIRT1 expression in colorectal adenocarcinoma[J]. Med Oncol, 2014,31(6):965.
[19] Jiang K, Lyu L, Shen Z, et al. Overexpression of SIRT1 is a poor prognostic factor for advanced colorectal cancer[J]. Chin Med J (Engl), 2014,127(11):2021-2024.
[20] Toscano-Garibay JD, Aquino-Jarquin G. Regulation exerted by miRNAs in the promoter and UTR sequences: MDR1/P-gp expression as a particular case[J]. DNA Cell Biol, 2012,31(8):1358-1364.
[21] Wolking S, Schaeffeler E, Lerche H, et al. Impact of genetic polymorphisms of ABCB1 (MDR1, P-Glycoprotein) on drug disposition and potential clinical implications: update of the literature[J]. Clin Pharmacokinet, 2015,54(7):709-735.
[22] Li XF, Ma L, Lu J, et al. Effect of ionizing radiation on transcription of colorectal cancer MDR1 gene of HCT-8 cells[J]. Asian Pac J Trop Med, 2013,6(5):407-409.
[23] Rahman M, Selvarajan K, Hasan MR, et al. Inhibition of COX-2 in colon cancer modulates tumor growth and MDR-1 expression to enhance tumor regression in therapy-refractory cancers in vivo[J]. Neoplasia, 2012,14(7):624-633.
[24] Akiyama K, Ohga N, Hida Y, et al. Tumor endothelial cells acquire drug resistance by MDR1 up-regulation via VEGF signaling in tumor microenvironment[J]. Am J Pathol, 2012,180(3):1283-1293.
Expression of SIRT1 in colorectal carcinoma and its relationship with and MDR-1
WANGJing1,CUIMin,ZHANGQian,LIHong,ZHANGYan,CAOZhang
(1BinzhouMedicalCollege,Binzhou256603,China)
Objective To investigate the expression of silent information regulator 1 (SIRT1) in colorectal carcinoma (CRC) and its relationship with and multidrug resistance-related protein 1 (MDR-1). Methods We used the imunohistochemistry method to detect the expression of SIRT1 and MDR-1 and analyzed their relationships with clinical data in 162 specimens of CRC. Results SIRT1 and MDR-1 expression was detected in 107 (66.0%) and 96 (59.2%) out of 162 colorectal adenocarcinomas, respectively. Statistically, the expression of the SIRT1 protein was not associated with clinical and pathological parameters, including sex, tumor stage, lymph node metastasis and tumor differentiation (allP>0.05), but was associated with tumor size (P<0.05). In addition, the positive expression of SIRT1 and MDR-1 in CRC was positively correlated with each other (r=0.506,P<0.01). Conclusion SIRT1 is highly expressed in the CRC and its expression is positively correlated with MDR-1 expression.
colorectal carcinoma; silent information regulator 1; multidrug resistance-related protein 1; immunohistochemistry
山东省自然科学基金资助项目(ZR2011HQ025,ZR2013HQ018);滨州医学院科研启动基金(BY2010KYQD10,2013QNKJJ01)。
王静(1983-),女,主治医师,研究方向为肿瘤病理学。E-mail: wangjing63886@163.com
曹璋(1978-),男,副教授,研究方向为肿瘤病理学。E-mail: 2438747821@qq.com
10.3969/j.issn.1002-266X.2016.24.005
R735.3
A
1002-266X(2016)24-0017-03
2015-11-28)
