胃癌组织ATP1A2的表达及机制探讨
2016-05-10李智王硕侯科佐臧丹郑春雷车晓芳曲秀娟刘云鹏
李智,王硕,侯科佐,臧丹,郑春雷,车晓芳,曲秀娟,刘云鹏
(中国医科大学附属第一医院,沈阳110001)
胃癌组织ATP1A2的表达及机制探讨
李智,王硕,侯科佐,臧丹,郑春雷,车晓芳,曲秀娟,刘云鹏
(中国医科大学附属第一医院,沈阳110001)
目的 观察胃癌组织ATP酶α2亚基(ATP1A2)表达情况,探讨其与黏着斑通路、细胞黏附分子、钙离子通路、细胞外基质相关信号通路的关系。方法 从癌症基因组图谱(TCGA)数据库下载并预处理胃癌RNASeqV2数据、从人类肿瘤相关基因表达汇编(GEO)数据库下载胃癌样本数据集GSE62254的series matrix数据,通过TCGA数据集纳入胃癌患者293例,通过GEO数据集纳入胃癌患者300例。根据表达谱数据,将胃癌组织ATP1A2表达由低到高排序,按33%、67%者将数据三等分,低于33%者为低表达,高于67%者为高表达,两者之间为中表达。分析不同ATP1A2表达与胃癌患者临床病理参数的关系,比较低、中、高表达者中位生存时间,利用基因集富集分析方法预测ATP1A2相关的基因通路。结果 TCGA数据集纳入的293例胃癌患者中,ATP1A2低、中、高表达者分别为95、99、99例;不同ATP1A2表达与胃癌患者性别、年龄无关(P均>0.05),与T分期、N分期、pTNM分期及组织分化程度有关(P均<0.05);ATP1A2低、中、高表达者中位生存时间分别为70、36.9和26个月,三者间比较P<0.01。GEO数据集纳入的300例胃癌患者中,ATP1A2低、中、高表达者分别为99、102、99例;不同ATP1A2表达与胃癌患者性别、年龄、T分期、N分期、pTNM分期及Lauren分型均有关(P均<0.05);ATP1A2高表达者的中位生存时间为31个月,较低表达和中表达者中位生存时间明显延长(P<0.01)。ATP1A2高表达富集了黏着斑通路、细胞黏附分子、钙离子信号通路、细胞外基质等相关的基因通路(P<0.05或<0.01)。结论 胃癌组织中ATP1A2高表达,其高表达预示患者预后不良;ATP1A2高表达导致黏着斑通路、细胞黏附分子、钙离子信号通路、细胞外基质等基因通路异常可能是其作用机制。
胃癌;癌症基因组图谱;人类肿瘤相关基因表达汇编;ATP酶α2亚基
胃癌是临床常见的恶性肿瘤之一[1],占所有恶性肿瘤相关死亡的第二位。多数胃癌患者就诊时已属晚期,失去了手术治疗机会,其生存时间很难超过1年[2]。侵袭和转移是胃癌患者短期内死亡的主要原因。Na+-K+-ATP酶是广泛表达于上皮细胞的一种跨膜蛋白,是进行主动运输的载体蛋白,由α、β、γ三种亚基组成[3,4]。近年研究发现,Na+-K+-ATP酶的α亚单位在包括非小细胞肺癌、肠癌和恶性脑胶质瘤等多种恶性肿瘤中异常表达,并参与肿瘤细胞的侵袭、转移等过程[5~8]。但目前的研究主要集中于α1和α3两种亚单位,有关α2亚单位的研究较少。ATP酶α2亚单位(ATP1A2)位于染色体1q23.2,包含23个外显子,其功能缺失会造成Na+-K+-ATP酶功能受到抑制,导致细胞外K+聚集、细胞内Na+聚集,并通过Na+/Ca2+交换使细胞内Ca2+增多,从而引发一系列疾病。近年研究认为,ATP1A2基因改变与脑胶质瘤、多囊卵巢综合征等关系密切,但其作用机制尚不清楚。2015年12月~2016年1月,本研究利用在线高通量数据,采用生存分析、基因集富集分析(GSEA)等方法探讨ATP1A2在胃癌组织中的表达及意义。
1 资料与方法
1.1 资料收集 利用Bioconductor/TCGAbiolinks函数包从癌症基因组图谱(TCGA)数据库(https://tcga-data.nci.nih.gov/tcga/)下载并预处理胃癌RNASeqV2数据(level 3)。从NCBI的人类肿瘤相关基因表达汇编(GEO)数据库(http://www.ncbi.nlm.nih.gov/geo)下载胃癌样本数据集GSE62254的series matrix数据。仅保留临床资料和生存信息完整的病例,TCGA数据集共纳入胃癌患者293例(男184例、女109例,中位年龄65岁;TNM分期:Ⅰ期41例、Ⅱ期109例、Ⅲ期125例、Ⅳ期18例)。GSE62254数据集共纳入胃癌患者300例(男199例、女101例,中位年龄62岁;TNM分期:Ⅰ期30例、Ⅱ期96例、Ⅲ期95例、Ⅳ期77例,分期不详2例。
1.2 胃癌组织ATP1A2表达情况及其与患者预后的关系 TCGA数据库的293例胃癌患者采用RNA测序方法,GSE62254数据库的300例胃癌患者采用微阵列方法,分别检测胃癌组织中ATP1A2的表达。以探针信号强度反映ATP1A2的相对表达量,若同一基因信号强度不同,取其中位数。根据ATP1A2表达谱数据,将ATP1A2的相对表达量由低到高排序,按33%、67%将数据三等分,低于33%者为低表达,高于67%者为高表达,两者之间为中表达。分析不同ATP1A2表达与胃癌患者临床病理参数的关系,比较不同ATP1A2表达者的中位生存时间。
1.3 ATP1A2基因集GSEA 采用GSEA2.2.2版软件,根据TCGA数据集ATP1A2表达的中位值(原始读长:48.5)将患者分为低表达和高表达,选用GSEA网站MsigDB数据库中的c2.cp.kegg.v5.1.symbols.gmt数据集作为参照基因集,分析不同ATP1A2表达对各参照基因集的影响。采用缺省加权富集统计的方法进行GSEA,设置随机组合次数为1 000次。
1.4 统计学方法 采用SPSS17.0统计软件。相关性分析采用Spearman秩相关检验。采用Kaplan Meier法绘制生存曲线,Log-rank检验进行比较。P<0.05为差异有统计学意义。在GSEA中按P<0.05且错误发现率(FDR)<0.25的基因集为显著富集基因集。
2 结果
2.1 不同ATP1A2表达与胃癌患者临床病理参数的关系 TCGA数据库293例胃癌患者中,ATP1A2低、中、高表达分别为95、99、99例,不同ATP1A2表达与胃癌患者性别、年龄无关(P均>0.05),与T分期、N分期、pTNM分期及组织分化程度显著相关(P均<0.01),具体见表1。
GEO数据库300例胃癌患者中,ATP1A2低、中、高表达分别为99、102、99例,不同ATP1A2表达与患者性别、年龄、T分期、N分期、pTNM分期、Lauren分型等显著相关(P均<0.05),具体见表2。
2.2 不同ATP1A2表达者生存情况 分别利用TCGA及GSE62254数据集进行生存分析。结果显示,在TCGA数据集中ATP1A2低、中、高表达者的中位生存时间分别为70、36.9和26个月,三者比较P<0.01(见插页Ⅰ图2A)。GSE62254数据集分析亦得出相似的结果,ATP1A2高表达者中位生存时间为31个月,中表达和低表达者中位生存时间未达到,均长于高表达组,组间比较P均<0.01(见插页Ⅰ图2B)。
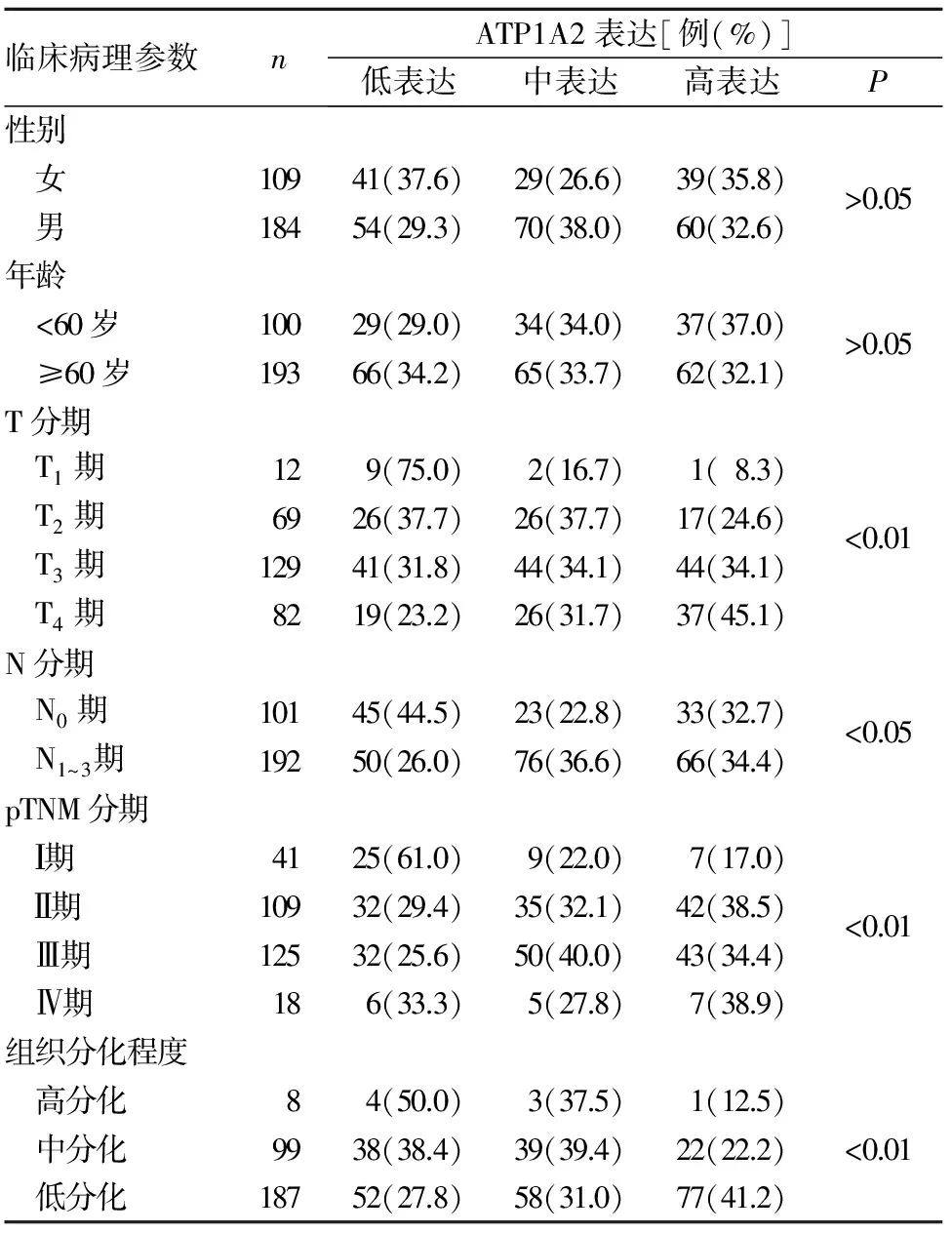
表1 不同ATP1A2表达与TCGA数据库293例胃癌患者临床病理参数的关系

表2 不同ATP1A2表达与GEO数据库300例胃癌患者临床病理参数的关系
注:*2例患者的T分期及TNM分期不详,**3例患者的Lauren分型不详,未被列入分析。
2.3 ATP1A2的功能基因集GSEA情况 GSEA结果显示,ATP1A2高表达样本富集到黏着斑通路(P<0.01,FDR=0.000 4)、细胞黏附分子(P<0.01,FDR=0.000 4)、钙离子信号通路(P<0.01,FDR=0.001 0)、细胞外基质(P<0.05,FDR=0.022 0)等相关基因通路。见插页Ⅰ图3。
3 讨论
Na+-K+-ATP酶作为信号转导蛋白,参与机体生理功能的维持和病理状态的发展[9]。有研究证实,Na+-K+-ATP酶是一种潜在的抗肿瘤作用靶标[10]。Na+-K+-ATP酶的不同亚基在不同肿瘤组织中异常表达。α1亚单位在非小细胞肺癌和脑胶质瘤组织中表达升高[6,8],而在结肠癌组织中表达降低[7]。α3亚单位在肝细胞癌和结直肠癌组织中表达升高[7,11]。异常表达的α1和α3亚单位参与肿瘤细胞的增殖、侵袭和转移等过程。α2亚单位主要表达于骨骼肌、心肌和脑组织,目前的研究主要集中于α2亚单位与中枢神经系统疾病的关系[12,13]。但α2亚单位是否参与胃癌的发生、发展尚并不清楚。本研究利用TCGA和GEO数据集,结合生物信息学分析方法,证实ATP1A2基因在胃癌组织中高表达,在TNM分期高和组织分化程度差的胃癌组织中表达更高。进一步评价ATP1A2基因对评估胃癌患者预后的作用,结果显示ATP1A2高表达患者生存期更短,两个数据集的结果基本一致。上述结果说明,胃癌组织中ATP1A2高表达者预后不良,故ATP1A2表达可作为评价胃癌患者预后的指标。
细胞外基质通路、黏着斑通路、细胞黏附分子基因通路与癌细胞的侵袭和转移密切相关[14]。癌细胞侵袭和转移的过程包括细胞发生上皮间质转化(EMT)、紧密连接松散、integrin等细胞黏附分子表达和功能发生异常、基质微环境改变、金属骨架蛋白重排,进而导致癌细胞离开原发灶,穿透基底膜及细胞外基质,伴随循环系统种植于远处[15]。有研究指出,癌细胞EMT的发生与细胞内钙离子通路密切相关[16,17]。在表皮生长因子刺激下,当癌细胞发生EMT时,细胞内Ca2+水平快速恢复到基线水平。本研究GESA方法发现,ATP1A2基因高表达样本富集到了钙离子信号通路和细胞外基质、黏着斑通路、细胞黏附分子等基因通路,提示ATP1A2基因可能通过改变Na+-K+-ATP酶活性干预细胞内钙离子通路,改变肿瘤微环境,进而参与胃癌的侵袭和转移过程。下阶段可以利用胃癌临床标本,联合检测ATP1A2基因和相应信号通路蛋白的表达,并评估其预后价值。另外,循环肿瘤细胞是近阶段研究热点[18]。其产生与癌细胞间的连接松散、黏附异常、细胞外基质微环境改变等关系密切[19~21]。ATP1A2基因水平与循环肿瘤细胞检出量的关系也值得进一步探讨。外泌体(exosome)是细胞主动向胞外分泌的、大小均一的囊泡样小体[22]。目前已知其具有影响细胞外基质、改变细胞连接状态等功能[23,24]。已有多个研究显示,ATP酶改变与exosome的产生和功能有关[25,26],但尚无ATP1A2基因与exosome的相关研究,这是我们今后研究的方向之一。
综上所述,本研究利用TCGA及GEO数据库推测出胃癌组织中ATP1A2高表达,其表达变化参与胃癌的发生、发展,并可作为预测患者预后的指标;ATP1A2高表达导致黏着斑通路、细胞黏附分子、钙离子信号通路、细胞外基质等基因通路异常可能是其作用机制。
[1] Chen W, Zheng R, Zhang S, et al. The incidences and mortalities of major cancers in China, 2009[J]. Chin J Cancer, 2013,32(3):106-112.
[2] Wagner AD, Grothe W, Haerting J, et al. Chemotherapy in advanced gastric cancer: a systematic review and meta-analysis based on aggregate data[J]. J Clin Oncol, 2006,24(18):2903-2909.
[3] Lutsenko S, Kaplan JH. Organization of P-type ATPases: significance of structural diversity[J]. Biochemistry, 1995,34(48):15607-15613.
[4] Demaine C, Howe A. Cellular physiology of nerve and muscle[M]. United Kingdom: Blackwell Science, 2003:1-132.
[5] Mobasheri A, Avila J, Cózar-Castellano I, et al. Na+-K+-ATPase isozyme diversity; comparative biochemistry and physiological implications of novel functional interactions[J]. Bioscience Reports, 2000,20(2):51-91.
[6] Mijatovic T, Roland I, Quaquebeke EV, et al. The alpha1 subunit of the sodium pump could represent a novel target to combat non-small cell lung cancers[J]. J Pathol, 2007,212(2):170-179.
[7] Sakai H, Suzuki T, Maeda M, et al. Up-regulation of Na+-K+-ATPase α3-isoform and down-regulation of the α1-isoform in human colorectal cancer[J]. FEBS, 2004,563(1-3):151-154.
[8] Lefranc F, Mijatovic T, Kondo Y, et al. Targeting the alpha 1 subunit of the sodium pump to combat glioblastoma cells[J]. Neurosurgery, 2008,62(1):211-221.
[9] Smith TW. Pharmacokinetics, bioavailability and serum levels of cardiac glycosides[J]. J Am Coll Cardiol, 1985,5(5 Suppl A):43A-50A.
[10] Konstantinos A, Theodora C, Florian L, et al. Na+/K+ATPase inhibitors in cancer[J]. Current Drug Targets, 2014,15(10):988-1000.
[11] Shibuya K, Fukuoka J, Fujii T, et al. Increase in ouabain-sensitive K+-ATPase activity in hepatocellular carcinoma by overexpression of Na+-K+-ATPase alpha 3-isoform[J]. Eur J Pharmacol, 2010,638(1-3):42-46.
[12] Illarionova NB, Brismar H, Aperia A, et al. Role of Na,K-ATPase α1and α2isoforms in the support of astrocyte glutamate uptake[J]. Plos One, 2014,9(6):e98469.
[13] Xie J, Ye Q, Cui X, et al. Expression of rat Na-K-ATPase α2enables ion pumping but not ouabain-induced signaling in α1-deficient porcine renal epithelial cells[J]. Ajp Cell Physiology, 2015,309(6):C373-C382.
[14] Celeste MN, Mina JB. Of extracellular matrix, scaffolds, and signaling: tissue architecture regulates development, homeostasis, and cancer [J]. Annu Rev Cell Dev Biol, 2006(22):287-309.
[15] Meng F, Wu G. The rejuvenated scenario of epithelial-mesenchymal transition (EMT) and cancer metastasis [J]. Cancer Metastasis Rev, 2012,31(3-4):455-67.
[16] Davis FM, Azimi I, Faville RA, et al. Induction of epithelial-mesenchymal transition (EMT) in breast cancer cells is calcium signal dependent[J]. Oncogene, 2014,33(18):2307-2316.
[17] Davis FM, Kenny PA, Soo ET, et al. Remodeling of purinergic receptor-mediated Ca2+signaling as a consequence of EGF-induced epithelial-mesenchymal transition in breast cancer cells[J]. Plos One, 2011,6(8):e23464.
[18] Plaks V, Koopman CD, Werb Z. Cancer. Circulating tumor cells[J].Science, 2013,341(6151):1186-1188.
[19] Williams SC. Circulating tumor cells[J]. Proc Natl Acad Sci U S A, 2013,110(13):4861.
[20] Paterlini-Brechot P, Benali NL. Circulating tumor cells (CTC) detection: clinical impact and future directions[J]. Cancer Lett, 2007,253(2):180-204.
[21] Attard G, Swennenhuis JF, Olmos D,et al. Characterization of ERG, AR and PTEN gene status in circulating tumor cells from patients with castration-resistant prostate cancer[J]. Cancer Res, 2009,69(7):2912-2918.
[22] Valadi H, Ekström K, Bossios A, et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007,9(6):654-659.
[23] Kalluri R. The biology and function of exosomes in cancer[J].J Clin Invest. 2016,126(4):1208-1215.
[24] Azmi AS, Bao B, Sarkar FH. Exosomes in cancer development, metastasis, and drug resistance: a comprehensive review[J]. Cancer Metastasis Rev, 201,32(3-4):623-642.
[25] Hiraishi N, Ishida Y, Nagahama M. AAA-ATPase NVL2 acts on MTR4-exosome complex to dissociate the nucleolar protein WDR74[J]. Biochem Biophys Res Commun, 2015,467(3):534-540.
[26] Losh JS, King AK, Bakelar J, et al. Interaction between the RNA-dependent ATPase and poly(A) polymerase subunits of the TRAMP complex is mediated by short peptides and important for snoRNA processing[J]. Nucleic Acids Res, 2015,43(3):1848-1858.
Expression of ATP1A2 in gastric cancer and its mechanism
LIZhi,WANGShuo,HOUKezuo,ZANGDan,ZHENGChunlei,CHEXiaofang,QUXiujuan,LIUYunpeng
(TheFirstHospitalofChinaMedicalUniversity,Shenyang110001,China)
Objective To observe the expression of ATP1A2 in gastric cancer tissues and to investigate the correlations of ATP1A2 expression with focal adhesion, cell adhesion molecules, calcium signaling and ECM receptor interaction pathways. Methods TCGA dataset which included 293 cases, and GEO dataset GSE62254 which included 300 cases, were collected. ATP1A2 expression was trisected into 3 levels: low, median, and high. The cutoff was set to 0.33 and 0.67. The relationships between ATP1A2 and clinicopathological characteristics as well as prognosis were assessed. GSEA was used to predict the functional gene sets modulated by ATP1A2. Results There were 95 cases of low expression, 99 of median expression and 99 of high expression in TCGA dataset. The expression of ATP1A2 was significantly associated with T stage, lymph node metastasis, TNM stage and differentiation (allP<0.01), but was not associated with gender and age (allP>0.05). The median survival durations were 70, 36.9, and 26 months in low, median, and high ATP1A2 expression subgroups, respectively. The P value was less than 0.05 in the log-ranked test. While in GSE 62254 dataset, there were 99 low expressed, 102 median expressed and 99 high expressed cases. Different expression of ATP1A2 was significantly associated with gender, age, T stage, N stage, pTNM stage and Lauren types (allP<0.05). The median survival duration in the high ATP1A2 subgroup was 31 months, while it was much longer in the median and low expression subgroups (P<0.01). In GSEA, focal adhesion, cell adhesion molecules, calcium signaling, and extracellular matrix receptor interaction pathways were enriched in samples with high ATP1A2 expression (P<0.05 orP<0.01). Conclusions ATP1A2 is highly expressed in gastric cancer tissues and the high expression indicates poor prognosis. The underlying mechanism might be that the high expression of ATP1A2 causes the abnormity of focal adhesion, cell adhesion molecules, calcium signaling and extracellular matrix receptor interaction pathways.
gastric carcinoma; cancer genome atlas; human cancer-related gene expression assembly; ATP1A2
国家自然科学基金资助项目(81302023);“重大新药创制”科技重大专项课题(2013ZX09303002);辽宁省科学技术计划项目(2014225013)。
李智(1978-),男,副教授,研究方向为肿瘤生物信息学。E-mail: lizhi2018@hotmail.com
刘云鹏(1959-),男,教授,研究方向为肿瘤分子生物学、生物信息学。E-mail: cmuliuyunpeng@hotmail.com
10.3969/j.issn.1002-266X.2016.24.002
R735.2
A
1002-266X(2016)24-0005-04
2016-01-12)
