LMX1B基因多态性与儿童原发性肾病综合征的相关性分析
2016-05-10于海绍雷凤英陈秀萍蒋玲覃远汉
于海绍,雷凤英,陈秀萍,蒋玲,覃远汉
(广西医科大学第一附属医院,南宁530021)
LMX1B基因多态性与儿童原发性肾病综合征的相关性分析
于海绍,雷凤英,陈秀萍,蒋玲,覃远汉
(广西医科大学第一附属医院,南宁530021)
目的 探讨LMX1B基因第3外显子突变及其多态性与儿童原发性肾病综合征(PNS)的相关性。方法 选取PNS患儿94 例(PNS组),其中糖皮质激素敏感48例、耐药46例,同期体检健康儿童60例作为对照组。采用聚合酶链反应-DNA直接测序技术观察两组LMX1B基因第3外显子突变情况,并分析其多态性与PNS的关系。结果 PNS组与对照组LMX1B基因第3外显子均未发现突变,仅发现一个多态性位点rs2277158,且两组等位基因频率及基因型分布比较差异均无统计学意义(P均>0.05)。PNS组糖皮质激素敏感者与糖皮质激素耐药者等位基因频率及基因型分布比较差异无统计学意义(P>0.05)。结论 LMX1B基因第3外显子及rs2277158位点多态性可能与儿童PNS的发生无关,其rs2277158位点多态性与儿童PNS糖皮质质素治疗反应也无明确关联。
原发性肾病综合征;LMX1B基因;单核苷酸多态性;儿童
原发性肾病综合征(PNS)是因肾小球基膜通透性升高,导致血浆内大量蛋白质由尿丢失的临床综合征,其病因和发病机制尚不明确。Podocin是构成滤过隙膜的主要蛋白质,并与Nephrin、CD2AP相互作用[1]。LMX1B基因敲除小鼠会出现肾脏足细胞分化障碍、Podocin和CD2AP表达下调[2]和Col4a3和Col4a4转录表达丧失,从而影响构成肾小球基膜的Ⅳ型胶原表达[3]。有文献报道,LMX1B基因突变导致的指甲髌骨综合征患者可表现为肾病综合征,并对激素耐药[4,5]。PNS患儿LMX1B基因第4外显子存在突变,且与激素耐药有关[6]。既往研究发现,LMX1B基因第3外显子突变发生率远高于第4~6外显子[4]。因此,我们采用聚合酶链反应-DNA直接PCR测序技术检测PNS患儿LMX1B基因第3外显子的突变情况,并探讨其多态性与PNS的发生及糖皮质激素治疗反应的关系。
1 资料与方法
1.1 临床资料 研究对象为2010年1月~2014年2月广西医科大学第一附属医院儿科就诊的94例PNS患儿(PNS组),男72例、女22例,年龄(6.5±3.7)岁。糖皮质激素治疗敏感48例,耐药46例。PNS的诊断标准及糖皮质激素治疗反应类型参照中华医学会儿科学分会肾脏病学组制定的儿童常见肾脏疾病诊治循证指南[7]。 对照组为同期我院体检健康儿童60例,男40例、女20例,年龄(6.9±3.8)岁。两组性别、年龄具有可比性。
1.2 LMX1B基因突变及多态性检测 抽取两组外周静脉血2 mL,置于EDTA抗凝试管中,采用北京康为世纪生物科技有限公司提供的外周血基因组DNA提取试剂盒提取DNA,并于-20 ℃冻存。采用聚合酶链反应-DNA直接测序技术对LMX1B基因第3外显子测序并对其多态性位点进行基因型分型。聚合酶链反应引物序列:F为5′-CAGGTGACTCTAGGCAGGATG-3′,R为5′-CACACAGGTGGACACGTCA-3′。聚合酶链反应体系和条件:50 μL PCR反应体系:基因组DNA 100 ng,正、反向引物(20 μmol/L)各1 μL,Mix (RR901大连TaKaRa公司)25 μL,灭菌双蒸水;反应条件:95 ℃预变性10 min,95 ℃变性30 s,63 ℃退火30 s,72 ℃延伸30 s,循环30次,最后72 ℃延伸10 min。取3 μL PCR产物进行2%琼脂糖凝胶电泳,100 V电泳30 min,紫外灯下观察电泳结果,选取明亮特异性条带进行测序(华大基因生物科技有限公司)。
1.3 统计学方法 采用SPSS16.0统计软件。计数资料采用频数或百分率表示,结果比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 LMX1B基因测序结果 两组均未发现LMX1B基因第3外显子存在突变,LMX1B基因rs2277158位点测序结果见插页Ⅱ图1。测序图中纯合子呈单峰,杂合子呈双峰。
2.2 两组rs2277158位点多态性分析 两组LMX1B 基因rs2277158位点基因型分布及等位基因频率比较差异均无统计学意义(P均>0.05)。见表1。

表1 两组rs2277158位点基因型分布及等位基因频率比较
2.3 激素敏感与耐药患儿rs2277158位点多态性分析 激素敏感与激素耐药患儿rs2277158位点基因型及等位基因频率比较差异均无统计学意义(P均>0.05)。见表2。
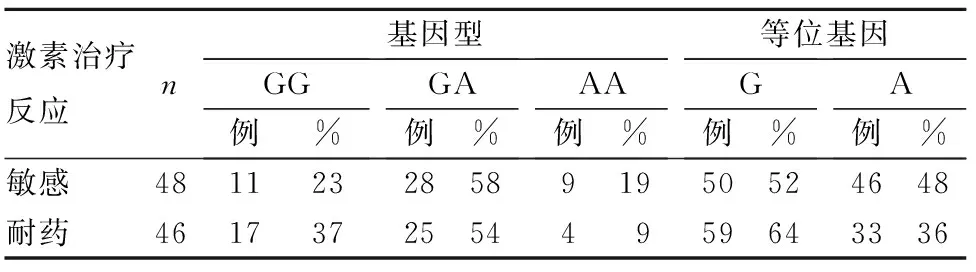
表2 激素治疗敏感与耐药患儿rs2277158位点基因型分布和等位基因频率比较
3 讨论
LMX1B基因属于转录因子家族,具有LIM-同源区,LIM区包括LIM-A和LIM-B,主要参与蛋白间的相互结合,而同源区主要参与DNA的结合。该基因位于常染色体9q34.1,其长度大约为82 kb,由8个外显子组成。第3外显子编码LIM-B,4~6外显子则编码同源区。LMX1B基因广泛存在于脊柱动物的胚胎中,并在四肢、肾脏(肾小球)、眼及大脑发育等过程中发挥重要作用。
近年来,因LMX1B基因突变可导致肾脏疾病而成为研究热点[8,9]。LMX1B出现于肾小球足细胞分化开始的S小体期[10],该基因敲除会导致肾小球足细胞分化障碍或足突消失以及肾小球基膜不规则增厚[2]。Zhou等[11]研究发现,LMX1B可以抑制多种促纤维化成分的表达,对肾间质具有保护作用。Bongers等[12]在研究指甲髌骨综合征患者临床表型与LMX1B基因突变关系时发现,基因突变患者中同源区比LIM区肾病发生率高。近期有文献报道,LMX1B在PNS患儿同源区中发生突变,且与激素治疗耐药有关[6],而LIM-B在已知LMX1B基因突变中占38%,同源区仅占18%[4]。目前尚无关于PNS患儿LIM-B基因突变的相关报道。研究发现,LMX1B基因突变会导致指甲髌骨发育异常、眼部疾病、肾脏损害以及神经系统症状[13];LMX1B基因多态性与青光眼、自闭症和精神分裂症等疾病有关[14~16],但其与肾脏疾病的关系鲜见报道。本研究对所有PNS患儿进行基因测序并未发现编码LIM-B区的第3外显子存在突变,提示PNS的发生可能与LIM-B无关。对该外显子的多态性分析发现,rs2277158位点多态性在正常人群与PNS患儿中的基因型分布及等位基因频率无统计学差异,表明该位点多态性可能与PNS发病无关。本研究激素治疗敏感与耐药患儿rs2277158位点基因型及等位基因频率比较无统计学差异,提示该位点多态性可能与糖皮质激素治疗反应无明显关系。目前,关于LMX1B基因突变导致肾脏疾病的机制尚不清楚,有学者认为是突变导致单体型剂量不足[17],但也有证据提示其突变会产生显性负作用从而导致相关疾病发生[18]。最近Lemley等[19]研究认为,LMX1B可能通过氨基酸序列和辅助作用因子调控不同靶基因,如R246及后面的氨基酸主要结合足细胞相关调控基因,而L226及之前氨基酸结合骨骼肌调控序列。白丽春等[6]发现的突变位点位置与此推测一致。因此,本研究在PNS患儿LIM-B区未发现突变的原因可能为LIM-B区不存在与肾脏疾病相关蛋白结合的位点。
本研究对LMX1B基因第3外显子进行测序分析,未发现PNS患儿LMX1B基因第3外显子存在突变,其LMX1B基因rs2277158位点多态性可能与儿童PNS的发生及其对糖皮质激素的治疗反应无关。由于本研究样本量较少,并且选取了LMX1B基因上的一个外显子进行测序分析,因而无法确定该基因其他外显子上是否存在突变,也无法确定该多态性位点与其他外显子多态性所构成的单体型与PNS的发生及糖皮质激素治疗反应的相关性。总之,LMX1B基因与儿童PNS 的相关性尚需进一步深入研究。
[1] Schwarz K, Simons M, Reiser J, et al. Podocin, a raft-associated component of the glomerular slit diaphragm, interacts with CD2AP and nephrin[J]. J Clin Invest, 2001,108(11):1621-1629.
[2] Miner JH, Morello R, Andrews KL, et al. Transcriptional induction of slit diaphragm genes by Lmx1b is required in podocyte differentiation[J]. J Clin Invest, 2002,109(8):1065-1072.
[3] Massella L, Gangemi C, Giannakakis K, et al. Prognostic value of glomerular collagen IV immunofluorescence studies in male patients with X-linked Alport syndrome[J]. Clin J Am Soc Nephrol, 2013,8(5):749-755.
[4] Marini M, Bocciardi R, Gimelli S, et al. A spectrum of LMX1B mutations in Nail-Patella syndrome: new point mutations, deletion, and evidence of mosaicism in unaffected parents[J]. Genet Med, 2010,12(7):431-439.
[5] Hari P, Mantan M, Dinda A, et al. Steroid-responsive nephrotic syndrome in a patient with nail-patella syndrome[J]. Pediatr Nephrol, 2006,21(8):1197-1199.
[6] 白丽春,覃远汉,黄韦芳,等.LMX1B基因突变检测对激素耐药型肾病综合征患儿的早期诊断价值[J].山东医药,2015,55(12):21-23.
[7] 中华医学会儿科学分会肾脏病学组.儿童常见肾脏疾病诊治循证指南(一):激素敏感、复发/依赖肾病综合征诊治循证指南(试行)[J].中华儿科杂志, 2009,47(3):167-170.
[8] Zhang LW, Wang LP. Recent advances in the research on mechanisms underlying podocyte-specific gene mutation-related steroid-resistant nephrotic syndrome[J]. Zhongguo Dang Dai Er Ke Za Zhi, 2014,16(1):99-102.
[9] Kopp JB. An expanding universe of FSGS genes and phenotypes: LMX1B mutations cause familial autosomal dominant FSGS lacking extrarenal manifestations[J]. J Am Soc Nephrol, 2013,24(8):1183-1185.
[10] Little MH, McMahon AP. Mammalian kidney development: principles, progress, and projections[J]. Cold Spring Harb Perspect Biol, 2012,4(5):a008300.
[11] Zhou TB, Ou C, Qin YH, et al. LIM homeobox transcription factor 1B expression affects renal interstitial fibrosis and apoptosis in unilateral ureteral obstructed rats[J]. Am J Physiol Renal Physiol, 2014,306(12):1477-1488.
[12] Bongers EM, Huysmans FT, Levtchenko E, et al. Genotype-phenotype studies in nail-patella syndrome show that LMX1B mutation location is involved in the risk of developing nephropathy[J]. Eur J Hum Genet, 2005,13(8):935-946.
[13] Ghoumid J, Petit F, Holder-Espinasse M, et al. Nail-Patella Syndrome: clinical and molecular data in 55 families raising the hypothesis of a genetic heterogeneity[J]. Eur J Hum Genet, 2016,24(1):44-50.
[14] Thanseem I, Nakamura K, Anitha A, et al. Association of transcription factor gene LMX1B with autism[J]. PLoS One, 2011,6(8):e23738.
[15] Bergman O, Westberg L, Nilsson LG, et al. Preliminary evidence that polymorphisms in dopamine-related transcription factors LMX1A, LMX1B and PITX3 are associated with schizophrenia[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2010,34(6):1094-1097.
[16] Park S, Jamshidi Y, Vaideanu D, et al. Genetic risk for primary open-angle glaucoma determined by LMX1B haplotypes[J]. Invest Ophthalmol Vis Sci, 2009,50(4):1522-1530.
[17] Bongers EM, de Wijs IJ, Marcelis C, et al. Identification of entire LMX1B gene deletions in nail patella syndrome: evidence for haploinsufficiency as the main pathogenic mechanism underlying dominant inheritance in man[J]. Eur J Hum Genet, 2008,16(10):1240-1244.
[18] Cross SH, Macalinao DG, McKie L, et al. A dominant-negative mutation of mouse Lmx1b causes glaucoma and is semi-lethal via LBD1-mediated dimerisation[J]. PLoS Genet, 2014,10(5):e1004359.
[19] Lemley KV. LMX1B mutations with nails and kneecaps: a new paradigm[J]. Nephrol Dial Transplant, 2014,29(1):9-12.
Association of LMX1B gene with primary nephritic syndrome in children
YUHaishao,LEIFengying,CHENXiuping,JIANGLing,QINYuanhan
(TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To investigate the associations between gene mutations and the polymorphisms in exon 3 of LIM homeobox transcription factor 1-beta (LMX1B) and primary nephritic syndrome (PNS) in children. Methods We studied 94 children with PNS (PNS group, 48 with glucocorticoid-sensitive, 46 with glucocorticoid-resistant) and 60 healthy controls (control group) to observe the genetic mutations in exon 3 of LMX1B gene and analyze the associations between the polymorphisms and PNS in the two groups by PCR-DNA direct sequencing. Results No gene mutations of the LMX1B gene but rs2277158 polymorphism and no significant difference either in genotypic or allelic frequencies of rs2277158 polymorphism were observed between PNS group and the control group (allP>0.05). Allele frequency and genotype distribution also showed no significant difference between the glucocorticoid-sensitive group and the glucocorticoid-resistant group (P>0.05). Conclusions There is no clear association between gene mutations and rs2277158 polymorphism in exon 3 of LMX1B gene and the risk for PNS in children. Rs2277158 polymorphism may not be associated with glucocorticoid treatment response in children with PNS.
primary nephritic syndrome; LMX1B gene; single nucleotide polymorphism; child
广西科学研究与技术开发计划课题资助项目(桂科攻1140003A-6)。
于海绍(1988-),男,硕士研究生,主要研究方向为小儿肾脏病基础与临床。E-mail: yhsgxykdx@163.com
覃远汉(1964-),男,主任医师,主要研究方向为小儿肾脏病基础与临床。E-mail: qinyuanhan603@163.com
10.3969/j.issn.1002-266X.2016.20.005
R692
A
1002-266X(2016)20-0015-03
2015-11-11)
