卵巢癌组织CXCL12、MMP-9、integrin β1表达及意义
2016-05-10刘静张柳杨勇李春燕郭华雄
刘静,张柳,杨勇,李春燕,郭华雄
(荆州市中心医院,湖北荆州434020)
卵巢癌组织CXCL12、MMP-9、integrin β1表达及意义
刘静,张柳,杨勇,李春燕,郭华雄
(荆州市中心医院,湖北荆州434020)
目的 探讨趋化因子CXCL12、基质金属蛋白酶9(MMP-9)及整合素β1(integrin β1)在卵巢癌发生、发展中的作用。方法 选取60例份卵巢癌组织、20例份卵巢交界性肿瘤组织及10例份卵巢良性肿瘤组织,采用免疫组化Envision法检测CXCL12、MMP-9及integrin β1阳性表达率,分析CXCL12、MMP-9及integrin β1阳性表达与卵巢癌患者临床病理参数的关系及卵巢癌组织中CXCL12、MMP-9、integrin β1表达的关系。结果 卵巢癌组织中CXCL12、MMP-9及integrin β1阳性表达率均高于卵巢交界性肿瘤组织及卵巢良性肿瘤组织(P均<0.01)。CXCL12阳性表达与卵巢癌临床分期、淋巴结转移及腹水有关(P<0.05或<0.01),MMP-9及integrin β1表达均与卵巢癌组织学分级、TNM分期、淋巴结转移及腹水有关(P<0.05或<0.01)。卵巢癌组织中CXCL12表达与MMP-9及integrin β1表达均呈正相关(r分别为0.328、0.332,P均为0.001),MMP-9表达与integrin β1表达呈正相关(r=0.447,P=0.000)。结论 卵巢癌组织CXCL12、MMP-9及integein β1均高表达,三者协同作用,共同促进卵巢癌的发生、发展。
卵巢肿瘤;趋化因子CXCL12;基质金属蛋白酶9;整合素β1
卵巢癌是妇科三大恶性肿瘤之一,病死率高,导致患者死亡的主要原因是种植转移。趋化因子CXCL12是由骨髓基质细胞产生的前B淋巴细胞活化因子,介导炎症反应,被认为是炎症趋化因子。研究发现,CXCL12与其特异性受体CXCR4结合构成CXCL12/CXCR4生物轴,对肿瘤的发生、发展具有重要的调控作用[1]。基质金属蛋白酶9(MMP-9)是一种能降解细胞外基质成分的重要蛋白水解酶,参与多种恶性肿瘤的侵袭转移过程。整合素β1(integrin β1)主要与细胞和间质黏附有关,与细胞基质成分相结合,激活整合素下游相关基因,在肿瘤侵袭转移中发挥重要作用。本研究检测卵巢癌组织CXCL12、MMP-9及integrin β1蛋白表达,探讨其在卵巢癌发生、发展中的作用。
1 资料与方法
1.1 临床资料 60例卵巢癌患者于2007~2013年于荆州市中心医院行手术治疗,患者年龄28~69岁、平均52.4岁,>50岁36例、≤50岁24例。术前均未行放化疗,术后均留取卵巢癌组织(卵巢癌组),均经病理检查证实诊断。组织学分型:浆液性癌45例,黏液性癌15例;参照女性生殖系统肿瘤WHO(2003年版)标准:高分化(G1)15例,中分化(G2)25例,低分化(G3)20例;根据国际妇产科联盟FIGO分期标准:Ⅰ 期10例,Ⅱ 期18例,Ⅲ 期27例,Ⅳ 期5例;伴有淋巴结转移28例;伴腹水且找到癌细胞32例(腹水阳性),无腹水或腹水未找到癌细胞28例(腹水阴性)。另外选取卵巢交界性肿瘤组织20例份(交界性肿瘤组)、卵巢良性肿瘤组织10例份(良性肿瘤组)作为对照。三组患者年龄具有可比性。
1.2 CXCL12、MMP-9及integrin β1表达检测 三组标本均经10%中性甲醛固定,常规脱水,石蜡包埋,行4 μm连续切片,采用Envision法进行免疫组织化学染色,以PBS代替一抗作为阴性对照,以已知阳性片作为阳性对照。具体操作步骤参照试剂盒说明书。结果判定标准:以细胞膜和细胞质呈黄色或棕黄色为CXCL12、MMP-9及integrin β1阳性表达。采用半定量-积分法对染色强度及阳性细胞数进行评分[2]。染色强度:阴性记0分,淡黄色记1分,棕黄色记2分,棕褐色记3分;阳性细胞数:无阳性细胞记0分,阳性细胞≤10%记1分,11%~50%记2分,51%~75%记3分,>75%记4分;染色强度评分和阳性细胞数评分乘积≥3判定为阳性。分析CXCL12、MMP-9及integrin β1表达与卵巢癌患者临床病理参数的关系及CXCL12、MMP-9、integrin β1表达之间的关系。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料组间比较采用χ2检验;相关性分析采用Spearman等级相关性分析法。P<0.05为差异有统计学意义。
2 结果
2.1 各组CXCL12、MMP-9及integrin β1表达 见表1。
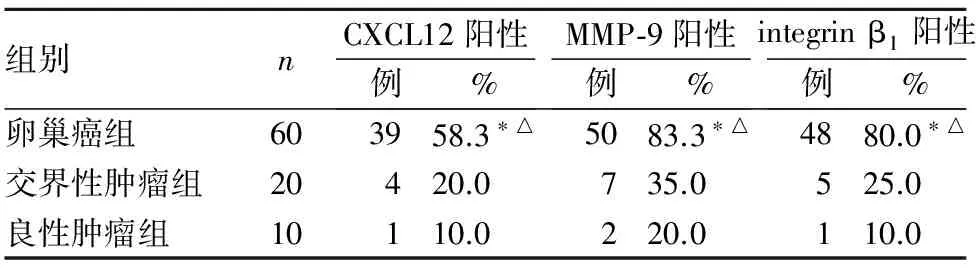
表1 三组CXCL12、MMP-9及integrin β1表达比较
注:与良性肿瘤组比较,*P<0.01;与交界性肿瘤组比较,△P<0.01。
2.2 卵巢癌组织中CXCL12、MMP-9及integrin β1阳性表达与患者临床病理参数的关系 见表2。

表2 卵巢癌组织中CXCL12、MMP-9及integrin β1表达与患者临床病理参数的关系
2.3 卵巢癌组织CXCL12、MMP-9、integrin β1表达之间的关系 卵巢癌组织中CXCL12表达与MMP-9及integrin β1表达均呈正相关(r分别为0.328、0.332,P均为0.001),MMP-9表达与integrin β1表达呈正相关(r=0.447,P=0.000)。
3 讨论
肿瘤的发生、侵袭、转移是一个主动的、有规律的过程,趋化因子在其中发挥重要作用[3]。趋化因子CXCL12是由68个氨基酸组成,属于CXC趋化因子家族成员。近年来研究发现,CXCL12除趋化作用外还可通过与其特异性受体结合形成生物轴,激活G蛋白介导的信号传导通路,从而促进肿瘤的发生、发展[4]。CXCR4特异性抑制剂AMD3100可阻断CXCL12诱导的信号传导通路[5]。Zhao等[6]研究显示,CXCL12在肿瘤的发生、发展过程中表现为双向调节作用,一方面通过促进细胞外基质的降解,促进肿瘤生长及发生浸润转移;另一方面通过趋化、活化免疫细胞捕获迁移中的肿瘤细胞或直接通过抑制血管增殖,发挥抗肿瘤作用。对胰腺癌的研究发现,CXCL12抑制胰腺导管癌的发生及发展[7]。本研究结果显示,CXCL12高表达促进卵巢癌的发生、发展,与Ghanem等[8]对肝癌的研究结果一致;其机制可能为CXCL12与其特异性受体CXCR4结合,激活G蛋白,使PI3K磷酸化,激活局部黏着酶(FAK),启动一系列信号传导通路[9]。整合素(integrins)是一类位于细胞表面的黏附分子,可介导细胞与细胞、细胞与基质间的反应,参与细胞信号传导、黏附及迁移,并调控细胞分化及增殖等多个生理过程[10]。本研究结果显示,integrin β1高表达参与卵巢癌的发生、发展,激活、调节癌细胞的黏附与迁移可能是其作用机制[11]。MMP-9在多种恶性肿瘤中高表达,通过降解基底膜中的Ⅳ型胶原和凝胶,促进肿瘤细胞发生侵袭转移[12]。本研究中卵巢癌组织MMP-9高表达促进卵巢癌的发生、发展,其机制可能为卵巢癌中MMP-9过表达破坏基底膜,进而促进卵巢癌细胞浸润转移。
本研究卵巢癌组织中CXCL12、integrin β1、MMP-9表达均呈正相关,提示三者之间具有协同作用,共同促进卵巢癌的发生、发展。CXCL12与其受体CXCR4结合后可激活细胞表面integrin β1,增强肿瘤细胞与细胞外基质之间的黏附,调节肿瘤细胞的运动与迁移,促进侵袭转移[13,14]。Laird等[15]研究发现,CXCL12可通过CXCR4/ERK/NF-κB信号传导促进MMP-9表达,或直接诱导肿瘤细胞分泌MMP-9,从而破坏肿瘤血管壁的基底膜,进而重塑血管、诱导新生血管生长,促进肿瘤发生浸润转移[15,16]。
综上所述,卵巢癌组织中CXCL12、MMP-9及integein β1表达均增加,三者之间协同作用,共同参与卵巢癌的发生、发展。
[1] Nagasawa T. CXCL12/SDF-1 and CXCR4[J]. Front Immunol, 2015,12(6):301-303.
[2] 邢传平,刘斌,董亮.免疫组织化学标记结果的判断标准方法[J].中华病理学杂志,2001,30(4):318.
[3] Peter G, Jorg H, Kerstin S, et al. CXCR4 regulates the early extravasation of metastatic tumor cells in vivo[J]. Neoplasia, 2009,11(7):651-661.
[4] Barbieri F, Thellung S, Wurth R, et al. Emerging targets in pituitary adenomas: role of the CXCL12/CXCR4-R7 system[J]. Int J Endocrinology, 2014,17(11):1-16.
[5] Domanska UM, Kruizinga RC, Nagengast WB, et al. A review on CXCR4/CXCL12 axis in oncology:no place to hide[J]. Eur J Cancer, 2013,49(1):219-230.
[6] Zhao S, Wang J, Qin C. Blockade of CXCL12/CXCR4 signaling inhibits intrahepatic cholangiocarcinoma progression and metastasis via inactivation of canonical Wnt pathway[J]. J Exp Clin Cancer Res, 2014,33(1):103-124.
[7] Roy I, Zimmerman NP, Mackinnon AC, et al. CXCL12 Chemokine expression suppresses human pancreatic cancer growth and metastasis[J]. PLoS ONE, 2014,9(3):1-13.
[8] Ghanem I, Riveiro ME, Paradis V, et al. Insights on the CXCL12-CXCR4 axis in hepatocellular carcinoma carcinogenesis[J]. Am J Transl Res, 2014,6(4):340-352.
[9] Sarvaiya PJ, Guo D, Ulasov I, et al. Chemokines in tumor progression and metastasis[J]. Oncotarget, 2013,4(12):2171-2185.
[10] Ginsberg MH. Integrin activation[J]. BMB Rep, 2014,47(12):655-659.
[11] Ponnala S, Chetty C, Veeravalli KK, et al. MMP-9 silencing regulates hTERT expression via β1integein-mediated FAK signaling and induces senescence in glioma xenograft cells[J]. Cell Signal, 2011,23(12):2065-2075.
[12] Wang J, Shi Q, Yuan TX, et al. Matrix metalloproteinase 9(MMP-9) in osteosarcoma: review and meta-analysis[J]. Clin Chim Acta, 2014,433(6):225-231.
[13] Wang B, Wang W, Niu W,et al. SDF-1/CXCR4 axis promotes directional migration of colorectal cancer cells through upregulation of integrin αvβ6[J]. Carcinogenesis, 2014,35(2):282-291.
[14] Hu TH, Yao Y, Yu S, et al. SDF-1/CXCR4 promotes epithelialmesenchymal transition and progression of colorectal cancer by activation of the Wnt/beta-catenin signaling pathway[J]. Cancer Lett, 2014,354(2):417-426.
[15] Laird SM, Widdowson R, El-Sheikhi M, et al. Expression of CXCL12 and CXCR4 in human endometrium; effects of CXCL12 on MMP production by human endometrial cells[J]. Hum Reprod, 2011,26(5):1144-1152.
[16] Kiss DL, Windus LC, Avery VM. Chemokine receptor expression on integrin-mediated stellate projections of prostate cancer cells in 3D culture[J]. Cytokine, 2013,64(1):122-130.
荆州市科技发展计划项目(2009-13-15)。
郭华雄(E-mail: ghx8361@163.com)
10.3969/j.issn.1002-266X.2016.28.017
R737.31
B
1002-266X(2016)28-0050-03
2015-11-05)
