革兰阳性菌、革兰阴性菌血流感染致脓毒症患者血清降钙素原水平变化及意义
2016-05-10邹秀丽吴铁军崔玉静田辉张喜红曲爱君田锁臣
邹秀丽,吴铁军,崔玉静,田辉,张喜红,曲爱君,田锁臣
(聊城市人民医院,山东聊城252000)
革兰阳性菌、革兰阴性菌血流感染致脓毒症患者血清降钙素原水平变化及意义
邹秀丽,吴铁军,崔玉静,田辉,张喜红,曲爱君,田锁臣
(聊城市人民医院,山东聊城252000)
目的 检测革兰阳性(G+)菌、革兰阴性(G-)菌血流感染致脓毒症患者血清降钙素原(PCT)水平变化,探讨其意义。方法 选取脓毒症患者124例,血细菌培养结果均阳性且为单一菌种,其中G-菌感染41例(G-菌组)、G+菌感染83例(G+菌组)。两组均在应用抗生素治疗前取血,计数WBC及中性粒细胞百分比(NEU%),采用酶联荧光法检测血清PCT及高敏C-反应蛋白(hs-CRP),进行急性生理与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、序贯器官衰竭(SOFA)评分,统计28天死亡率,采用受试者工作特征(ROC)曲线分析血清PCT、hs-CRP水平及WBC数量、NEU%鉴别脓毒症患者G+菌、G-菌血流感染的效能。结果 G+菌组血清PCT水平低于G-菌组(P<0.01),两组hs-CRP、WBC及NEU%比较差异无统计学意义(P均>0.05)。血清PCT水平诊断脓毒症患者G-菌血流感染的AUC为0.867(95%CI为0.789~0.946,P=0.000),敏感性为76.9%,特异性为89.2%;其余指标不能鉴别G+、G-菌血流感染。G-菌组的APACHEⅡ评分、SOFA评分及28天死亡率均高于G+菌组(P<0.05或<0.01)。G-菌组血清PCT水平与SOFA评分呈正相关(r=0.54,P<0.05)。结论 血清PCT水平可鉴别G-菌与G+菌血流感染而导致的脓毒症,且可反映病情严重程度及预测预后。
脓毒症;降钙素原;革兰阴性菌;革兰阳性菌;血流感染
脓毒症是由感染引起的全身炎性反应综合征(SIRS),病情凶险、病死率高。在导致脓毒症的各类感染中,血流感染被认为是影响脓毒症患者预后的重要因素。目前,临床常用降钙素原(PCT)、高敏C-反应蛋白(hs-CRP)等指标对脓毒症进行早期诊断及预后评估,但上述指标对快速鉴别血流感染致病菌种类的相关报道较少。本研究探讨革兰阳性菌(G+菌)、革兰阴性菌(G-菌)血流感染致脓毒症患者血清PCT水平变化及意义。
1 资料与方法
1.1 临床资料 选择2012年1月~2014年12月我院ICU收治的成年脓毒症患者124例,诊断标准参照2008国际严重脓毒症和脓毒症休克治疗指南[1]。均于应用抗生素前留取血标本,血细菌培养结果均阳性且为单一菌种(真菌、混合菌感染除外)。G-菌感染41例(G-菌组),男24例、女17例,年龄24~87(64.5±17.4)岁;G+菌感染83例(G+菌组),男55例、女28例,年龄23~94(58.8±17.9)岁;两组性别、年龄具有可比性。排除标准:应用刺激细胞炎症介质释放的药物,烧伤,小细胞肺癌,甲状腺癌,使用CD3单克隆抗体治疗,长期严重器官灌注异常。
1.2 相关指标观察 两组均在应用抗生素治疗前
行以下指标检测。①WBC数量及中性粒细胞百分比(NEU%):采用流式细胞术计数WBC及NEU%。②血清PCT、hs-CRP:采用酶联荧光法,试剂盒由梅里埃诊断产品(上海)有限公司提供,检测仪器为MINIVIDAS。③慢性健康状况评分系统Ⅱ(APACHEⅡ)评分、序贯器官衰竭(SOFA)评分:根据入ICU第一个24 h内最差的数据进行APACHEⅡ评分和SOFA评分,具体方法参照文献[1]。④ 28天死亡率:以患者28天转归情况为终点,计算死亡率。
2 结果
2.1 两组血清PCT、hs-CRP水平及WBC数量、NEU%比较 见表1。

表1 两组血清PCT、hs-CRP水平及WBC数量、NEU%比较[M(P25,P75)]
注:与G-菌组比较,*P<0.01。
2.2 血清PCT、hs-CRP水平及WBC数量、NEU%鉴别G+菌、G-菌血流感染的效能 以ROC曲线下面积(AUC)=0.5为界值,血清PCT水平诊断脓毒症患者G-菌血流感染的AUC为0.867(95%CI为0.789~0.946,P=0.000);PCT的最佳截断值为17.48 ng/mL,此时Youden指数最大为0.661,识别G-菌血流感染的敏感性为76.9%、特异性为89.2%。血清hs-CRP水平及WBC、NEU%不能鉴别脓毒症患者G+菌、G-菌血流感染。见表2。
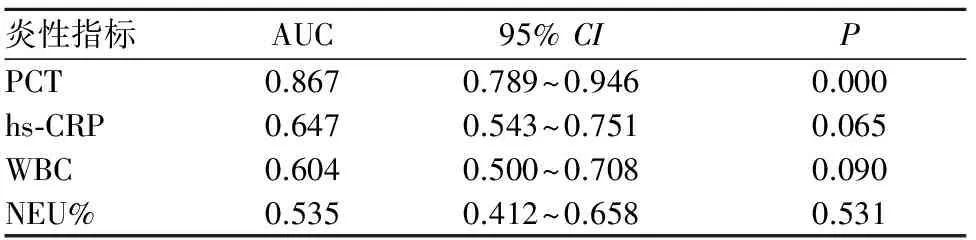
表2 血清PCT、hs-CRP水平及WBC、NEU%诊断脓毒症患者G-菌血流感染的 ROC结果
2.3 两组APACHE Ⅱ评分、SOFA评分及28天死亡率比较 G-菌组APACHEⅡ评分、SOFA评分均明显高于G+菌组(P均<0.05),见表3。G+菌组28天死亡5例、死亡率为6.02%,G-菌组分别为9例、21.95%,两组28天死亡率比较P<0.01。
2.4 血清PCT水平与APACHEⅡ评分、SOFA评分的相关性 G-菌组血清PCT水平与SOFA评分呈正相关(r=0.54,P<0.05),与APACHEⅡ评分不相关(P>0.05);G+菌组血清PCT水平与APACHEⅡ评分、SOFA评分均无关(P均>0.05)。

表3 两组APACHEⅡ评分、SOFA评分比较(分,
注:与G-菌组比较,*P<0.01。
3 讨论
细菌性血流感染是严重的全身性感染,病情可迅速进展,易发展为严重脓毒症和脓毒症休克,病死率较高[2]。血流感染早期可仅表现为发热,血培养阳性是诊断的“金标准”,但血培养耗时较长,阳性率较低,且培养过程受多种因素的影响,故对血流感染早期诊断有一定局限。
大规模的流行病学调查结果显示,G-菌血流感染致脓毒症患者病情更严重[3]。传统炎性指标如WBC、NEU%、hs-CRP等在诊断感染时有一定意义,但在鉴别致病菌种类方面价值有限。PCT是降钙素的前体蛋白质,当机体发生全身性感染时体内PCT水平显著升高[4,5]。其可用于鉴别急性细菌性感染和病毒性感染,对脓毒症的早期诊断及危重程度评估有重要价值,PCT水平越高提示病情越重、预后越差[6,7]。但目前PCT水平检测对区分G-菌和G+菌感染的报道较少,且结果不一。Charles等[8]研究显示,G-菌血流感染致脓毒症患者血清PCT水平显著高于G+菌血流感染者。Brodská等[9]发现,G-菌血流感染致脓毒症患者血清PCT水平高于G+菌组和真菌组。但Clec′h等[10]研究发现,37例G+菌血流感染和41例G-菌血流感染致脓毒症患者血清PCT水平比较差异无统计学意义。本研究结果显示,G-菌血流感染致脓毒症患者血清PCT水平明显高于G+菌血流感染者。G-菌细胞壁主要成分是脂多糖,当细菌自溶或黏附于其他细胞时产生大量内毒素释放入血,内毒素作为促炎细胞因子可二次刺激机体产生和释放PCT。Dandona等[11]观察到给健康志愿者体内注射内毒素可引起TNF、IL-6及PCT水平成倍增加,血PCT水平高峰延迟出现;提示内毒素可直接刺激血PCT释放。本研究中G-菌组、G+菌组血清hs-CRP水平比较无统计学差异,可能原因为hs-CRP半衰期长,机体受手术、外伤等单一刺激后hs-CRP水平升高,恢复到基线水平往往需要数天时间; hs-CRP特异性差,创伤、手术、烧伤、急性胰腺炎、炎性疾病、肿瘤、心肌梗死等均会引起hs-CRP水平升高[12]。本研究两组WBC数量和NEU%比较无明显统计学差异;原因可能为微生物感染时WBC数量可增多、减少甚至缺乏,且检测时操作不规范、不熟练也可影响细胞计数结果。相比hs-CRP、WBC数量、NEU%等传统炎症标志物,PCT在鉴别G-菌血流感染致脓毒症方面具有更高的敏感性和特异性, ROC曲线结果显示,其AUC为0.867,当PCT截断点为17.48 ng/mL时,其敏感性和特异性分别为76.9%、89.2%;提示PCT可用于诊断G-菌血流感染致脓毒症。
APACHE Ⅱ评分和SOFA评分是目前ICU中应用较为广泛的评估病情严重程度的评分系统。本研究结果显示,G-菌血流感染致脓毒症患者血清PCT水平与APACHE Ⅱ评分和SOFA评分均呈正相关,血清PCT水平可反映脓毒症患者病情严重程度及预后[13]。SOFA评分是一个动态描述脓毒症相关脏器功能障碍的量化评分指标。杜斌等[14]研究认为,SOFA评分可以较好地预测患者在ICU住院期间多器官功能障碍综合征的发生及预后。本研究中G-菌组的APACHE Ⅱ评分、SOFA评分均明显高于G+菌组,28天死亡率亦高于G+菌组,进一步提示G-菌血流感染致脓毒症患者病情更严重、预后更差;相关性分析结果显示,G-菌组血清PCT水平与SOFA评分呈正相关,提示血清PCT水平可反映G-菌血流感染所致脓毒症的危重程度。
总之,血清PCT水平可用于鉴别G-菌与G+菌血流感染而导致的脓毒症,且可反映病情严重程度及预测预后。
[1] 姚咏明,黄立锋,林洪远.《2008国际严重脓毒症和脓毒性休克治疗指南》概要[J].中国危重病急救医学,2008,20(3):135-138.
[2] Martin GS, Mannino DM, Eaton S, et al. The epidemiology of sepsis in the United States from 1979 through 2000[J]. N Engl J Med, 2003,348(16):1546-1554.
[3] Garrouste-Orgeas M, Timsit JF, Tafflet M, et al. Excess risk of death from intensive care unit acquired nosocomial blood-stream infections: a reappraisal[J]. Clin Infect Dis, 2006,42(8):1118-1126.
[4] Wrenger S, Kahne T, Bohuon C, et al. Amino-terminal truncation of procalcitonin, a marker for systemic bacterial infections,by dipeptidyl peptidase Ⅳ (DP Ⅳ)[J]. FEBS Lett, 2000,466(1):155-159.
[5] Russwurm S, Wiederhold W, Oberhofer M, et al. Procalcitonin as monocytic marker for eady diagnosis in septic abortion[J]. Z Geburtsh Neonatol, 2000,204(1):34-38.
[6] 余娅芬,陈德昌,宋秀琴.早期诊断严重脓毒症脓毒症休克研究进展[J].中国急救医学,2007,27(2):154-156.
[7] 王明刚,李春盛,杨军,等.降钙素原对危重症患者合并脓毒症早期诊断及预后预测的意义[J].中华全科医师杂志,2007,4(6):215-218.
[8] Charles PE, Ladoire S, Aho S, et al. Serum procalcitonin elevation in critically ill patients at the onset of bacteria caused by either gram negative or gram positive bactera[J]. BMC Infect Dis, 2008,8(38):1-8.
[9] Brodská H, Malícˇ ková K, Adámková V, et al. Significantly higher procalcitonin levels could differentiate Gram-negative sepsis from Gram-positive and fungal sepsis[J]. Clin Exp Med, 2013,13(3):130-146.
[10] Clec′h C, Ferriere F, Karoubi P, et al. Diagnostic and prognostic value of procalcitonin in patients with septic shock[J]. Crit Care Med, 2004,32(5):1166-1199.
[11] Dandona P, Nix D,Wilson MF,et al. Procalcitonin increase after endotoxin injection in normal subject[J]. J Clin Endocrinol Metab, 1994,6(79):1605-1608.
[12] Szalai AJ, VanCott JL, McGhee JR, et al. Human C-reactive protein is protective against fatal Salmonella enterica serovar typhimurium infection in transgenic mice[J]. Infect Immun, 2000,68(10):5652-5656.
[13] 王胜云,陈德昌.降钙素原和C-反应蛋白与脓毒症患者病情严重程度评分的相关性研究及其对预后的评估价值[J].中华危重病急救医学,2015,27(2):97-101.
[14] 杜斌,陈德昌,刘大为,等.感染相关的器官功能衰竭评分对多器官功能障碍综合征预后判断的意义[J].中华医学杂志,2001,81(2):78-81.
聊城市科学技术发展计划项目。
吴铁军(E-mail: tiejunwu@hotmail.com)
10.3969/j.issn.1002-266X.2016.28.027
R631
B
1002-266X(2016)28-0075-03
2015-12-08)
