鼻咽癌组织MTDH、MMP-9表达及意义
2016-05-10陈应超李泽文周洁肖兰刘汉忠
陈应超,李泽文,周洁,肖兰,刘汉忠
(孝感市中心医院,湖北孝感 432100)
鼻咽癌组织MTDH、MMP-9表达及意义
陈应超,李泽文,周洁,肖兰,刘汉忠
(孝感市中心医院,湖北孝感 432100)
目的 观察鼻咽癌组织异黏蛋白(MTDH)及基质金属蛋白酶9(MMP-9)的表达变化,探讨其意义。方法 采用免疫组化法检测60例份鼻咽癌组织(观察组)、26例份慢性鼻咽炎组织(对照组)中MTDH及MMP-9蛋白表达,并分析MTDH及MMP-9与鼻咽癌患者临床病理参数的关系,及二者表达的相关性。结果 观察组与对照组MTDH阳性表达率分别为53.3%(32/60)、11.5%(3/26),二者比较P<0.01;MMP-9阳性表达率分别为71.7%(43/60)、34.6%(9/26),二者比较P<0.01。MTDH阳性表达与鼻咽癌淋巴结转移及临床分期有关(P均<0.05),MMP-9阳性表达与鼻咽癌淋巴结转移有关(P<0.05)。鼻咽癌组织MTDH表达与MMP-9表达呈正相关(r=0.376,P<0.01)。结论 鼻咽癌组织中MTDH、MMP-9表达均升高,MTDH及MMP-9高表达可能在鼻咽癌的发生及转移过程中发挥重要作用。
鼻咽癌;异黏蛋白;基质金属蛋白酶9
鼻咽癌是我国发病率较高的恶性肿瘤之一,且具有高转移性的特征。异黏蛋白(MTDH)又称AEG-1、LYRIC、3D3,是近年来发现的一个癌基因,在多种人类肿瘤组织中高表达,被认为与肿瘤的侵袭、转移及预后不良有关[1]。基质金属蛋白酶9(MMP-9)是一种重要的蛋白水解酶,通过降解细胞外基质(ECM)及基底膜的重要成分参与肿瘤的侵袭和转移过程[2]。MTDH可通过调控MMP-9,在ECM降解、细胞侵袭及转移过程中发挥重要作用[3,4]。目前在鼻咽癌组织中MTDH、MMP-9的相关研究鲜见报道。本研究观察鼻咽癌组织中MTDH、MMP-9的表达变化,并探讨其意义。
1 资料与方法
1.1 临床资料 选择2010~2013年孝感市中心医院收治的鼻咽癌患者60例,男37例、女23例,年龄27~74(57.0±16.7)岁。均经病理学检查证实,术前均未行放、化疗。根据2002年美国联合委员会(AJCC)标准进行分期:T1、T2期26例,T3、T4期34例;无淋巴结转移24例,有淋巴结转移36例;临床分期Ⅰ期+Ⅱ期27例、Ⅲ期+Ⅳ期33例;60例活检标本均为低分化鳞状细胞癌。手术留取鼻咽癌组织60例份为观察组,另取同期慢性鼻咽炎组织26例份为对照组。对照组男15例、女11例,年龄22~72 (57.0±16.2)岁。两组性别比、年龄具有可比性。
1.2 MTDH、MMP-9表达检测 采用免疫组化SP法。MTDH兔抗人多克隆抗体(ZA-0346)、MMP-9兔抗人多克隆抗体(ZA-0336)、免疫组化试剂盒(SP-9000)、DAB显色试剂盒均购于北京中杉金桥生物技术有限公司。常规脱蜡、水化,4 μm连续切片;抗原修复:采用枸橼酸缓冲液(pH 6.0)高压下修复10 min,室温下3% H2O2封闭10 min;滴加MTDH抗体(1∶100)及MMP-9抗体(即用型) 4 ℃孵育过夜,滴加二抗,DAB显色、苏木精复染后脱水封片。染色结果判断:MTDH及MMP-9均以细胞质染色为主,以细胞质染成棕黄色或棕褐色为阳性。采用双盲法,结合阳性细胞率及显色程度进行半定量处理。阳性细胞率评分:阳性细胞率≤10%、>10%~50%、>50%~80%、>80%分别记0、1、2、3分。显色程度评分:无显色为0分、浅黄色为1分、棕黄色为2分、棕褐色为3分。以上两项评分之积<3分为阴性,≥3分为阳性[5]。分析鼻咽癌组织MTDH、MMP-9阴性表达与患者临床病理参数的关系,及二者表达的相关性。
1.3 统计学方法 采用SPSS13.0统计软件。计数资料比较采用χ2检验,相关性分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。
2 结果
观察组与对照组MTDH阳性表达率分别为53.3%(32/60)、11.5%(3/26),两组比较P<0.01;MMP-9阳性表达率分别为71.7%(43/60)、34.6%(9/26),两组比较P<0.01。MTDH阳性表达与鼻咽癌患者淋巴结转移及临床分期有关(P均<0.05),MMP-9阳性表达与鼻咽癌淋巴结转移有关(P<0.05)。鼻咽癌组织MTDH及MMP-9表达与患者临床病理参数的关系见表1。
相关性分析显示, 鼻咽癌组织MTDH表达与MMP-9表达呈正相关(r=0.376,P<0.01)。
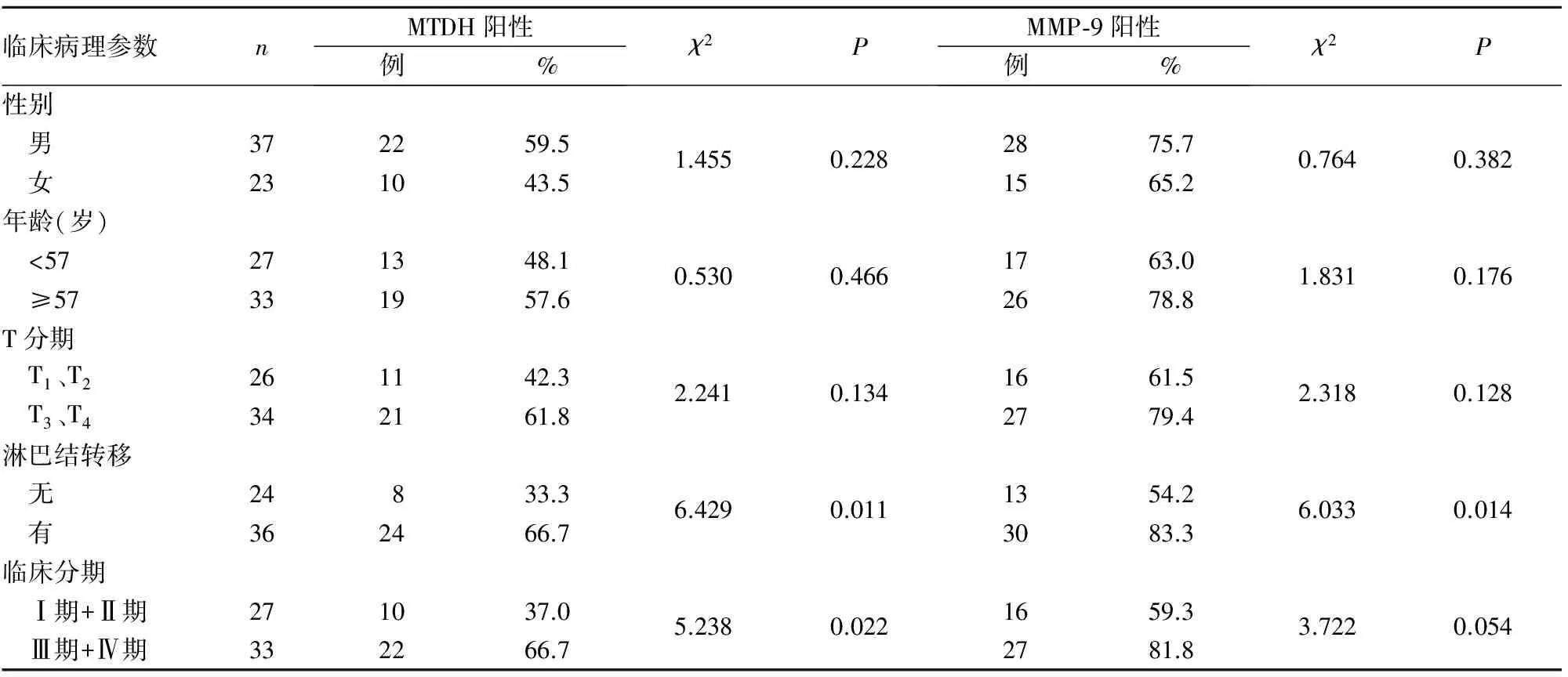
表1 鼻咽癌组织MTDH及MMP-9表达与患者临床病理参数的关系
3 讨论
MTDH基因定位于8q22染色体,包含12个外显子和11个内含子,总长度85 482 bp;通过PI3K/Akt、NF-κB、Wnt/β-catenin等信号通路促进肿瘤的发生、发展,包括启动肿瘤细胞的增殖与凋亡、增强肿瘤细胞的侵袭与转移、提高肿瘤细胞对化疗药物及放射线的耐受性等[1]。MTDH在正常组织中不表达或低表达,但在多种肿瘤如结肠腺癌[5]、食管鳞癌[6]、舌鳞癌[7]、胰腺癌[8]等组织中过表达。本研究观察组MTDH阳性表达率显著高于对照组,提示MTDH过表达与鼻咽癌的发生有关。MTDH的致癌活性与其对细胞增殖、凋亡的异常调节有关。研究发现,MTDH通过AKT/FOX03a信号通路影响细胞周期,上调CyclinD表达、下调p27表达,加速细胞的恶性增殖[6];MTDH通过PI3K/Akt信号通路,下调促凋亡蛋白BAD与p21表达、上调MDM2表达,导致抑癌基因p53失活,抑制细胞凋亡[9]。本研究显示,MTDH过表达与鼻咽癌淋巴结转移及临床分期有关,提示MTDH可作为评估鼻咽癌恶性程度及转移的分子指标之一。在食管鳞癌[6]、舌鳞癌[7]中亦发现,MTDH高表达与肿瘤的分化程度、TNM分期相关,是患者预后的独立影响因素。MTDH促进肿瘤恶性发展及转移的可能机制包括:①下调E-cadherin表达,促进上皮-间质转化(EMT),进而促进转移[8,10,11];②诱导MMPs表达,加速ECM降解[3~5];③促进新生血管形成[8,12]。
ECM及基底膜是阻碍肿瘤细胞侵袭和转移的主要屏障。MMP-9是降解基底膜及ECM的重要水解酶之一,通过降解其主要成分(如Ⅳ、Ⅴ型胶原和明胶等)参与肿瘤的侵袭和转移[2]。本研究观察组MMP-9阳性表达率显著高于对照组,且MMP-9阳性表达与淋巴结转移有关,证实了MMP-9在鼻咽癌发生及转移中的作用,与其他研究结果相似[13,14]。研究表明,过表达的MTDH可作用于MMP-9的启动子并激活MMP-9表达,抑制内源性MMP-9表达,显著降低MTDH对肿瘤细胞所产生的侵袭性影响[3]。在MTDH基因沉默的子宫颈癌细胞中,其瘤细胞的侵袭能力明显降低;下调MTDH表达后,MMP-9表达亦减少[4]。张伟等[5]应用免疫组化法检测了结肠腺癌中MTDH和MMP-9蛋白的表达,发现两者的表达呈正相关,认为两者可能协同促进结肠腺癌的发展。本研究鼻咽癌组织中MTDH与MMP-9的表达呈正相关,推测鼻咽癌组织MTDH过表达可能通过上调MMP-9表达为癌细胞向ECM侵袭提供前提条件。
总之,鼻咽癌组织中MTDH及MMP-9表达增加,二者高表达可能在鼻咽癌的发生及转移中发挥重要作用,但其具体调控机制有待进一步的研究。
[1] Luni E, Swadesh KD, Santanu D, et al. AEG-1/MTDH/LYRIC: signaling pathways, downstream genes, interacting proteins, and regulation of tumor angiogenesis[J]. Adv Cancer Res, 2013(120):75-111.
[2] Nascimento Dda C, Durigan Rde C, Tibana RA, et al. The response of matrix metalloproteinase-9 and -2 to exercise [J]. Sports Med, 2015,45(2):269-278.
[3] Liu LP, Wu JH, Ying Z, et al. Astrocyte elevated Gene-1 upregulates Matrix Metalloproteinase-9 and induces human glioma invasion[J]. Cancer Res, 2010,70(9):3750-3759.
[4] 秦瑞英,夏永华,任艳芳,等.AEG-1表达下调对子宫颈癌细胞细胞周期和侵袭能力的影响及其机制[J].中国病理生理杂志,2013,29(6):1020-1030.
[5] 张伟,方子乔,吉化春,等.结肠腺癌组织MTDH和MMP-9表达临床意义研究[J].中华肿瘤防治杂志,2015,22(10):786-795.
[6] Yu C, Chen K, Zheng H, et al. Overexpression of astrocyte elevated gene-1 (AEG-1) is associated with esophageal squamous cell carcinoma (ESCC) progression and pathogenesis[J]. Carcinogenesis, 2009,30(5):894-901.
[7] Ke ZF, He S, Li S, et al. Expression characteristics of astrocyte elevated gene-1 (AEG-1) in tongue carcinoma and its correlation with poor prognosis[J]. Cancer Epidemiol, 2013,37(2):179-185.
[8] 黄炎,柯儒斌,徐新伟,等.MTDH在胰腺癌中的表达及其与E-cadherin、 MVD的关系[J].肿瘤学杂志,2015,21(6):475-481.
[9] Lee SG, Su ZZ, Emdad L, et al. Astrocyte elevated gene-1(AEG-1) is a target gene of oncogenic Ha-ras requiring phosphatidylinositol 3-kinase and c-Myc[J]. Proc Natl Acad Sci U S A, 2006,103(46):17390-17395.
[10] Yu C, Liu Y, Tan H, et al. Metadherin regulates metastasis of squamous cell carcinoma of the head and neckvia AKT signalling pathway-mediated pepithelial-mesenchymal transition[J]. Cancer Lett, 2014,343(2):258-307.
[11] Liu K, Guo L, Miao L, et al. Ursolic acid inhibits epithelial-mesenchymal transition by suppressing the expression of astrocyte-elevated gene-1 in human nonsmall cell lung cancer A549 cells[J]. Anticancer Drugs, 2013,24(5):494-503.
[12] Emdad L, Lee SG, Su ZZ, et al. Astrocyte elevated gene-1 (AEG-1) functions as an oncogene and regulates angiogenesis[J]. Proc Natl Acad Sci U S A, 2009,106(50):21300-21305.
[13] 李智,林素暇,梁惠珍,等.鼻咽癌组织中巨噬细胞移动抑制因子和MMP-2、MMP-9表达的关系[J].临床与实验病理学杂志,2004,20(4):169-173.
[14] 陈应超,张少容,李里香,等.AKT2 S100A4及MMP-9在鼻咽癌组织中的表达[J].中国肿瘤临床,2010,37(8):444-447.
孝感市中心医院院内基金资助项目(201211)。
周洁(E-mail: cycpcy2001@sina.com)
10.3969/j.issn.1002-266X.2016.28.022
R739.6
B
1002-266X(2016)28-0063-03
2015-11-27)
