α-硫辛酸对早期糖尿病肾病患者肾功能的保护及对炎性反应、氧化反应的调节
2016-05-10柴雪妍
柴雪妍
·论著·
α-硫辛酸对早期糖尿病肾病患者肾功能的保护及对炎性反应、氧化反应的调节
柴雪妍
目的 研究α-硫辛酸对早期糖尿病肾病患者肾功能的保护作用及对炎性反应、氧化反应的调节作用。方法 选择收治的早期糖尿病肾病患者80例,随机分为联合治疗组和常规治疗组,每组40例。联合治疗组接受α-硫辛酸联合常规药物治疗,常规治疗组接受常规药物治疗;治疗后检测2组患者的肾功能指标、炎性和氧化反应指标。结果 联合治疗组患者的血清CysC、RBP含量低于常规治疗组(P<0.05);联合治疗组患者的血清hs-CRP、TNF-α、HMGB1、CCL2含量低于常规治疗组(P<0.05);联合治疗组患者的血清8-OHdG、MDA含量低于常规治疗组,SOD、GSH含量高于常规治疗组(P<0.05)。结论 α-硫辛酸联合常规治疗能够更为有效的保护肾功能、减轻炎性反应和氧化反应,在早期糖尿病肾病的治疗中展现出积极价值。
糖尿病肾病;α-硫辛酸;氧化反应;炎性反应
糖尿病肾病(diabetic nephropathy,DN)是2型糖尿病常见的微血管并发症,也是临床上终末期肾脏疾病最常见的原因。DN的发病机制复杂,糖基化终末产物堆积、多元醇旁路激活、细胞因子紊乱、脂质代谢异常、氧自由基损伤等均参与疾病的发生和发展。其中,氧化应激反应过度激活是近年来被广泛认知的DN发病机制之一,氧化应激反应所产生的氧自由基能够直接造成肾小球结构损伤,同时氧化应激反应也是其他病理缓解的共同通路[1]。因此,氧化应激反应的激活与DN的发生密切相关,减轻氧化应激反应对于DN的治疗以及肾功能的改善具有重要意义[2]。α-硫辛酸是一类具有抗氧化作用的物质,本研究分析α-硫辛酸对早期DN患者肾功能的保护作用及对炎性反应、氧化反应的调节作用。
1 资料与方法
1.1 一般资料 选择2012年5月至2014年8月在我院确诊为DN的80例患者纳入研究,纳入标准:(1)明确2型糖尿病的诊断;(2)24 h尿白蛋白排泄率30~300 mg;(3)获得医院伦理委员会批准;(4)患者知情同意。患者随机分为联合治疗组和常规治疗组,每组40例。联合治疗组采用α硫辛酸联合常规药物治疗,常规组采用常规药物治疗。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。
表1 2组患者一般资料比较 ±s
1.2 治疗方法 2组患者均接受常规对症治疗,包括降血糖治疗、改善肾功能、营养干预、运动干预等,降糖治疗方案根据患者情况给予口服降糖药物和(或)胰岛素治疗,将餐后2 h血糖控制在9.0 mmol/L以下、空腹血糖控制在7.0 mmol/L以下;改善肾功能的药物为ARB类药物,方法:氯沙坦钾片(杭州默沙东制药有限公司)50 mg/次,口服1次/d。联合治疗组在常规基础上加入α-硫辛酸,α-硫辛酸注射液(6 ml∶150 mg)12 ml 加入100 ml 0.9%氯化钠溶液中,静脉滴注,2次/d,连续使用8周。
1.3 检测试剂及仪器 酶联免疫吸附试剂盒为Roche公司,放射免疫沉淀试剂盒为南京建成生物公司;多功能酶标仪为Bio-tek公司。
1.4 检测方法 采集患者的空腹外周血,室温静置并离心后得到血清,采用酶联免疫吸附试剂盒检测胱抑素C(CysC)、视黄醇结合蛋白(RBP)、高敏C-反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)、高迁移率族蛋白1(HMGB1)、CCL2含量;采用放射免疫沉淀试剂盒检测8-羟脱氧鸟苷(8-OHdG)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱苷肽(GSH)。

2 结果
2.1 2组肾功能指标比较 治疗前2组患者的血清CysC、RBP差异无统计学意义(P>0.05);治疗后8周时,联合治疗组血清CysC、RBP低于常规治疗组,差异有统计学意义(P<0.05)。见表2。
表2 2组患者肾功能指标比较


组别治疗前CysCRBP治疗后CysCRBP联合治疗组5.42±0.71186.65±20.321.72±0.1962.62±8.62常规治疗组5.58±0.60185.79±19.492.95±0.32106.52±12.47t值0.1290.2527.8228.793P值>0.05>0.05<0.05<0.05
2.2 2组炎性反应指标比较 治疗前2组患者的血清hs-CRP、TNF-α、HMGB1、CCL2差异无统计学意义(P>0.05);治疗后8周时,联合治疗组血清hs-CRP、TNF-α、HMGB1、CCL2含量低于常规治疗组,差异有统计学意义(P<0.05)。见表3。
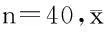
表3 2组患者炎性反应指标比较 ±s
2.3 2组氧化反应指标比较 治疗前2组患者的血清8-OHdG、MDA、SOD、GSH含量差异无统计学意义(P>0.05);治疗后8周时,联合治疗组患者的血清8-OHdG、MDA含量低于常规治疗组,SOD、GSH含量高于常规治疗组,差异均有统计学意义(P<0.05)。见表4。
表4 2组患者氧化反应指标比较


组别治疗前MDA8-OHdGGSHSOD治疗后MDA8-OHdGGSHSOD联合治疗组45.78±5.6262.22±7.5817.95±1.88114.59±12.5314.56±2.3119.62±2.4156.74±6.64312.52±36.34常规治疗组46.12±52963.09±6.9818.35±2.16116.12±13.1927.19±4.0233.39±5.5123.42±3.42188.45±21.62t值0.1040.2280.1740.3019.4948.68313.8226.977P值>0.05>0.05>0.05>0.05<0.05<0.05<0.05<0.05
3 讨论
DN是2型糖尿病患者最常见的并发症,也是临床上终末期肾脏疾病最常见的病因。近年来,越来越多关于DN发病机制的研究认为氧化应激反应增强与DN的发生密切相关,氧化应激反应所产生的氧自由基不仅能够直接造成肾小球损伤,还能够通过造成多元醇通路功能增强、糖基化终末产物蓄积、PKC通路激活[3]。因此,有学者认为氧化应激反应激活是造成DN发生和发展的上游因素,阻断或抑制氧化应激反应有助于控制DN的病情发展[4]。α-硫辛酸是一类具有抗氧化作用的药物,兼具脂溶性和水溶性的特性,经静脉进入体内后能够穿过磷脂双分子层并进入细胞内,在多个脏器和组织内发挥抗氧化应激的作用[5]。
本研究采用α-硫辛酸联合常规方案来治疗早期DN,希望能够通过α-硫辛酸的抗氧化应激效应来改善早期DN患者的病情,减轻肾脏功能损伤的进程。为了明确该治疗方案的效果,我们首先对肾功能指标进行了分析。血肌酐和尿素氮是临床评价肾功能的常用指标,但是受到肾脏自身代偿机制的影响,上述两项指标在肾功能损伤的早期并不会发生明显变化,因而不适用于早期DN治疗效果的评价。CysC和RBP是两类新发现的肾功能评价指标,CysC和RBP主要经由肾小球滤过和排泄;当肾小球发生损伤、血流灌注不足时,经由肾小球排泄的CysC和RBP减少,相应血清中的含量升高[6]。我们对血清中CysC和RBP的分析显示,联合治疗组患者的血清CysC、RBP含量低于常规治疗组(P<0.05)。由此说明α-硫辛酸对早期DN患者的肾功能具有保护作用。
在明确α-硫辛酸对肾功能的保护作用后,我们进一步对药物发挥作用的分子途径进行了深入分析。α-硫辛酸的重要药理作用是抗氧化应激,能够直接清除氧自由基并减轻入球小动脉内皮细胞、肾小球基底细胞受到的氧化损伤[7]。细胞内的生物结构受到氧自由基的攻击后会产生多种氧化产物,生物膜结构中的脂质分子发生氧化反应的产物是MDA、核糖核酸和脱氧核糖核酸发生氧化反应的产物是8-OHdG[8]。由氧化反应产物含量的分析可知:联合治疗组患者的血清8-OHdG、MDA含量低于常规治疗组。这说明α-硫辛酸能够减轻氧化应激反应。体内本身存在多种抗氧化物质,如SOD、GSH等,能够在一定范围内清除氧自由基,但是过度的氧化应激反应会大量消耗抗氧化物质[9]。α-硫辛酸在减轻氧化应激反应的同时,势必也能够减少抗氧化物质的消耗,我们的分析结果也同样证实:联合治疗组患者的血清SOD、GSH含量高于常规治疗组(P<0.05)。
有研究认为,氧化应激反应的激活多伴随炎性反应的增强,肾小球局部募集的炎性细胞能够合成和分泌多种炎性介质,进而通过损伤血管内皮细胞、刺激系膜细胞增殖等方式来造成肾小球血流灌注减少、机械屏障功能受损[10]。炎性细胞在局部的募集与氧自由基的损伤相关,而临床用于反应炎性反应程度的常用指标包括hs-CRP、TNF-α、HMGB1、CCL2。hs-CRP是一类非特异性急性时相反应蛋白,与炎性反应具有良好的一致性和相关性[11];TNF-α是炎性反应激活过程中最先发生改变的炎性因子,能够介导局部组织和细胞的炎性性损伤;HMGB-1是一类晚期炎性介质,其含量在炎性反应的中晚期持续升高;CCL-2是重要的内源性趋化因子,参与炎性细胞的招募以及炎性反应的级联放大[12]。我们对2组患者血清中炎性介质含量的分析可知:联合治疗组患者的血清hs-CRP、TNF-α、HMGB1、CCL2含量低于常规治疗组。说明α-硫辛酸治疗有助于减轻炎性反应程度。
综上所述,α-硫辛酸联合常规治疗能够更为有效的保护肾功能、减轻炎性反应和氧化反应,在早期DN的治疗中展现出积极价值。
1 Sauriasari R,Andrajati R,Azizahwati M,et al.Marker of lipid peroxidation related to diabetic nephropathy in Indonesian type 2 diabetes mellitus patients.Diabetes Res Clin Pract,2015,108:193-200.
2 Nosadini R,Tonolo G.Role of oxidized low density lipoproteins and free fatty acids in the pathogenesis of glomerulopathy and tubulointerstitial lesions in type 2 diabetes. Nutr Metab Cardiovasc Dis,2011,21:79-85.
3 Hakki I,Suher M.The relationship between the level of glutathione, impairment of glucose metabolism and complications of diabetes mellitus.Pak J Med Sci,2013,29:938-942.
4 云鹏,肖虎,龚婷,等. α-硫辛酸联合氯沙坦治疗早期糖尿病肾病的临床观察.中国医院药学杂志,2012,32:1035-1038.
5 Lin H,Ye S,Xu J,et al.The alpha-lipoic acid decreases urinary podocalyxin excretion in type 2 diabetics by inhibiting oxidative stress in vivo.J Diabetes Complications,2015,29:64-67.
6 梁丽娟,洪宝建,方亚奇,等.血清 CysC、RBP、NEFA 联合检测在2型糖尿病肾病早期诊断中的临床价值.中国卫生检验杂志,2015,25:524-526.
7 赵林双,向光大,杨李,等.8-羟基脱氧鸟苷酸和血管内皮生长因子与糖尿病肾病的关系.中国糖尿病杂志,2012,20:667-670.
8 周莉,陆卫平.糖尿病肾病患者血清趋化因子与氧化应激水平的相关性及α-硫辛酸的治疗作用.南京医科大学学报(自然科学版),2013,33:1435-1438.
9 Sedighi O,Makhlough A,Shokrzadeh M,et al.Association between plasma selenium and glutathione peroxidase levels and severity of diabetic nephropathy in patients with type two diabetes mellitus. Nephrourol Mon,2014,6:e21355.
10 Navarro-Gonzalez JF,Mora-Fernandez C,Murosde Fuentes M,et al.Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy.Nat Rev Nephrol,2011,7:327-340.
11 Hotamisligil GS.Endoplasmic reticulum stress and the inflammatory basis of metabolic disease.Cell,2010,140:900-917.
12 Dabhi B,Mistry KN.Oxidative stress and its association with TNF-α-308 G/C and IL-1α-889 C/T gene polymorphisms in patients with diabetes and diabetic nephropathy.Gene,2015,562:197-202.
10.3969/j.issn.1002-7386.2016.08.029
102413 北京市,中国核工业北京四〇一医院
R 587.24
A
1002-7386(2016)08-1209-03
2015-11-28)
