β-谷甾醇对人肺癌A549细胞增殖及凋亡的影响*
2016-05-10周玲玉王乐琴魏思宇练雪梅
周玲玉,徐 彩,王乐琴,魏思宇,卢 蕾,练雪梅
(1.重庆医科大学公共卫生与管理学院,营养与食品卫生学教研室,重庆 400016;
2.重庆医科大学脂质研究中心,重庆 400016)
·论 著·
β-谷甾醇对人肺癌A549细胞增殖及凋亡的影响*
周玲玉1,2,徐 彩1,2,王乐琴1,2,魏思宇1,2,卢 蕾1,2,练雪梅△
(1.重庆医科大学公共卫生与管理学院,营养与食品卫生学教研室,重庆 400016;
2.重庆医科大学脂质研究中心,重庆 400016)
目的 研究β-谷甾醇对A549细胞是否具有潜在的抗增殖和诱导凋亡作用。方法 不同浓度β-谷甾醇处理人肺癌A549细胞24h后,采用CCK-8法检测细胞的增殖抑制作用;流式细胞术检测A549 细胞周期分布及凋亡率的变化。结果 β-谷甾醇以剂量依赖性方式明显抑制A549细胞的生长;流式结果表明β-谷甾醇使A549 细胞阻滞在G2/M 期,同时促使A549细胞凋亡率的增加。结论 β-谷甾醇可诱导人肺腺癌A549细胞G2/M期细胞周期阻滞,并引起细胞凋亡性死亡。
β-谷甾醇; 肺癌; A549; 细胞周期; 细胞凋亡
肺癌是严重威胁人类生命健康的疾病,最新统计资料显示,肺癌是引起全球癌症死亡的首要原因[1-2],其中非小细胞肺癌(NSCLC),包括腺癌、鳞状细胞癌和大细胞癌,占所有肺癌的80%[3]。肺癌已成为我国增幅最快、最常见的恶性肿瘤,中国癌症控制计划已将肺癌的防治列为重点。尽管目前治疗方法较多,但肺癌的治疗效果却始终令人不满意,其5年生存率仍然较低[4]。更多的治疗方法正在被探索之中,以便提高肺癌5年生存率和治疗效果。目前通过蔬菜、水果、香料、茶叶、草本植物和药用植物中的植物化学物来控制癌症的发生发展已经成为最可行的方法。植物化学物是植物次生代谢物,由于它对慢性疾病包括癌症有潜在的预防作用而受到广泛关注。植物甾醇是一种与胆固醇结构相似的植物化学物,能够取代肠道低密度脂蛋白(LDL)胆固醇。坚果、花生、芝麻、大豆、未精炼的植物油和谷物都是植物甾醇的丰富来源[5]。常见的膳食植物甾醇有β-谷甾醇、菜油甾醇、豆甾醇,分别占50%~65%、10%~40% 和0%~35%。
研究显示,β-谷甾醇摄入量的多少与许多人类慢性病的发生率有关。目前研究证明,β-谷甾醇在降低血液胆甾醇含量、抑制肿瘤、防治前列腺肥大、抑制乳腺增生和调节免疫方面都有重要作用[6]。大量研究表明,β-谷甾醇作为潜在的天然药物,能有效预防多种肿瘤的发生和生长,以往的研究主要集中于β-谷甾醇抗乳腺癌、结肠癌、前列腺癌等方面,但对肺癌作用的报道很少,故本研究以人肺癌A549细胞为研究对象,对β-谷甾醇抗肺癌作用进行了初步探讨。
1 资料与方法
1.1 一般资料 人肺腺癌细胞株A549购于ATCC。
1.2 仪器与试剂 酶标仪(HIMFD,Gene Company Limited);超净工作台(SW-CJ-2F,苏州工业园三兴净化技术有限公司);CO2恒温培养箱(Eppendorf,CO170S-230-0000);倒置荧光显微镜(leica,DMI-4000B);生物安全柜(CMC,1384)。β-谷甾醇(Sigma,S9889-10 mg);RPMI 1640(Hyclone,SH3080001B);PBS磷酸盐缓冲液(Hyclone,SH3025601B);青链霉素混合液(Hyclone,CC0113);二甲基亚砜DMSO(sigma,D2650);小牛血清(GIBCO,16010-159);0.25%胰蛋白酶(Hyclone,SH30042.01);Cell Counting Kit-8(日本同仁化学,CK04);RT-PCR引物序列(华大科技)。
1.3 方法
1.3.1 细胞培养 A549细胞系培养于含10%小牛血清、1%双抗(青霉素100 U/mL,链霉素100 μg/mL)的RPMI 1640 培养基中,在37 ℃、体积分数为5%的CO2恒温培养箱中培养。细胞呈贴壁生长,3~4d传代,取对数生长期细胞进行实验。
1.3.2 细胞毒性检测 细胞毒性效应用CCK-8试剂盒检测。取对数生长期细胞,加细胞悬液(1×105cell/mL)100 μL每孔至96孔板(边缘用灭菌PBS填充),每组设置6个副孔。培养过夜,更换无血清培养基。饥饿12 h之后更换含β-谷甾醇(0、5、10、20、40 μmol/L)的培养基,同时设置空白对照组,培养24 h。每孔加入10 μL CCK-8溶液,37 ℃培养1~4 h,酶标仪测定450 nm波长各孔的吸光度。实验重复3次。细胞活力%=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.3.3 流式细胞仪检测细胞凋亡率 取对数生长期细胞,加细胞悬液(2×105cell/mL)1 mL每孔至6孔板,每组设置3个副孔,培养过夜,更换无血清培养基。饥饿12 h之后,用不同浓度β-谷甾醇(0、2.5、10、40 μM)处理24 h。细胞用不含EDTA的胰酶消化后,用PBS洗涤2遍,1 000 r/min离心5 min,加1 mL PBS重悬送流式细胞室进行细胞凋亡率检测。
1.3.4 流式细胞仪检测细胞周期 取对数生长期细胞,加细胞悬液(2×105cell/mL)1 mL每孔至6孔板,每组设置3个副孔,培养过夜,更换无血清培养基。饥饿12 h之后,用不同浓度β-谷甾醇(0、2.5、10、40 μM)处理24 h。细胞用胰蛋白酶消化之后,再用预冷PBS洗涤细胞两次,加1 mL -20 ℃ 70%的乙醇溶液重悬,4 ℃固定过夜。后送流式细胞室进行细胞周期检测。
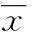
2 结 果
2.1 β-谷甾醇对A549细胞毒性的影响 CCK-8试剂盒检测A549细胞活性。β-谷甾醇处理A549细胞24 h后,显著抑制细胞增殖,且随着药物浓度的增加,其抑制作用逐步增强,呈明显的剂量-效应关系。与对照组相比,β-谷甾醇在5、10、20、40 μM剂量作用下的细胞活力分别为(67.82±5.43)%、(53.87±8.46)%、(50.03±3.26)%和(36.96±6.53)%,差异有统计学意义(P<0.01),见图1。

*:P<0.05,**:P<0.01,与对照组比较。
图1 β-谷甾醇对A549细胞的细胞毒性作用
2.2 β-谷甾醇对A549细胞周期的影响 流式细胞仪检测细胞周期结果显示,与对照组相比,2.5、10、40 μM β-谷甾醇实验组处理A549细胞24 h后,G2/M期细胞比例由对照组的(4.41±1.21)%增加至(5.58±2.30)%、(5.58±2.09)%、(9.60±1.74)%,差异有统计学意义(P<0.01)。结果说明β-谷甾醇诱导G2/M期细胞周期的阻滞,见图2。
2.3 β-谷甾醇对A549细胞凋亡的影响 流式Annexin-V/PI双染检测细胞凋亡率,结果如图3所示,0、2.5、10、40 μM β-谷甾醇实验组细胞凋亡率分别为(13.61±2.29)%、(16.15±3.02)%、(26.04±2.18)%、(49.72±1.83)%,与对照组相比差异有统计学意义(P<0.05)。因此,β-谷甾醇可诱导A549细胞凋亡且呈浓度依赖性。

图2 β-谷甾醇对A549细胞周期的作用

图3 β-谷甾醇对A549细胞凋亡的作用
3 讨 论
β-谷甾醇抗癌作用的动物实验表明,含有2%混合植物甾醇的饮食能抑制癌细胞的生长,减少肿瘤的大小,并降低结肠癌、乳腺癌、肝癌的发病率[7-10]。体外研究结果还表明,植物固醇,尤其是β-谷甾醇,对乳腺癌、结肠癌、肝癌、骨髓瘤和胰腺癌等均有抑制增殖和诱导凋亡的作用[11-16]。细胞周期调控异常和细胞凋亡是肿瘤生长不受控制及恶性转化的主要原因。β-谷甾醇对肺癌细胞的作用目前尚未见研究报道,故本文初步研究了β-谷甾醇对人肺癌细胞A549细胞增殖和凋亡的影响。
实验结果显示,不同浓度β-谷甾醇处理人肺癌A549细胞,细胞活性随药物浓度增加逐渐降低,从(67.82±5.43)%降至(36.96±6.53)%,表明β-谷甾醇对A549细胞具有明显的生长抑制作用,且呈显著的剂量依赖性。诱导肿瘤细胞周期阻滞以及引起细胞凋亡是天然药物抗肿瘤活性的重要机制[17]。细胞周期中G1/S、G2/M、M 中后期在调控细胞周期进展中发挥重要作用,其中G2/M期能防止受损或未完成复制的DNA 进入有丝分裂,并停留在G2期来修复DNA,故G2/M 期阻滞对肿瘤细胞显得尤为重要[18]。有研究发现,β-谷甾醇可诱导结肠癌、白血病、肝癌等肿瘤细胞发生G2/M期细胞周期的阻滞[19-21]。本研究流式细胞周期分析表明,在β-谷甾醇作用24 h后,G2/M期细胞百分比从(4.41±1.21)%增加到(9.6±1.74)%,说明A549细胞在G2/M期发生了阻滞。提示β-谷甾醇可通过诱导A549细胞周期阻滞从而抑制肿瘤细胞的增殖。
β-谷甾醇不仅能促使肿瘤细胞发生细胞周期阻滞,亦能诱导细胞程序性死亡,即细胞凋亡(APO),它是多细胞生物体维持组织完整性和功能,以及消除受损或不需要细胞的一个关键作用机制[22]。癌细胞凋亡作为一种潜在的治疗靶点近年来受到关注。癌细胞逃避细胞凋亡的过程中,细胞增殖率增加,最终导致肿瘤形成。凋亡失调与肿瘤的发生密切相关,在调亡机制上50%的肿瘤细胞存在缺陷。细胞凋亡在肿瘤发生、发展过程中主要起着负反馈调节作用,可以阻碍肿瘤细胞的迅速生长。凋亡过程主要由2个蛋白家族介导,即Bcl-2家族蛋白和caspase家族蛋白,并最终导致结构蛋白消化,DNA降解及细胞吞噬。细胞发生凋亡主要通过两个途径实现[23]:一是由促凋亡和抗凋亡因子介导的线粒体凋亡通路,二是细胞表面死亡受体通路。本实验通过流式凋亡率的检测,表明β-谷甾醇在0~40 μM范围内,以剂量依赖方式促进A549细胞凋亡,β-谷甾醇浓度越高,A549细胞凋亡率越大,与对照组相比差异有统计学意义(P<0.05)。
综上所述,本研究初步证实,一定浓度的β-谷甾醇可通过阻滞肺癌A549细胞周期于G2/M 期来抑制细胞增殖,同时促进细胞凋亡,发挥抗肿瘤作用。
[1]Siegel R,Naishadham D,Jemal A,et al.Cancer statistics[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Siegel R,Ward E,Brawley O,et al.The impact of eliminating socioeconomic and racial disparities on premature cancer deaths[J].CA Cancer J Clin,2011,61(2):12-36.
[3]Zarogoulidis K,Zarogoulidis P,Darwiche K,et al.Treatment of non-small cell lung cancer (NSCLC)[J].Journal of Thoracic Disease,2013,5(4):289-296.
[4]Blanco R,Iwakawa R,Tang M,et al.A gene-alteration profile of human lung cancer cell lines[J].Hum Mutat,2009,30(8):1199-1206.
[5]Bradford PG,Awad AB.Phytosterols as anticancer componds[J].Molecular Nutrition & Food Research,2007,51(2):161-170.
[6]Fernandez ML,Vega-López S.Efficacy and safety of sitosterol in the management of blood cholesterol levels[J].Cardiovasc Drug Rev,2005,23(1):57-70.
[7]Albert AB,Savarimuthu I,Gabriel MP,et al.Chemopreventive potential of β-Sitosterol in experimental colon cancer model-an in vitro and In vivo study[J].BMC Complementary and Alternative Medicine,2010,24(10):1472-1482.
[8] Awad AB,Downie AC,Fink CS,et al.Inhibition of growth and stimulation of apoptosis by β-sitosterol treatment of human breast cancer MDA-MB-231 cells in cultre[J].International Journal of Molecular Medicine,2000,5(5):541-545.
[9]Ju YH,Clausen LM,Allred KF,et al.β-sitosterol,β-sitosterol glucoside,and a mixture of β- sitosterol and β-sitosterol glucoside modulate the growth of estrogen-responsive breast cancer cells in vitro and in ovariectomized athymic mice[J].Journal of Nutrition,2004,134(10):1145-1151.
[10]Ki-Suk Kim,Hea Jung Yang,Jae-Youl Lee,et al.Effects of β-sitosterol derived from Artemisia capillaris on the activated human hepatic stellate cells and dimethylnitrosamine-induced mouse liver fibrosis[J].BMC Complementary and Alternative Medicine,2014,14(363):13724-13729.
[11]Young-Sang Kim,Xi-Feng Li,Kyong-Hwa Kang,et al.Stigmasterol isolated from marine microalgae Navicula incerta induces apoptosis in human hepatoma HepG2 cells[J].BMB Reports,2014,47(8):433-438.
[12]Shanthi SV,Raosaheb KK,Rana PS,et al.β-sitosterol induces G1 arrest and causes depolarization of mitochondrial membrane potential in breast carcinoma MDA-MB-231 cells[J].BMC Complementary and Alternative Medicine,2013,13(2):256-258.
[13]Albert AB,Savarimuthu I,Gabriel MP,et al.Cesheaercmh aroticple reventive potential of β-Sitosterol in experimental colon cancer model-an in vitro and in vivo study[J].BMC Complementary and Alternative Medicine,2010,10(24):2379-2381.
[14]程静,刘军权,陈复兴,等.β-谷甾醇对人自然杀伤细胞杀伤胰腺癌SW-1990细胞的影响[J].检验医学与临床,2012,9(24):3078-3082.
[15]Song Hyo Sook,Hyo-Jung Lee,Ji-Hyun Kim,et al.Reactive oxygen species-mediated activation of AMP-activated protein kinase and c-Jun N-terminal kinase plays a critical role in beta-sitosterol-induced apoptosis in multiple myeloma U266 cells[J].Phytotherapy Research,2014,28(3):387-394.
[16]Cheng DL,Guo ZQ,Zhang SL,et al.Effect of β-sitosterol on the expression of HPV E6 and p53 in cervical carcinoma cells[J].Contemporary Oncology,2015,19(1):36-42.
[17]Xavier CP,Lima CF,Pereira WC,et al.Lateolin,qaercetin and ursolic acid are potent inhibitors of proliferation and inducers of apoptosis in both KRAS and BRAF mutated human colorectal cancer cells[J].Cancer Lett,2009,281(2):162-170.
[18]Wang Y,Ji P,Zhang W,et al.Centrosome-associated regulators of the G(2)/M checkpoint as targets for cancer therapy[J].Molecular Cancer,2009,8(8):862-864.
[19]Jayaprakasha GK,Jadegoud Y,Nagana Gowda GA,et al.Bioactive compounds from sour orange inhibit colon cancer cell proliferation and induce cell cycle arrest[J].Journal of Agricultural and Food Chemistry,2010,58(1):180-186.
[20]Moon DO,Kim MO,Choi YH,et al.beta-Sitosterol induces G2/M arrest,endoreduplication,and apoptosis through the Bcl-2 and PI3K/Akt signaling pathways[J].Cancer Letters,2008,264(2):181-191.
[21]Li Q,Jiang C,Zu Y,et al.SFE-CO2extract from Typhonium giganteum Engl.tubers,induces apoptosis in human hepatoma SMMC-7721 cells involvement of a ROS-mediated mitochondrial pathway[J].Molecules,2011,16(10):8228-8242.
[22]Adams JM.Ways of dying:multiple pathways to apoptosis[J].Genes & de2elopment,2003,17(20);2481-2495.
[23]Lemaire M,Froment C,Botros R,et al.CDC25B phosphorylation by p38 and mk-2[J].Cell Cycle,2006,5(15):1649-1653.
Effect of β-sitosterol on proliferation and apoptosis of lung cancer cell line A549*
ZhouLingyu,XuCai,WangLeqin,LianXuemei△
(ChongqingMedicalUniversity,Chongqing400016,China)
Objective To investigate whether β-sitosterol possesses anti-proliferation and apoptosis inductive effect in A549 cells.Methods A549 cells were treated with various concentrations of β-sitosterol for 24 h.The cell proliferation inhibiting effect was measured by using the CCK-8 assay.The apoptosis rate and cell cycle distribution of A549 cells were detected by the flow cytometry method( FCM) after the treatment of β-sitosterol.Results β-sitosterol inhibited the growth of A549 cells in dose dependent manner.The FCM analysis results showed thatβ-sitosterol arrested A549 cells at the stage G2/M of cell cycle,meanwhile promoted the increase of A549 cells apoptosis rate.Conclusion β-sitosterol can induce the apoptotic cell death and G2/M arrest of human lung cancer A549 cells.
β-sitosterol; lung cancer; A549; cell cycle; cell apoptosis
国家自然科学基金资助项目(81071907);重庆自然科学基金资助项目(2011BB5128);教育部新世纪优秀人才支持计划(10-0997)。
周玲玉,女,硕士,主要从事肺癌与脂代谢研究。
△,E-mail:793585732@qq.com。
10.3969/j.issn.1673-4130.2016.07.001 文献标识码:A 文章编号:1673-4130(2016)07-0865-03
2015-12-18)
