纳米二氧化钛和铜对大型溞的联合毒性
2016-05-10殷亚远WANGChao朱小山吴乾元张文龙河海大学环境学院江苏南京0098香港高等教育科技学院香港特别行政区999077清华大学深圳研究生院广东深圳58055
李 轶,殷亚远,WANG Chao,朱小山,吴乾元,张文龙(.河海大学环境学院,江苏南京 0098;.香港高等教育科技学院,香港特别行政区 999077; .清华大学深圳研究生院,广东深圳 58055)
纳米二氧化钛和铜对大型溞的联合毒性
李轶1,殷亚远1,WANG Chao2,朱小山3,吴乾元3,张文龙1
(1.河海大学环境学院,江苏南京210098;2.香港高等教育科技学院,香港特别行政区999077; 3.清华大学深圳研究生院,广东深圳518055)
摘要:为进一步研究纳米二氧化钛(nTiO2)与铜(Cu(2+))的相互作用和生物效应,选取大型溞(Daphnia magna)为受试生物,研究nTiO2与Cu(2+)对Daphnia magna的联合毒性效应和Daphnia magna体内抗氧化系统的变化。结果表明,nTiO2与Cu(2+)对Daphnia magna的72 h半致死浓度(LC(50))和半抑制浓度(EC(50))分别为22.742mg/L、16.739mg/L和11.635μg/L、10.129μg/L。当nTiO2与Cu(2+)共存时,其联合作用的72 h-LC(50)和72 h-EC(50)分别为12.721mg/L、8.827mg/L和12.405μg/L、10.559μg/L。nTiO2与Cu(2+)联合作用于Daphnia magna后,Daphnia magna体内超氧化物歧化酶(SOD)和还原型谷胱甘肽(GSH)活性表现为先诱导后抑制,脂质过氧化的产物丙二醛(MDA)含量逐渐升高。这表明,机体的抗氧化体系受到活性氧自由基(ROS)攻击已经崩溃,无法为Daphnia magna提供保护,氧化伤害是nTiO2与Cu(2+)联合毒性的关键原因。
关键词:纳米二氧化钛;铜;大型溞;联合毒性效应;酶活性;体内抗氧化系统
纳米二氧化钛(titanium dioxide nanopartilces,nTiO2)是一种广泛应用于商业产品的人工纳米材料,比如化妆品、油漆、涂料和防晒霜等[1]。nTiO2的广泛应用,以及逐年增加的产量,使nTiO2不可避免地进入到水环境中。近年来,在地表水中已经可以检测到nTiO2(质量浓度为16μg/L)[2-3]。美国10个具有代表性的污水处理厂的进水nTiO2质量浓度为181~1233μg/L[4]。Federici等[5]发现,nTiO2能产生活性氧(ROS),导致细胞损伤。当彩虹鳟鱼(rainbow trout)暴露于低浓度(0.1mg/L、0.5mg/L和1mg/L)的nTiO2时,鱼体内的抗氧化酶活性产生变化。nTiO2进入水环境中会与环境中的污染物相互作用,从而会对污染物的毒性和迁移转化产生影响[6-9]。Yang等[6]研究发现nTiO2具有很强的吸附能力,促进了重金属(如Cd、As)在生物体内的富集,对水生生物产生潜在的威胁。目前已经有研究表明,即使是低浓度的nTiO2也会明显增强铜对大型溞(Daphnia magna,简写为D.magna)的毒性,且会促进铜在大型溞体内的累积[7]。但是,Rosenfeldt等[8-9]发现nTiO2会减轻铜对大型溞的毒性,这是由于Cu2+与nTiO2结合得很牢固,而且nTiO2快速地团聚且沉降,降低Cu的生物有效性。以上研究存在着矛盾,并且更多地研究较高浓度的纳米材料对污染物毒性效应的影响,未考虑到环境中纳米颗粒的实际浓度和生物体内抗氧化系统的变化[10-11]。为进一步探究nTiO2对Cu毒性的影响,本文考察两者共存时对模式生物大型溞的联合毒性效应以及溞体内酶活性的变化。通过研究更深入地理解MNMs潜在的健康风险,为MNMs的环境风险管理提供参考。
1材料与生物
1.1试验材料及储备液
nTiO2白色粉末购自南京埃普瑞纳米材料有限公司,平均粒径15 nm,锐钛矿型,纯度大于99.5%。其余试剂均为国产优级纯或分析纯,纯度均高于99.0%。玻璃仪器在使用前均用10%浓硝酸浸泡48h,并用去离子水冲洗干净,高温高压(121℃、15min)灭菌后待用。
试验体系是曝气3d的自来水,pH为7.8,总有机碳(TOC)为1.57mg/L,自来水中Ti、Cu、Cd和Pb的质量浓度分别为0、60 ng/L、70 ng/L、9ng/L(ICP-MS)。取0.25g nTiO2溶于250mL曝气3d的自来水中,超声10min后静置5min,反复3次,配成1g/L的nTiO2母液备用。
1.2受试生物及其培养
模式生物大型溞,由清华大学深圳研究生院水环境安全实验室提供,并参照国家标准方法[12]培养。培养温度23℃,光暗周期14 h∶10 h。每天定时投喂斜生栅藻(Scenedesmus obliquus),藻的培养参照文献[13]。
2试验方法
2.1nTiO2与Cu2+的单独毒性试验
D.magna毒性试验方法参照国家标准方法[12]。首先配制nTiO2/Cu2+试验液:用曝气3d的自来水逐级稀释nTiO2/Cu2+母液,得到一系列不同浓度的试验液(nTiO2质量浓度分别为0、0.5mg/L、1mg/L、5mg/L、10mg/L、15mg/L;Cu2+质量浓度分别为0、5μg/L、7.5μg/L、10μg/L、12.5μg/L、15μg/L)。每个浓度组设置3个平行样,每个试验平行组将10头5日龄D.magna放入盛有50 mL溶液的烧杯中,将装有溶液的烧杯置于摇床上培养[12-14]。烧杯用封口膜封口避免溶液蒸发,同时在封口膜上开5~6个小孔以满足D.magna生长的需要。每24 h观察一次,并且为了更准确判断nTiO2的毒性,连续观察72 h[14]。试验结束后,计算72 h-LC50和72 h-EC50。
2.2nTiO2与Cu2+的联合毒性试验
考虑到实际环境中nTiO2的质量浓度为10~1000μg/L[2-3,6],并且参照之前nTiO2与Cu2+单独毒性试验得到的最大无观察效应浓度(NOEC),设置nTiO2质量浓度为0.1mg/L,Cu2+质量浓度分别为0(对照)、5μg/L、7.5μg/L、10μg/L、12.5μg/L、15μg/L;Cu2+质量浓度为1μg/L,nTiO2质量浓度分别为0(对照)、0.5mg/L、1mg/L、5mg/L、10mg/L、15mg/L。其他试验方法与单独毒性试验一致。
2.3酶活性及蛋白含量的检测
72 h试验结束后,取50头D.magna,用生理盐水冲洗干净,滤纸吸干,将溞体小心移入已称重的1.5mL的离心管中,称重测得溞体的湿重,加入一定体积预冷匀浆液(0.01mol/L蔗糖,0.000 1mol/L EDTA-2Na,0.01mol/L Tris-HCI,pH=7.4),得到质量体积浓度为1%的溞体匀浆液。然后迅速转移到玻璃匀浆器中匀浆。再以10000 r/min离心10min取上清液待测。蛋白含量、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)酶活性和脂质过氧化物(LPO)的测定采用南京建成生物研究所试剂盒测定。
3结果与讨论
3.1nTiO2与Cu2+对D.magna的单独毒性
图1(a)表明低浓度(0.5mg/L、1mg/L)组中D.magna的活性未受到抑制,但是在高浓度(5mg/L、10mg/L、15mg/L)组,nTiO2明显抑制了D.magna的活动,甚至出现死亡。由于主要考察nTiO2在较低浓度时对D.magna的影响,本次试验各浓度抑制率和死亡率均低于50%,因此按照标准的EPA Tsk法[15],可大致算得nTiO2对D.magna的72 h-LC50和72 h-EC50值的范围(表1)。图1(b)表明随着浓度增大,Cu2+对D.magna的活动抑制作用逐渐增强,严重地会出现死亡现象,呈现明显的剂量效应关系。按照标准的EPA Probit法[15],可得到Cu2+对D.magna的72 h-LC50和72 h-EC50值(表1),与已有的研究保持一致[16-17]。
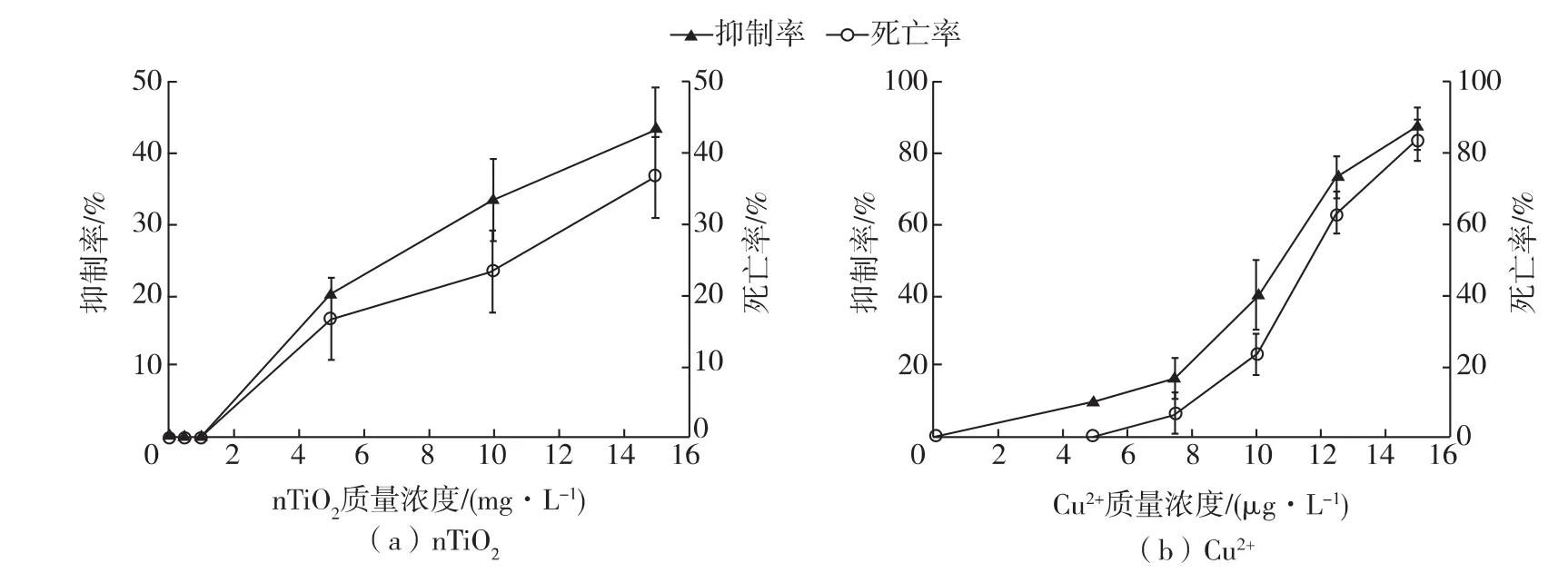
图1 nTiO2与Cu2+分别对D.magna的72h活动抑制和致死效应Fig.1Separate effect of nTiO2and Cu2+on 72h immobilization or mortality of D.magna
3.2nTiO2与Cu2+对D.magna的联合毒性效应
联合毒性试验中D.magna的72 h-LC50和72 h-EC50值见表1。图2(a)表明当Cu2+的质量浓度为1μg/L时,nTiO2的毒性显著增强(p<0.05);图2(b)表明当nTiO2质量浓度在0.1mg/L时,Cu2+在较低浓度(5μg/L、7.5μg/L、10μg/L)时,毒性有所增强,但在高浓度(12.5μg/L、15μg/L)时,毒性却降低了(p<0.05)。这可能与纳米材料和污染物的相互作用有关。nTiO2能够吸附大量的重金属离子,从而降低溶液中的自由金属离子,如果nTiO2未进入生物体内,便会导致毒性降低;当吸附有金属离子的nTiO2进入生物体内,那么金属离子的累积和毒性就会改变。
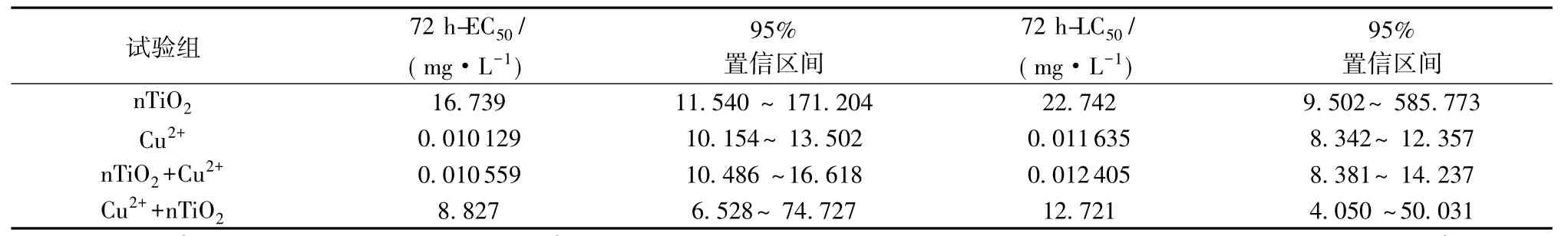
表1 D.magna的72 h-EC50和72 h-LC50值Table 172 h-EC50和72 h-LC50values of D.magna
3.3D.magna体内SOD酶活性的变化
生物体内SOD等酶类抗氧化系统能保护细胞免受活性氧自由基(ROS)的损伤,在抗氧化平衡中起着至关重要的作用[18]。图3(a)表明,随着nTiO2浓度的增加,SOD活性缓慢升高,然后下降。当1μg/L Cu2+和不同浓度nTiO2共存时,SOD活性迅速升高,然后下降(p<0.05)。图3(b)表明,随着Cu2+浓度的增加,SOD活性迅速升高,然后下降。当0.1mg/LnTiO2和不同浓度Cu2+共存时,SOD活性变化趋势与Cu2+单独作用时类似(p<0.05)。这可能是nTiO2和Cu2+相互作用后,迫使机体产生超氧自由基()等活性氧物质,SOD活性增强去除,随着继续增加的ROS对SOD酶蛋白的攻击,最终使SOD活性随之降低[19]。
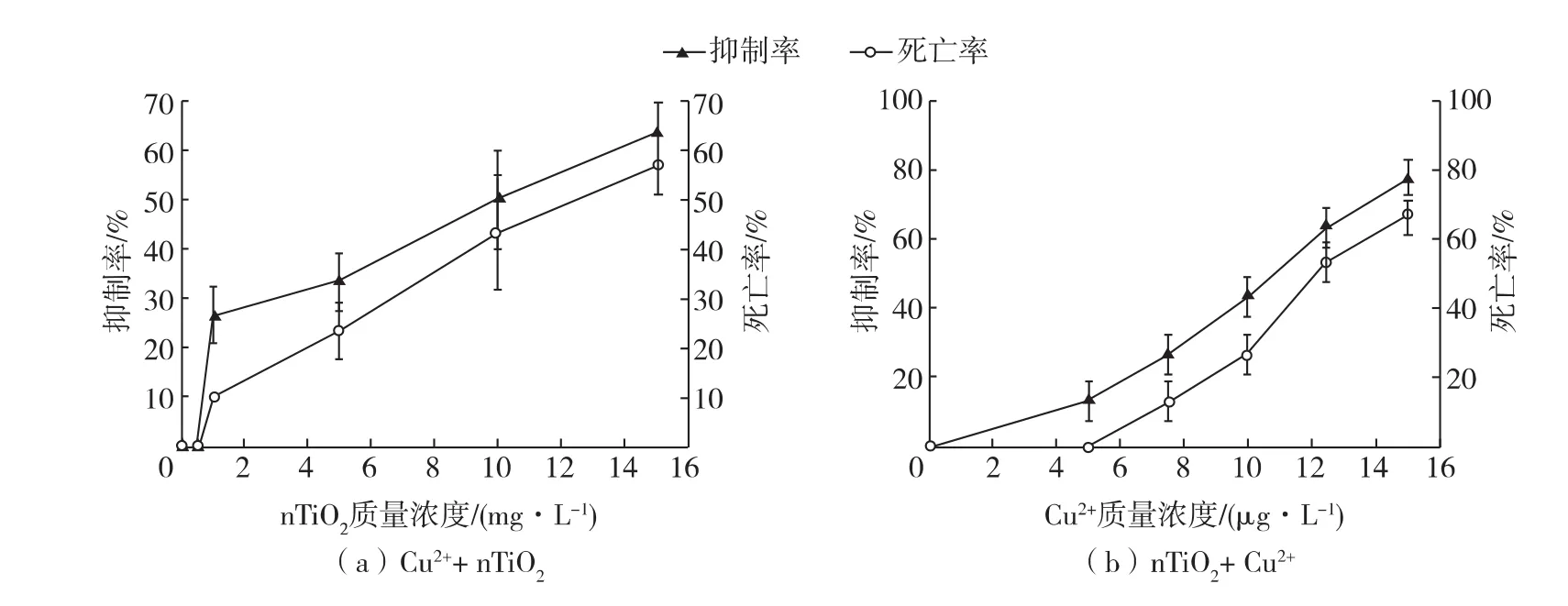
图2 nTiO2和Cu2+混合后对D.magna的72h活动抑制和致死效应Fig.2Joint effect of nTiO2and Cu2+on 72h immobilization or mortality of D.magna

图3 nTiO2和Cu2+对D.magna SOD的影响Fig.3Effect of nTiO2and Cu2+on SOD activity of D.magna
3.4D.magna体内MDA含量变化
氧化伤害表现为氧自由基攻击生物膜,引发脂质过氧化,而MDA是这一过程的产物,因而MDA可以反映机体内脂质过氧化的程度[20]。图4(a)表明,随着nTiO2浓度的增加,MDA含量逐渐升高。当1μg/L Cu2+和不同浓度nTiO2共存时,1mg/L、5mg/L、10mg/L、15mg/L nTiO2浓度组的酶活性均显著高于对照组,而且Cu2+和不同浓度nTiO2共存时,会加重nTiO2对D.magna的脂质过氧化伤害(p<0.05)。图4(b)表明,随着Cu2+浓度的增加,MDA含量逐渐升高。当0.1mg/L nTiO2和不同浓度Cu2+共存时,MDA含量变化趋势与Cu2+单独作用时类似。
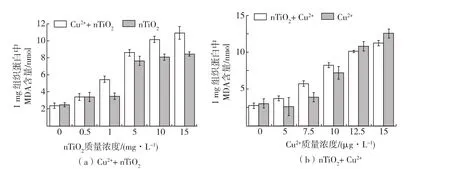
图4 nTiO2和Cu2+对D.magna MDA的影响Fig.4Effect of nTiO2and Cu2+on MDA content of D.magna
3.5D.magna体内GSH含量的变化
GSH能够清除D.magna体内的活性氧,还可以在谷胱甘肽硫转移酶的催化下与污染物结合,降低毒性[21]。图5(a)表明,随着nTiO2浓度的增加,GSH含量升高,然后下降。当1μg/L Cu2+和不同浓度nTiO2共存时,GSH含量迅速升高,然后下降。0.5mg/L、1mg/L、5mg/L、10mg/L、15mg/L nTiO2浓度组的GSH含量均显著高于对照组,当nTiO2浓度大于0.5mg/L后,D.magna体内GSH含量就开始下降(p<0.05),这表明,Cu2+和不同浓度nTiO2共存时,会加重nTiO2对D.magna的氧化伤害。图5(b)表明,随着Cu2+浓度的增加,GSH含量逐渐升高。7.5μg/L、10μg/L、12.5μg/LCu2+浓度组的GSH含量均显著高于对照组,当Cu2+质量浓度大于7.5μg/L后,GSH含量下降;当0.1mg/L nTiO2和不同浓度Cu2+共存时,GSH含量变化趋势与Cu2+单独作用时类似(p<0.05)。
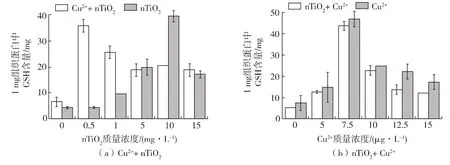
图5 nTiO2和Cu2+对D.magna GSH的影响Fig.5Effect of nTiO2and Cu2+on GSH content of D.magna
4结 论
D.magna暴露于nTiO2或Cu2+溶液中,SOD和GSH的活性开始逐渐增加,随后逐渐降低;MDA的含量明显增加。当D.magna暴露于nTiO2和Cu2+混合溶液中,D.magna体内酶活性的变化趋势与上述现象类似,但可以看出nTiO2和Cu2+相互作用后对D.magna体内酶活性的影响比nTiO2和Cu2+单独作用时更大。nTiO2可能导致重金属Cu毒性的增强,也有可能起到毒性减弱的作用。nTiO2和Cu2+相互作用后可能通过产生ROS攻击D.magna引起氧化伤害的途径,引发毒性。
参考文献:
[1]CHEN X,MAO S S.Titanium dioxide nanomaterials:synthesis,properties,modifications,and applications[J].Chemical Review,2007,107:2891-2959.
[2]KAGIR,ULRICH A,SINNET B.Synthetic TiO2nanoparticle emission from exterior facades into the aquatic environment[J].Environmental Pollution,2008,156(2):233-239.
[3]TAN Cheng,FANWenhong,WANGWenxiong.Role of titanium dioxide nanoparticles in the elevated uptake and retention of cadmium and zinc in Daphniamagna[J].Environmental Science and Technology,2011,46(1):469-476.
[4]KISER M A,WESTERHOFF P,BENN T.Titanium nanomaterial removal and release from wastewater treatment plants[J].Environmental Science and Technology,2009,43(17):6757-6763.
[5]FEDERICIG,SHAW B J,HANDY R D.Toxicity of titanium dioxide nanoparticles to rainbow trout(Oncorhynchusmykiss): Gill injury,oxidative stress,and other physiological effects[J].Aquatic Toxicology,2007,84(4):415-430.
[6]YANGWeiwan,WANG Ying,HUANG Bin,et al.TiO2Nanoparticles Act As a Carrier of Cd Bioaccumulation in the Ciliate Tetrahymena thermophile[J].Environmental Science and Technology,2014,48(13):7568-7575.
[7]FANWenhong,CUIminming,LIU Hong,et al.Nano-TiO2enhances the toxicity of copper in natural water to Daphniamagna [J].Environmental Pollution,2011,159(3):729-734.
[8]ROSENFELDT R R,SEITZ F,SCHULZ R,et al.Heavy metal uptake and toxicity in the presence of titanium dioxide nanoparticles:a factorial approach using daphniamagna[J].Environmental Science and Technology,2014,48:6965-6972.
[9]ROSENFELDTRR,SEITZF,SENNL.Nanosizedtitaniumdioxidereducescoppertoxicity:theroleoforganicmaterialandthe crystallinephase[J].EnvironmentalScienceandTechnology,2015,49(3):1815-1822.
[10]KLAPERR,CRAGOJ,BARRJ.Toxicitybiomarkerexpressionindaphnidsexposedtomanufacturednanoparticles:changesin toxicitywithfunctionalization[J].EnvironmentalPollution,2009,157(4):1152-1156.
[11]GRIFFITTRJ,LUOJ,GAOJ.Effectsofparticlecompositionandspeciesontoxicityofmetallicnanomaterialsinaquatic organisms[J].EnvironmentalToxicologyandChemistry,2008,27(9):1972-1978.
[12]国家环境保护局.GB/T13266—1991.水质物质对蚤类(大型蚤)急性毒性测定方法[S].北京:中国标准出版社,1991.
[13]华汝成.单细胞藻类培养与利用[M].北京:农业出版社,1987.
[14]ZHUX,CHANGY,CHENY.ToxicityandbioaccumulationofTiO2nanoparticleaggregatesinDaphniamagna[J].Chemosphere,2010,78(3):209-215.
[15]朱小山.几种人工纳米材料的生态毒理学研究[D].天津:南开大学,2007.
[16]KIMKT,KLAINESJ,LINSJ,etal.Acutetoxicityofamixtureofcopperandsingle-walledcarbonnanotubestoDaphnia magna[J].EnvironmentalToxicologyandChemistry,2010,29(1):122-126.
[17]TAOXJ,HEYL,FORTNERJD,etal.Effectsofaqueousstablefullerenenanocrystal(nC60)oncopper(tracenecessary nutrientmetal):EnhancedtoxicityandaccumulationofcopperinDaphniamagna[J].Chemosphere,2013,92(9):1245-1252.
[18]GERACITANOL,MONSERRATJM,BIANCHINIA.Physiologicalandantioxidantenzymeresponsestoacuteandchronic exposureofLaeonereisacuta(Polychaeta,Nereididae)tocopper[J].JournalofExperimentalMarineBiologyandEcology,2002,277(2):145-156.
[19]GAETKELM,CHOWCK.Coppertoxicity,oxidativestress,andantioxidantnutrients[J].Toxicology,2003,189:147-163.
[20]罗义.氯酚类和四溴双酚-A诱导鲫鱼活性氧产生及分子致毒机制的研究[D].南京:南京大学,2006.
[21]王震宇,赵建,李娜,等.人工纳米颗粒对水生生物的毒性效应及其机制研究进展[J].环境科学,2010(6):1409-1418.(WANGZhenyu,ZHAOJian,LINa,etal.Reviewofecotoxicityandmechanismofengineerednanoparticlestoaquatic organisms[J].EnvironmentalScience,2010(6):1409-1418.(inChinese))
·简讯·
第十四届中国水论坛将在长春市召开
为更好地研讨和解决中国面临的水问题,在国内众多专家的支持和努力下,中国水论坛已经成功举办了十三届学术研讨会。由中国自然资源学会水资源专业委员会、中国地理学会水文地理专业委员会、中国水利学会水资源专业委员会等主办的第十四届中国水论坛将于2016年8月25—27日在吉林省长春市召开。
第十四届中国水论坛将以“面向未来的水安全与可持续发展”为主题,针对国家水安全战略需求以及国际水科学前沿问题开展广泛、深入研讨,尽力搭建好2016年度水科学问题学术交流平台,为我国经济社会可持续发展和生态文明建设的水安全保障提供智力支撑。论坛主要议题:变化环境下水循环演变与水资源配置、水文气象预测及其应用、江河湖库湿地水系的水量-水质-水生态联合调控、地下水管理与污染修复、农业水资源高效利用技术与模式、洪涝干旱对水系统的影响及适应性、水-能源-粮食-生态耦合机制与调控、城市水管理理论方法与技术、国际河流水资源开发与保护、水资源风险管理与安全保障。
(本刊编辑部供稿)
Joint toxicity of titanium dioxide nanoparticles and copper on Daphnia magna
LIYi1,YIN Yayuan1,WANG Chao2,ZHU Xiaoshan3,WU Qianyuan3,ZHANG W enlong1
(1.College of Environment,Hohai University,Nanjing 210098,China; 2.Faculty of Science and Technology,Technological and Higher Education Institute of Hong Kong,Hong Kong 999077,China; 3.Graduate School at Shenzhen,Tsinghua University,Shenzhen 518055,China)
Abstract:To understand the interaction of titanium dioxide nanoparticles(nTiO2)and copper(Cu(2+))and their biological effects,using Daphniamagna as a test animal,we studied the joint toxicity effects of nTiO2and Cu(2+)on Daphnia magna and its internal antioxidant system.The results show that the respective values of 72 h-LC(50)and 72 h-EC(50)of Daphnia magna exposed to nTiO2were 22.742 and 16.739mg/L and the values of Daphnia magna exposed Cu(2+)were 11.635 and 10.129μg/L.When nTiO2and Cu(2+)coexisted,the respective values of 72 h-LC(50)and 72 h-EC(50)of Daphniamagna exposed to nTiO2were 12.721 and 8.827mg/L and the values of Daphniamagna exposed to Cu(2+)were 12.405 and 10.559μg/L.When Daphniamagna were exposed to both nTiO2and Cu(2+),the activity of superoxide dismutase(SOD)and reduced glutathione(GSH)was first induced and then inhibited,and themalondialdehyde(MDA)content produced during lipid peroxidation increased gradually.This indicated that the antioxidant system had been attacked by reactive oxygen species(ROS),and it could not provide protection for Daphnia magna,which was the key reason for the joint toxicity of Cu(2+)and nTiO2.
Key words:nTiO2;Cu;Daphnia magna;joint toxicity;enzyme activity;internal antioxidant system
作者简介:李轶(1975—),男,江苏盐城人,教授,博士,主要从事污水处理与资源化、水环境治理与修复和水资源保护研究。E-mail:envly @hhu.edu.cn
基金项目:国家自然科学基金(51322901,51479066);水体污染控制与治理科技重大专项(2012ZX07506-002-2)
收稿日期:2015-09-30
DOI:10.3876/j.issn.1000-1980.2016.02.001
中图分类号:X171.5
文献标志码:A
文章编号:1000-1980(2016)02-0095-06
