水稻显性脆秆突变体Bc 18的鉴定和基因定位
2016-05-09彭应财刘文真傅亚萍王鹤潼胡国成陈温福徐正进
彭应财刘文真傅亚萍王鹤潼胡国成陈温福徐正进,*
(1沈阳农业大学农学院,沈阳110866;2中国水稻研究所,杭州310006;#共同第一作者;*通讯联系人,E-mail:xuzhengjin@126.com)
水稻显性脆秆突变体Bc 18的鉴定和基因定位
彭应财1,2,#刘文真2,#傅亚萍2王鹤潼1胡国成2陈温福1徐正进1,*
(1沈阳农业大学农学院,沈阳110866;2中国水稻研究所,杭州310006;#共同第一作者;*通讯联系人,E-mail:xuzhengjin@126.com)
彭应财,刘文真,傅亚萍,等.水稻显性脆秆突变体Bc18的鉴定和基因定位.中国水稻科学,2016,30(2):127-135.
摘 要:从三交组合Ⅱ-32B//协青早B/Dular的F2群体中获得了1个脆性突变体,整个植株表现全生育期脆性。根据该突变体的表型,将其命名为Bc18(Brittle culm 18)。为了更好地鉴定该突变体,用正常茎秆强度品种中9B作轮回亲本与Bc18杂交,创制了Bc18脆秆近等基因系中脆B和中9B。表型鉴定显示,突变体Bc18在生育期、株高、单株穗数、每穗粒数、结实率和千粒重等主要农艺和产量性状上与野生型中9B无显著差别,但茎、叶的机械强度分别下降了70.70%和47.16%。细胞壁组分分析表明,突变体Bc18茎、叶的纤维素和木质素含量与野生型中9B无显著差异,但半纤维素含量分别提高了31.84%和17.35%。6个杂交组合F2和12个回交BC1F1群体的遗传分析证明Bc18脆性突变由单显性基因控制。采用图位克隆技术,构建了Bc18/02428和Bc18/9311的F2定位群体,并利用网上公布的SSR标记和新设计的InDel标记,最终将Bc18基因定位在第1染色体长臂端InDel标记PBC22与PBC33之间约154kb的区间内。
关键词:水稻;Bc18;显性脆秆;机械强度;半纤维素含量;基因定位
水稻茎秆强度是一个非常重要的农艺性状,与水稻的抗倒伏、产量、米质和品种的适应性密切相关,是超级稻育种的重要考核指标之一。水稻脆性突变,一方面导致茎秆机械强度显著降低,影响水稻的抗倒伏性和栽培适应性;另一方面,脆性突变导致茎叶细胞壁的组分改变和适口性增加,使其有望成为动物饲料的原材料[1-2],甚至成为提取生物能源乙醇的宝贵资源[3-4]。
水稻脆性突变体的研究始于20世纪60年代。自1963年Nagao等[5]首次报道水稻脆茎突变体bc1以来,已鉴定了20多个水稻脆性突变。,这些脆秆突变体大多数由隐性单基因控制,只有Bc6和nbc(t)由显性基因控制,其中Bc6由半显性单基因控制[6],nbc(t)为双显性基因控制[7]。利用脆秆突变体,克隆了一系列脆秆相关基因。OsCesA4、OsC-esA7、OsCesA9编码纤维素合酶催化亚基,在功能上并不冗余,可能形成一个纤维素合酶复合体参与次生细胞壁合成[8]。bc7与bc11是等位基因,均是由纤维素合酶基因OsCesA4突变产生[9-10]。fp2突变体为OsCesA7基因发生了错义突变,导致植株矮小,叶片披垂,机械强度明显下降,生长缓慢,纤维素减少了75%,木质素减少了68%,半纤维素和硅质则增加了31%和30%[11]。Bc6、bc88、dwf1、S1-60 和bc13为等位基因,均是OsCesA9基因发生了突变,其中Bc6在第7外显子的高度保守区发生了错义突变,导致第588个氨基酸由精氨酸变为亮氨酸,茎秆纤维素含量降低了38%,半纤维素含量增加了34%[6];bc88在第5外显子的第1784位点发生碱基代换,错义突变导致第421个氨基酸由脯氨酸变为亮氨酸,植株矮化,秧苗期叶片萎蔫,生育期延迟,根短,分蘖减少,茎秆纤维素含量只有野生型的60%(鲜质量)[12-13];dwf1在第7外显子上产生的错义突变,导致植株变矮,叶片披垂,纤维素和木质素含量下降,半纤维素含量增加,叶片机械强度下降了83%[14];S1-60在第5跨膜区域发生的错义突变,导致植株矮化、育性下降,纤维素含量只有野生型的44.7%,机械强度下降[15];bc13则在第551位点发生了错义突变(G变为A),编码的氨基酸由谷氨酸变为赖氨酸,位于N-末端锌指之后富含酸性氨基酸残基区域,导致植株机械强度只有野生型的1/3,细胞壁变薄,纤维素含量比野生型降低了22%,部分维管束木质部坍塌或导管数量变多但大小不均匀,地上部分镉(Cd)积累减少,耐镉能力增强[16]。BC1基因编码一个主要在水稻的厚壁组织和维管束中表达的类-cobra蛋白,与纤维素微纤丝的组装和纤维素结晶密切相关,BC1基因突变不仅可以降低细胞壁厚度和纤维素含量,还增加了木质素的含量[17-18]。BC3基因编码OsDRP2B蛋白,调节细胞的跨膜运输,影响纤维素合酶OsCesA4在质膜上的丰度,BC3基因突变干扰了细胞壁纤维素的合成,导致植株根、茎、叶纤维素含量降低了28%~36%[19-20]。BC10基因编码一个定位在高尔基体的Ⅱ型内整合膜蛋白,具有糖基转移酶的活性,通过调节细胞壁纤维素合成和阿拉伯半乳聚糖蛋白含量,控制水稻的机械强度[21]。BC12基因编码一个马达蛋白kinesin4,这是一个双靶向定位蛋白,在细胞核和细胞质中均有分布,参与次生细胞壁的生物合成和细胞周期进程,细胞数目显著减少导致了突变体植株矮化,纤维素微纤丝排列异常和细胞壁组分改变导致脆性突变[22]。BC14与OsNST1是等位基因,编码一个具有尿苷二磷酸-葡萄糖(UDP-Glucose)转运活性的核糖转运子(NSTs),该转运子定位于高尔基体内,调控细胞壁多糖生物合成过程中底物的跨膜运输,参与细胞壁多糖及糖蛋白构建[23-24]。BC14/OsNST1基因的错义突变引起纤维素含量下降,细胞壁结构改变,导致植株机械强度降低和生长发育缺陷。BC15/OsCTL1基因编码一个定位在高尔基体上Ⅱ型跨膜类几丁质酶蛋白,错义突变引起厚壁组织细胞壁变薄和纤维素含量降低,机械强度严重下降,但生长发育未受到显著影响[25]。Li等[26]通过T-DNA插入水稻突变体库,筛选到了一个软秆脆茎突变体fc1,植株变矮(株高只是野生型的80%),茎秆软且不能直立,结实率和千粒重下降,生育期延长,第1、2节间的机械强度降低到野生型的34%~28%,纤维素含量为野生型的86%,木质素含量为野生型的82%,FC1编码一个肉桂醇脱氢酶,主要在厚壁组织的次生细胞壁和维管束中表达。此外,已染色体定位但还有待克隆或确定功能的脆性基因有位于第2染色体的dfr[27]、dbc1[28],位于第5染色体的bc2[29-30],位于第6染色体的bc4[31]、734[32],位于第9染色体的ncb(t)[7]、fld1[33]等。这些研究结果表明,水稻植株表现脆性主要是由细胞壁组分(特别是纤维素含量降低)或结构发生变化引起的,细胞壁形成过程中的某一个环节出现问题均有可能导致脆性突变的产生。
本研究从新品种选育过程中三交组合Ⅱ-32B//协青早B/Dular的F2群体获得一个茎、叶、穗和种子均表现脆性的突变体Bc18,通过农艺和产量性状、细胞壁组分、茎叶机械强度等方面的研究揭示了Bc18突变体的生物学特性,并利用图位克隆技术对Bc18进行基因定位,旨在为克隆该基因和研究显性脆秆水稻的分子机理奠定基础,为谷草两用脆秆杂交稻新品种培育提供种质资源。
1 材料与方法
1.1 试验材料
在三交组合Ⅱ-32B//协青早B/Dular的F2群体中发现一个脆秆单株,通过连续10代自交选择后获得了水稻脆性突变体。根据突变体的表型,将该突变体命名为Bc18(Brittle culm 18)。
因突变体Bc18来源于三交组合Ⅱ-32B//协青早B/Dular,三交组合的各个亲本与突变体Bc18均有一定的亲缘关系,但却不适合作为突变体的野生型用于对比。因此,用Bc18作为脆性基因供体,中9B作为受体和轮回亲本创制了该脆秆性状的近等基因系中脆B(Bc18)和中9B。突变体和野生型植株如无特别说明均来自该近等基因系。
1.2 农艺性状和产量构成调查
2008-2009年,结合脆秆杂交稻配合力比较试验,调查突变体Bc18及其野生型中9B的主要农艺和产量性状。采用随机区组设计,每区组设置11个小区,重复3次,每小区种植10行,每行15株,行株距20cm×27cm,单本插。记载各个小区的生育期,成熟期从小区第3行、第3株开始调查连续10个单株的株高、单株有效穗数,再按10个调查单株的单株平均有效穗数取样2株考查穗长、每穗总粒数、实粒数、结实率、千粒重,每小区实割测产110株。
1.3 植株机械强度测定
分别挖取成熟期突变体Bc18和野生型中9B 各3~5株,挑选没有病虫害、粗细比较接近的茎秆各10个,取倒2节间上部约12cm长的茎秆片段放在WZL-300B卧式电脑拉力仪上进行抗张力测试,参数设定如下:ω=0.05g/m2;夹距=50mm;速度v=10mm/min,在显示器上读取抗张力数值(牛,N)。按同样的测试方法,取健康无病的倒2叶10片,在靠近叶片基部总长度的1/3处取12cm长的叶片放在电脑拉力仪上测定叶片的抗张力。以抗张力的测定值代表测试样品的机械强度。
1.4 细胞壁组分分析
取抽穗期的叶片与茎秆,105℃下杀青1h,然后65℃下烘24h,粉碎后过40目筛,装入样品袋备用。采用Van Soest法测定细胞壁组分含量的技术原理[34],利用丹麦FOSS公司生产的Fibertec 2010型纤维素测定仪测定样品的纤维素、半纤维素和木质素含量。
1.5 脆秆突变体Bc18的遗传
选用3个籼稻保持系(中9B、Ⅱ-32B、协青早B)和3个恢复系(明恢63、密阳46、中恢218),分别与原始突变体Bc18进行杂交及回交,建立F2群体和BC1F1回交群体。采用超稀直播法播种,每个F2群体播种2000~3000粒,回交群体播种200~300粒。出苗后大约2叶1心时,对2粒谷挨在一起或过密之处的单株进行间苗。在群体绝大部分单株成熟时,采用人工折断法进行脆与非脆单株的鉴定。
1.6 Bc18脆秆基因分子定位
1.6.1 构建定位群体
用原始突变体Bc18分别与粳稻品种02428和籼稻品种9311杂交建立F2群体。采用人工折断法,抽穗期进行第一次植株脆性鉴别,成熟期进行第二次脆性确认,两次鉴别均表现野生型(02428或9311)的非脆秆单株用于Bc18基因的定位。
1.6.2 水稻总DNA的提取和PCR检测分子标记的多态性
参照卢扬江和郑康乐的方法,稍作修改后提取水稻DNA[35]。PCR体系包括20ng/μL模板DNA 2μL,1μmol/L SSR引物2μL,10×PCR缓冲液1.5μL,1μmol/L dNTP 0.8μL,5U/μL Taq酶0.3μL,ddH2O 8.4μL。PCR扩增程序如下:94℃下预变性5min;94℃下变性1min,55℃~58℃下退火1min,72℃下延伸1min,35个循环;再在72℃下延伸10min。PCR产物采用8%聚丙烯酰胺凝胶电泳,银染法显色后直接观察分子标记的多态性。
1.6.3 Bc18脆秆基因的定位
选取均匀分布在水稻12条染色体上的256对SSR引物,对野生型亲本02428、9311分别与原始突变体Bc18进行多态性分析。根据两亲本间分子标记的多态性,确定用于基因定位的分子标记和F2群体。在确定Bc18基因在染色体上的位置后,将国际水稻基因组测序计划完成的日本晴基因组序列和中国华大基因研究中心完成的9311草图序列作BLAST分析(http://www.ncbi.nlm.nih.gov/BLAST/Genome/PlantBlast.shtml),找出日本晴和9311之间的差异序列,用引物设计软件Primer Premier 5.0设计新的InDel引物。利用新设计的引物和更多的定位单株,通过染色体步移最终确定Bc18基因所在的区域。
2 结果与分析
2.1 突变体Bc18及其近等基因系的获得与纯化
在杂交水稻三系不育系的选育过程中,从三交组合Ⅱ-32B//协青早B/Dular的F2群体中发现一个茎秆、稻穗容易断裂的单株,后代繁种出现茎秆脆与不脆分离。从中选择茎秆表现最脆,株叶形态较好的单株留种。经过连续10代自交加代和人工选择,获得一个谷壳金黄色,茎、叶、穗和种子很容易折断的单株群体,根据突变体的表型将其命名为Bc18(曾用名:ZGBCR1)。
以Bc18作为脆性基因供体,正常茎秆强度的籼稻保持系中9B作为受体和轮回亲本,杂交后再连续回交3次,获得了Bc18脆秆性状的近等基因系中脆B(Bc18)和中9B(野生型),并以此近等基因系进行突变体Bc18相关性状的鉴定。
2.2 突变体Bc18的主要农艺和产量性状
突变体Bc18田间表现与野生型相似。两者播始历期相同,株高也十分接近。突变体的茎粗(茎秆外径)略小于野生型,但秆壁的厚度较野生型稍大;突变体的叶片略长于野生型,但叶片变窄、叶厚增加。统计学分析显示,所有这些性状在突变体和野生型之间均无显著差异(表1)。
连续两年三次重复区组比较试验,突变体Bc18的单株有效穗数、每穗总粒数、每穗实粒数、穗长、着粒密度与野生型基本一致;结实率略高于野生型,千粒重比野生型略低,但差异不显著;实测小区产量两者没有明显差异(表2)。

表1 突变体Bc18及其野生型的主要特征特性(2008年,杭州)Table 1.Major agronomic traits of Bc18 and its wild type in Hangzhou,2008.

表2 突变体Bc18与及其野生型的产量与产量构成(2008-2009年,杭州)Table 2.Yields and yield components of Bc18 and its wild type in Hangzhou,2008-2009.
以上结果说明,Bc18脆性突变对植株的生长发育没有明显影响,农艺和产量性状没有变劣。

A、B、C和D分别为突变体Bc18易折断的茎秆、叶片、叶鞘和稻穗;箭头表示突变体Bc18各个部分易断裂之处。A,B,C and D show broken culm,leaf,leaf sheath and panicle of Bc18,respectively;Arrows indicate easily broken position of Bc18;WT,Wild type.图1 突变体Bc18和野生型的表型Fig.1.Phenotypes of Bc18 and its wild type.

10个测定数据的平均值;**表示在0.01水平上差异显著;横栏表示标准误。The average values are means of 10measurements;**significant at 0.01level;Bars are standard errors;WT,Wild type.图2 突变体Bc18和野生型的机械强度Fig.2.Mechanical strength of Bc18 and its wild type.
2.3 突变体Bc18的机械强度
突变体Bc18植株表现全生育期脆性,茎、叶片、叶鞘、穗都很容易折断,机械强度明显下降(图1)。采用人工折断的方法虽然可以对稻株的机械强度进行大致定性,却难以进行精确的定量分析。为此,我们利用WZL-300B卧式电脑拉力仪测定了Bc18及其野生型中9B成熟期倒2节间和倒2叶的抗张力,结果表明突变体Bc18倒2节间和倒2叶的抗张力分别为19.89N和10.44N,分别比野生型降低了70.70%和47.16%(图2)。可见,脆性突变严重影响了Bc18植株的机械强度。
2.4 突变体Bc18的细胞壁组分
测定成熟期突变体Bc18和野生型中9B茎秆和叶片的纤维素、半纤维素、木质素含量,结果表明,突变体Bc18茎、叶的纤维素含量各占茎、叶干物质总质量的28.93%和18.8%,与野生型接近;半纤维素含量各占干物质总质量的26.5%和35.0%,分别比野生型提高了31.84%和17.35%,差异极显著;木质素含量各占茎、叶干物质总质量的3.23%和4.5%,比野生型提高了3.19%和5.15%,差异不显著(图3)。这与已发表的大多数脆性突变体纤维素含量明显降低不同。
2.5 Bc18脆秆性状的遗传
用原始突变体Bc18与3个籼稻保持系和3个籼稻恢复系分别杂交获得F1植株,所有F1植株茎、叶都表现脆性;6个F2群体,茎秆表现脆和非脆的单株数呈现典型的3∶1分离,经卡方测验,符合一对显性单基因控制的遗传模式(表3)。以突变体Bc18作轮回亲本建立的6个BC1F1回交群体,全部植株均表现脆性;以正常茎秆强度亲本作轮回亲本建立的6个BC1F1回交群体,脆与非脆单株以1∶1分离,进一步证明了Bc18突变体受单显性基因控制。

A-茎秆纤维素、半纤维素和木质素含量;B-叶片纤维素、半纤维素和木质素含量。3个测定数据的平均值;**表示在0.01水平上差异显著;横栏表示标准误。A and B,Cellulose,hemicellulose and lignin contents of total cell wall residues of the culm(A)and leaf(B)segments fromBc18 and its wild type plants;The average values are means of 3measurements;**significant at 0.01level;The bars refer standard errors.图3 突变体Bc18和野生型细胞壁组分含量Fig.3.Measurement of cell wall components of Bc18 and its wild type.
2.6 Bc18脆秆基因的染色体定位
多态性检测结果显示,256对SSR引物中有102对在Bc18和02428之间具有多态性。利用筛选获得的多态SSR引物检测Bc18/02428F2定位群体中9个野生型(不脆)单株的基因型,结果显示第1染色体长臂端的分子标记RM7419显示的9个野生型单株的基因型与亲本02428完全相同。扩大样本到21个野生型单株,结果发现Bc18脆秆基因与RM7419标记之间仅存在1次交换(图4)。通过以上实验初步将Bc18定位在第1染色体长臂端分子标记RM7419附近。
2.7 Bc18脆秆基因的精细定位
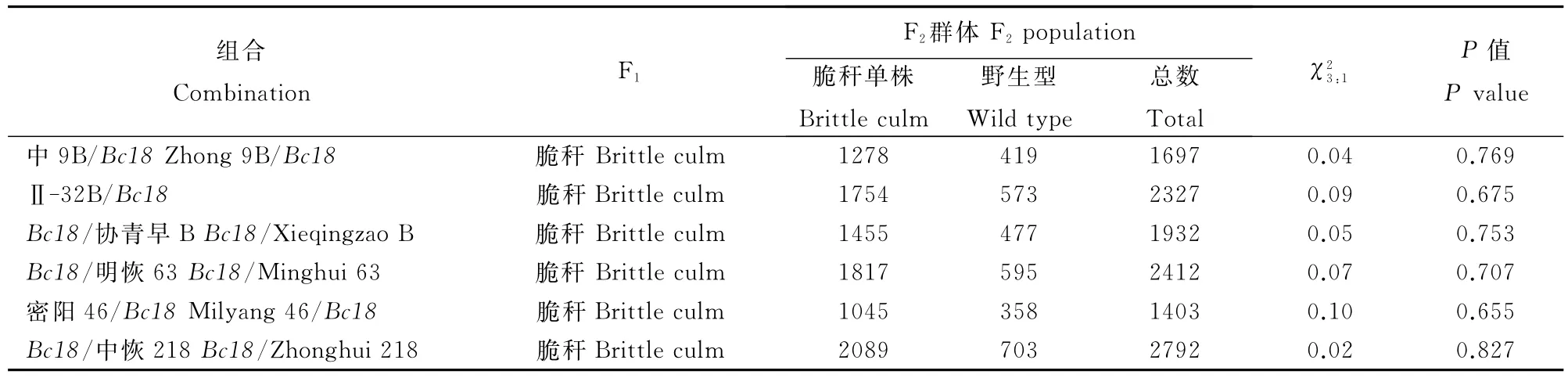
表3 突变体Bc18 F2分离群体Table 3.Genetic analyses of Bc18 F2populations.
在初定位的基础上,我们根据Gramene(http://www.gramene.org)网站上提供的数据,在RM7419标记附近挑选了10对SSR引物。PCR扩增结果显示只有SSR标记RM315在Bc18与02428之间具有多态性。利用RM7419和RM315引物检测21个野生型单株的基因型,发现RM7419 和RM315与Bc18均有1个交换,但是交换单株不同,因此Bc 18基因被定位在SSR标记RM7419和RM315之间。继续在RM7419和RM315标记之间寻找和合成新的SSR引物,通过134个定位单株把Bc18基因进一步定位在SSR标记RM1231和RM265之间大约5.7Mb的区间内。
为了对Bc18基因做进一步的定位,根据RM1231和RM265之间水稻品种9311和日本晴的基因组序列差异,用引物设计软件Primer Premier 5.0设计了5对InDel引物,多态性分析显示,只有1对引物在02428和Bc18之间表现出多态性,却有4对引物在9311和Bc18之间表现出多态性,且带型清晰。因此,精细定位群体改为9311/Bc18 F2群体中的非脆单株。通过1011个定位单株,把Bc18基因定位在InDel标记PBC4与PBC25之间,物理图距为460kb的区域内。然后又在PBC4与PBC25之间新设计了4个有多态的InDel标记(表4)。用这4对InDel引物进一步将Bc18基因定位在InDel标记PBC22与PBC33之间大约154kb的物理图距内(图5)。

1-Bc18;2-02428;3-F1(02428×Bc18);4~24-F2不脆单株。Lane 1,Bc18;Lane 2,02428;Lane 3,F1(02428/Bc18);Lanes 4to 24,Non-brittle culm individuals in F2population.图4 与Bc18基因连锁的SSR标记RM7419的扩增结果Fig.4.Electrophoresis of the SSR marker RM7419linked with the Bc18 locus.
3 讨论

图5 Bc18基因在第1染色体上的位置Fig.5. Location of the Bc18 gene on the chromosome 1of rice.

表4 用于Bc18基因精细定位的分子标记Table 4.Markers used for fine mapping of the Bc18 gene.
3.1 突变体Bc18的表型比较
从已报道的脆秆突变体来看,除了茎叶比较脆嫩、植株机械强度显著下降之外,大多数脆性突变体还伴随着诸如植株矮化、叶片披垂、卷叶、生育期延迟、穗变小、结实率下降等多种效应。例如,bc3、bc10、bc11、bc12、bc14、NE1031、ND8759、ND2359、bc88等突变体植株变矮,bc11、fp2、bc88、NE1031、ND8759、ND2359、dwf1等突变体成熟期叶片下垂,突变体fc 1茎秆不能直立,bc 3、bc10、bc11、bc12、gdd1、bc14、NE1031等突变体表现分蘖少、根短、结实率下降、叶片萎蔫等性状。本研究获得的突变体Bc18株叶形态良好,农艺、产量性状、生育期与野生型接近。
细胞壁组分测定结果表明,脆秆突变体的纤维素含量基本都呈现下降的趋势,半纤维素含量有升有降,木质素含量升高的突变体较多。半显性脆秆突变体Bc6茎秆纤维素含量比野生型降低了38%,半纤维素含量增加了34%,木质素含量没有明显变化[6];nbc(t)突变体茎秆纤维素含量比野生型下降了17%,木质素含量提高了5%,茎秆抗张力下降了69%[7]。与这些突变体相比,Bc18茎、叶的纤维素含量基本不变,木质素含量变化也不大,而半纤维素含量显著提高了31.84%和17.35%,茎秆机械强度比野生型下降了约70%,叶片机械强度则下降了47%。只有半纤维素含量显著提高是Bc18脆秆突变体在细胞壁组分上与其他脆秆突变体的明显不同之处。
3.2 Bc18突变基因的探讨
在已报道的脆秆突变体中,大部分是隐性单基因控制,只有bc6、nbc(t)为显性基因控制,其中bc6是一个半显性基因,位于第9染色体,是纤维素合酶OsCesA9基因发生了突变[6];nbc(t)则可能是由双显性基因控制,也位于第9染色体[25]。从本研究结果来看,Bc18由单显性基因控制,位于第1染色体的长臂端。
目前,第1染色体上报道了3个脆秆突变体bc7、bc11和NE1031,它们均是纤维素合酶OsCesA4基因发生了突变引起的。基因克隆分析发现,bc7在OsCesA4基因的第10外显子和第10内含子的连接处缺失了7个碱基,移码突变导致不能产生正常功能的OsCesA4蛋白,纤维素含量降低了约10%,半纤维素提高了30%,木质素含量没有明显变化,细胞壁变薄、机械强度下降,但外形没有明显变化[9];bc11是在OsCesA4基因的第13外显子上的一个碱基发生了错义突变,突变位点位于非常保守的第5个跨膜结构域的末端,G858R位置氨基酸由亮氨酸变为精氨酸,植株矮化、叶片萎蔫、穗变小、成熟期叶片披垂,细胞壁变薄,纤维素含量比野生型降低了约60%,阿拉伯木糖显著增加,木质素含量变化很少[10];NE1031是在OsCesA4基因的第6外显子处插入了Tos17转座子,导致基因产生突变,植株矮小,叶片萎蔫,茎秆变细,结实率低,纤维素含
量比野生型下降了80%左右,细胞壁变薄[8]。基因预测和功能注释结果表明,Bc18所在的154kb区间内有23个ORF,其中包含了OsCesA4基因(LoC _Os01g54620)。到底Bc18是不是与bc7、bc11、NE1031一样,因OsCesA4基因突变产生了脆性,还有待于进一步研究,但本研究的精细定位结果对进一步克隆Bc18基因奠定了基础。
参考文献:
[1] 吴超,傅亚萍,朱丽,等.转高赖氨酸蛋白基因脆茎水稻的收获指数及秸秆赖氨酸含量的研究.浙江农业学报,2008,20 (4):225-230.Wu C,Fu Y P,Zhu L,et al.Studies on harvest index and culm lysine content in the transgenic brittle culm rice inserted lysine-rich protein gene.Acta Agric Zhejiang,2008,20(4):225-230.(in Chinese with English abstract)
[2] 汪海峰,朱军莉,刘建新,等.饲喂脆茎全株水稻对生长肥育猪生长性能、养分消化和胴体质量的影响.畜牧兽医学报,2005,36(11):1139-1144.Wang H F,Zhu J L,Liu J X,et al.Growth performance,nutrient digestibility and carcass quality of growing-finishing pigs fed different levels of whole crop rice brittle culm-1.Acta Veter Zootech Sin,2005,36(11):1139-1144.(in Chinese with English abstract)
[3] 黄峰,王永泽,周胜德,等.水稻脆性秸秆发酵产纤维乙醇的研究.可再生能源,2014,32(2):211-215.Huang F,Wang Y Z,Zhou S D,et al.Study on cellulosic ethanol fermentation of brittle rice straw.Rene Energy Res,2014,32(2):211-215.(in Chinese with English abstract)
[4] 冯永清,邹维华,李丰成,等.特异水稻脆茎突变体生物学特性及生物质降解效率的研究.中国农业科技导报,2013,15 (3):77-83.Feng Y Q,Zou W H,Li F C,et al.Studies on biological characterization of rice brittle culm mutants and their biomass degradation efficiency.J Agric Sci and Technol,2013,15(3):77-83.(in Chinese with English abstract)
[5] Nagao S,Takahashi M.Genetieal studies on rice plant,XXVII:Trial construction of twelve linkage groups in Japanese rice.Fac Agr Hokkaido Univ,1963,53(1):72-130.
[6] Kotake T,Aohara T,Hirano K,et al.Rice Brittle culm 6 encodes a dominant-negative form of CesA protein that perturbs cellulose synthesis in secondary cell walls.J Exper Bot,2011,62(6):2053-2062.
[7] 王川丽,王令强,牟同敏.水稻脆性突变体nbc(t)的主要特性和脆性基因的初步定位.华中农业大学学报,2012,31(2):159-164.Wang C L,Wang L Q,Mou T M.Characterization and gene mapping of a brittle culm mutant nbc(t)in rice.J Huazhong Agric Univ,2012,31(2):159-164.(in Chinese with English abstract)
[8] Tanaka K,Murata K,Yamazaki M,et al.Three distinct rice cellulose synthase catalytic subunit genes required for cellulose synthesis in the secondary wall.Plant Physiol,2003,133(1):73-83.
[9] Yan C J,Yan S,Zeng X H,et al.Fine mapping and isolation of bc7(t),allelic to OsCesA4.J Genet and Genom,2007,34 (11):1019-1027.
[10]Zhang B C,Deng L W,Qian Q,et al.A missense mutation in the transmembrane domain of CESA4affects protein abundance in the plasma membrane and results in abnormal cell wall biosynthesis in rice.Plant Mol Biol,2009,71(4-5):509-524.
[11]Xu J D,Zhang Q F,Zhang T,et al.Phenotypic characterization,genetic analysis and gene-mapping for a brittle mutant in rice.J Integr Plant Biol,2008,50(3):319-328.
[12]Rao Y C,Yang Y L,Xin D D,et al.Characterization and cloning of a brittle culm mutant(bc88)in rice(Oryza sativa L.).Chin Sci Bull,2013,58(24):3000-3006.
[13]李晓静,徐多多,徐益敏,等.水稻纤维素合酶催化亚基的编码基因BC88的表达分析.中国水稻科学,2015,29(2):126-134.Li X J,Xu D D,Xu Y M,et al.Expression of OsBC88,a rice cellulose synthase catalytic subunit gene.Chin J rice Sci,2015,29(2):126-134.(in Chinese with English abstract)
[14]吴国超,桑贤春,马娇,等.水稻矮脆突变体dwfl的特性与基因定位.植物遗传资源学报,2014,15(4):795-801.Wu G C,Sang X C,Ma J,et al.Genetic analysis and finemapping of a dwarf and fragile mutant dwf1 in rice.J Plant Genet Resou,2014,15(4):795-801.(in Chinese with English abstract)
[15]Wang D F,Yuan S J,Yin L,et al.A missense mutation in the transmembrane domain of CESA9affects cell wall biosynthesis and plant growth in rice.Plant Sci,2012,196(11):117-124.
[16]Song X Q,Liu L F,Jiang Y J,et al.Disruption of secondary wall cellulose biosynthesis alters cadmium translocation and tolerance in rice plants.Molecular Plant,2013,3(6):768-780.
[17]Li Y H,Qian Q,Zhou Y H,et al.Brittle Culm 1,which encodes a cobra-like protein,affects the mechanical properties of rice plants.Plant Cell,2003,15(9):2020-2031.
[18]Liu L F,Shang-Guan K K,Zhang B C,et al.Brittle culm 1,a cobra-like protein,functions in cellulose assembly through binding cellulose microfibrils.Plos Genet,2013,9(8):1159-1169.
[19]Xiong G Y,Li R,Qian Q,et al.The rice dynamin-related protein DRP2B mediates membrane trafficking,and thereby plays a critical role in secondary cell wall cellulose biosynthesis.Plant J,2010,64(1):56-70.
[20]Ko H,Toshihisa K,Kumiko K,et al.Rice Brittle Culm 3(BC3)encodes a classical dynamin OsDRP2Bessential for proper secondary cell wall synthesis.Planta,2010,232(1):95-108.
[21]Zhou Y H,Li S B,Qian Q,et al.BC10,a DUF266-containing and Golgi-located typeⅡmembrane protein,is required for cell-wall biosynthesis in rice(Oryza sativa L.).plant J,2009,57(3):446-462.
[22]Zhang M,Zhang B C,Qian Q,et al.Brittle Culm 12,a dualtargeting kinesin-4protein,controls cell-cycle progression and wall properties in rice.Plant J,2010,63(2):312-328.
[23]Zhang B C,Liu X L,Qian Q,et al.Golgi nucleotide sugar transporter modulates cell wall biosynthesis and plant growth in rice.PNAS,2011,108(12):5110-5115.
[24]Song X Q,Zhang B C,Zhou Y H.Golgi-localized UDP-glucose transporter is required for cell wall integrity in rice.Plant Signal Behav,2011,6(8):1097-1100.
[25]Wu B,Zhang B C,Dai Y,et al.Brittle culm 15 encodes a membrane-associated chitinase-like protein required for cellulose biosynthesis in rice.Plant Physiol,2012,159(4):1440-1452.
[26]Li X J,Yang Y,Yao J L,et al.Flexible Culm 1 encoding a cinnamyl-alcohol dehydrogenase controls culm mechanical strength in rice.Plant Mol Biol,2009,69(6):685-697.
[27]叶亚峰,刘斌美,许学,等.水稻脆秆矮生突变体鉴定及基因定位研究.核农学报,2012,26(1):1-5.Ye Y F,Liu B M,Xu X,et al.Identification and genetic mapping of a fragile and dwarf rice mutant.J Nucl Agric Sci,2012,26(1):1-5.(in Chinese with English abstract)
[28]桑贤春,杜川,王晓雯,等.水稻矮秆脆性突变体dbc1的鉴定与基因定位.作物学报,2013,39(4):626-631.Sang X C,Du C,Wang X W,et al.Identification and gene mapping of dwarf and brittle culm mutant dbc1in Oryza sativa.Acta Agron Sin,2013,39(4):626-631.(in Chinese with English abstract)
[29]Takahashi M,Kinoshita T,Takeda K.Genetical studies on rice plant,XXXIII:Character expression and causal genes of some mutants in rice plant.J Fac Agric Hokkaido Univ,1968,55(4):496-512.
[30]Sanchez A C,Khush G S.Chromosomal location of some marker genes in rice using the primary trisomics.J Hered,1994,85(4):297-300.
[31]Librojo A L,Khush G S.Chromosomal Location of Some Mutant Genes Through the Use of Primary Trisomics in Rice.Rice Genetics.Manila(Philippines):IRRI,1986:249-255.
[32]张上都,余显权,赵福胜,等.一个水稻脆秆重组体的遗传分析.贵州农业科学,2010,38(2):5-6.Zhang S D,Yu X Q,Zhao F S,et al.Genetic analysis of a rice recombination with brittle stem.Guizhou Agric Sci,2010,38 (2):5-6.(in Chinese with English abstract)
[33]蒋钰东,何沛龙,廖红香,等.水稻脆性及叶尖枯死突变体fld1的鉴定与基因定位.植物学报,2014,49(6):663-671.Jiang Y D,He P L,Liao H X,et al.Identification and gene mapping of a fragile and leaf-tip dead mutant fld1 in Oryza sativa.Chin Bull Bot,2014,49(6):663-671.(in Chinese with English abstract)
[34]Van Soest P J,Robertson J B,Lewis A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition.J Dairy Sci,1991,74(10):3583-3598.
[35]卢扬江,郑康乐.提取水稻DNA的一种简易方法.中国水稻科学,1992,6(1):47-48.Lu Y J,Zheng K L.A simple method for isolation of rice DNA.Chin J Rice Sci,1992,6(1):47-48.(in Chinese with English abstract)
Characterization and Gene Mapping of a Dominant Brittle Culm Mutant Bc 18in Rice(Oryza sativa L.)
PENG Ying-cai1,2,#,LIU Wen-zhen2,#,FU Ya-ping2,WANG He-tong1,HU Guo-cheng2,CHEN Wen-fu1,XUZheng-jin1,*
(1College of Agronomy,Shenyang Agricultural University,Shenyang 110866,China;2 China National Rice Research Institue,Hangzhou 310006,China;#These authors contributed equally to this work;*Corresponding author,E-mail:xuzhengjin@126.com)
PENG Yingcai,LIU Wenzhen,FU Yaping,et al.Characterization and gene mapping of a dominant brittle culm mutant Bc18 in rice(Oryza sativa L.).Chin J Rice Sci,2016,30(2):127-135.
Abstract:A brittle culm mutant was obtained from the F2population of three-way crossⅡ-32B//Xieqingzao B/Dular and named as Brittle culm 18(Bc18)according to its phenotypes.Each part of plant showed brittleness during the whole growth period.In order to identify the mutant,near isogenic line populations of Zhongcui B and Zhong 9Bwere created with Bc18 mutant as the donor of brittle gene and Zhong 9B,a normal culm-strength variety,as the receptor and recurrent parent.Compared with wild type,Bc18 significantly declined by 70.70%and 47.16%in mechanical strength of culm and leaves,respectively.No significant differences were found in terms of growth duration,plant height,panicle number per plant,spikelet number per panicle,seed setting rate and 1000-grain weight.Cell wall components analyses showed that cellulose content and lignin content in Bc18 had no significant difference as compared with those of wild type,while hemicellulose content in culm and leaf dramatically increased by 31.84%and 17.35%,respectively.Genetic analyses of six F2and twelve BC1F1backcross populations revealed that the phenotype of Bc18 was controlled by a single dominant gene.Bc18/02428and Bc18/9311F2populations were developed for Bc18 gene mapping.By means of map-based cloning technology,with some SSR markers published online and new designed InDel markers,Bc18 was localized between InDel marker PBC22and PBC33at a physical distance of about 154kb on the long arm of chromosome 1.This work laid the foundation for cloning Bc18 gene in the future.
Key words:rice(Oryza sativa L.);Bc18;dominant brittle culm;mechanical strength;hemicellulose content;gene mapping
中图分类号:Q343.5;S511.032
文献标识码:A
文章编号:1001-7216(2016)02-0127-09
基金项目:中央级科研院所基本科研业务费专项(2014RG001-5);中国农业科学院超级稻杂种优势机理研究创新团队资助项目(CAAS-ASTIP-2013-CNRRI)。
收稿日期:2015-11-02;修改稿收到日期:2015-11-22。
