一株产灵菌红素菌的筛选及其等离子体诱变
2016-05-09张德伟薛正莲苏燕南何阳登张国锋安徽工程大学生物与化学工程学院安徽芜湖241000
张德伟,薛正莲,王 洲,苏燕南,何阳登,张国锋(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
一株产灵菌红素菌的筛选及其等离子体诱变
张德伟,薛正莲*,王 洲,苏燕南,何阳登,张国锋
(安徽工程大学生物与化学工程学院,安徽芜湖 241000)
摘要:为获得能高效合成灵菌红素的菌株,首先对土壤中的微生物进行分离,筛选得到一株优势菌株.分别采用形态学、生理生化实验以及16SrDNA测序分析,鉴定该菌株为粘质沙雷氏菌属,命名为Serratiamarcescens ZX-01.对该菌株分别采用常压室温等离子体(Atmospheric and Room Temperature Plasma,ARTP)诱变,并进行平板初筛和摇瓶复筛.经多轮诱变后,得到一株灵菌红素优势菌株ZX-3-10,其产量可达128.7mg/L,比诱变前提高123%.五代产量稳定性试验结果表明,该菌株具有良好的产量传代稳定性.
关 键 词:粘质沙雷氏菌;灵菌红素;筛选鉴定
灵菌红素(prodigiosins,PG)是一类具有多吡咯环的天然红色素的总称,由放线菌、细菌等微生物产生的次级代谢产物.1929年首次由Amak等在研究Serratia生长时发现,Harashima K等于1960年首次分离得到此类物质.已有的研究表明,灵菌红素具有广泛的抗生效果以及抗肿瘤活性,具有重要的研究意义[1-3].已报道[4]的可产灵菌红素类色素的微生物主要包括沙雷氏菌属、假单胞菌属、弧菌属、交替单胞菌属、皱纹单胞菌属以及革兰氏阳性的放线菌.目前,灵菌红素的研究和生产主要以Serratia菌属为主,其中最为常见的是以粘质沙雷氏菌(Serratiamarcescens)发酵生产灵菌红素.
韦凤[5]等从淡水鱼体中分离得到一株高产红色色素的Sm-128菌株,鉴定为粘质沙雷氏菌.李子武[6]等利用贫营养条件,从土壤中筛选获得一株产红色素菌株,经形态生理及分子鉴定为粘质沙雷氏菌,并对其所产红色素进行光谱分析确定为灵菌红素.陈月琴[7]等从大亚湾表面海水中分离得到一株海洋产灵菌红素细菌,对其进行分子鉴定为假单胞菌属.夏顺翔[8]等用紫外诱变原生质体,得到一株高产株灵菌红素,产量达到了0.813g/L.吴欢欢[9]等通过对筛选的高产红色素粘质沙雷氏菌jx-1菌株的发酵工艺优化,以补料方式和表面活性剂提高色素产量,最终使得红色素产量提高到5.8g/L.
清华大学研发的新型常压室温等离子体(ARTP)生物诱变育种技术,具有射流温度低(25~35℃)、活性粒子分布均匀、设备简单及操作简易等优势[10].ARTP诱变育种技术可以快速有效地突变细菌、微藻、真菌、酵母等微生物[11-13],已然成为生物诱变育种领域的一个研究热点.目前,尚未有关于使用常压室温等离子体(ARTP)诱变筛选灵菌红素高产菌株的突变菌方法报道.
本研究从土壤中筛选出一株产灵菌红素的菌株ZX-01,鉴定为粘质沙雷氏菌(Serratiamarcescens).运用ARTP诱变技术对出发菌株进行诱变,筛选得到一株高产灵菌红素的突变株ZX-3-10,为灵菌红素的开发及应用提供了获得优良菌株的方法.
1 材料与方法
1.1 材料
(1)样品.从安徽芜湖山林、池边和居民生活区随机取土样20份.
(2)主要试剂.酵母膏、胰蛋白胨、甘氨酸、甘油、乙醇、盐酸、琼脂、NaCl等.
(3)培养基.分离培养基:K2HPO40.1g/L,酪氨酸0.5g/L,(NH4)2SO41g/L,MgSO4·7H2O 0.02g/L,琼脂2g/L,pH 7.0~7.2;LB培养基:酵母膏5g/L,胰蛋白胨10g/L,NaCl 5g/L,pH 7.0~7.2;初筛培养基:酵母膏5g/L,胰蛋白胨10g/L,NaCl 5g/L,葡萄糖5~13g/L,琼脂2g/L,pH 7.0~7.2;发酵培养基:甘油20mL/L,胰蛋白胨13g/L,NaCl 5g/L,MgSO41.2g/L,甘氨酸2g/L,pH 6.5.
1.2 方法
(1)分离筛选.制备土样悬液,在LB培养基中培养24h后,用10倍稀释法将培养物稀释到10-5;取10-4、10-5两个稀释度的样品,分别涂布在分离培养基上,28℃倒置培养,观察菌落颜色和形态.挑取红色菌落进行划线,分离出单菌落.
(2)生理生化鉴定.
①形态观察:将纯化得到的菌株在LB培养基中活化,然后转接到LB固体培养基平板上,28℃培养48h,观察菌体生长状况及形态.
②生理生化实验:取28℃培养48h的菌株进行生理生化实验,参照《伯杰细菌鉴定手册》.
(3)分子生物学鉴定.
①16SrDNA测序:提取菌体的全基因组DNA,经电泳验证后作为模板进行PCR扩增,其引物如下:27F(5’-AGAGTTTGATCCTGGCTCAG-3’)及1492R(5’-ACGGTTACCTTGT TACGACTT-3’).反应体系为:重蒸水37.75μL,dNTP 4μL,10×Buffer 5μL,上游引物2μL,下游引物2μL,DNA模板1μL,exTaq酶0.25μL;反应总体系50μL.反应条件为:98℃预变性10s,98℃变性10s,55℃退火30s,72℃延伸1min 30s,总共30个循环,最后72℃延伸10min.产物经电泳验证后,用生工生物工程(上海)股份有限公司SanPrep DNA回收试剂盒回收PCR产物,经电泳检测后,送公司进行测序.
②系统发育分析:将所得16SrDNA基因序列与GenBank数据库中的已知序列进行BLAST比对,确定与实验菌株亲缘关系相近的种属,并从数据库获得相关种属模式菌株的16SrDNA基因序列,使用Clustal X软件和MEGA软件进行分析,绘制系统发育树.
(4)菌株ARTP诱变.
①诱变处理[14]:取已培养8h的菌液镜检,离心,用生理盐水重悬至菌浓度为108CFU/mL.取10μL菌悬液滴于等离子体诱变小铁片上,置入诱变仪中,分别处理0、30s、60s、90s、120s、150s、180s.诱变后将样品小铁片取出,放入装有990μL生理盐水的2mL的离心管中培养2h.分别取10-4、10-5和10-63个稀释度的菌液0.1mL涂布于筛选平板上,每个稀释度设3个平行,以ARTP处理0为对照组,28℃培养36h后,记录每皿菌落数,计算出诱变致死率,以等离子处理时间为横坐标,致死率和正突变率分别为纵坐标,绘制致死率和正突变率曲线.其中:

注:正突变菌落为在初筛平板上呈红色的菌落.
②平板初筛:取0.1mL稀释后的菌悬液,涂布在初筛平板上,28℃培养,挑取生长快、颜色较深的单菌落.每一轮诱变后,根据梯度平板实验提高葡萄糖添加量.
③摇瓶复筛:将初筛得到的菌株分别接种与LB培养基中,培养12h,转接到发酵培养基中,28℃发酵48h后,测定灵菌红素产量,筛选灵菌红素产量较高的菌株.
④遗传稳定性的分析:将诱变获得高产菌株在平板上进行活化,并作为第一代菌株,传代5次,摇瓶发酵测其产量,考察菌株的遗传稳定性,每组设3个平行.
(5)灵菌红素的测定方法.取5mL发酵液,10 000r/min离心10min,弃去上清液,加入5mL酸性乙醇(pH 3.0),28℃、180r/min摇床振荡提取60min后,10 000r/min离心10min,收集上清液,紫外-可见分光光度计535nm处测定吸光度.
2 结果与分析
2.1 粘质沙雷氏菌的鉴定
(1)形态特征.以产红色素菌株为目的菌株进行筛选,经划线分离、纯化后得到一株产红色素稳定的菌株,命名为ZX-01.菌株ZX-01为革兰氏阴性杆菌,生长较快,在LB平板上菌落呈圆形、边缘整齐、不透明,表面隆起、光滑粘稠、易挑取,且有轻微异味,筛选菌株的菌落形态及革兰氏染色如图1所示.

图1 ZX-01平板菌落形态图和革兰氏染色图
(2)生理生化实验.目的菌株ZX-01的生理生化实验结果如表1所示.

表1 菌株ZX-01生理生化特征
(3)16SrDNA的序列分析.提取筛选菌株ZX-01基因组后,利用通用引物对其16SrDNA区段进行扩增,将扩增片段回收纯化后由生工生物工程(上海)有限公司完成测序,得到ZX-01的16SrDNA序列,经序列拼接后,上传至GenBank,经过同源性比对,提交序列与已知粘质沙雷氏菌(Serratiamarcescens)同源性达99%以上.ZX-01菌株的基因组DNA电泳图和16SrDNA扩增产物电泳图如图2所示.利用MEGA 4以Neighbor-Joining算法绘制系统发育树,如图3所示.由图3可知,筛选菌株ZX-01属于一株变形菌门,与一株γ-变形细菌同源性较高,同时,与多株粘质沙雷氏菌具有较高同源性,结合形态特征和生理生化特征,最终鉴定该ZX-01菌株属于沙雷氏菌属的粘质沙雷氏菌.

图2 ZX-01菌株的基因组DNA电泳图和16SrDNA扩增产物电泳图
2.2 ARTP诱变
(1)粘质沙雷氏菌ZX-01的生长曲线.从平板上接种培养物于LB液体培养管中培养过夜,按体积分数2%的接种量转接至50mL的LB液体培养基中,28℃、180r/min摇床振荡培养,每隔2h取样测定一次菌悬液的OD600,并绘制菌株的生长曲线如图4所示.由图4可知,菌株在接种后2h进入对数生长期,培养14h后进入稳定期.

图3 ZX-01菌株的系统发育树
(2)ARTP诱变处理.菌株ZX-01等离子诱变致死率及正突变率如图5所示.由图5可知,菌株ZX-01经过ARTP诱变处理后,诱变致死率随着菌株诱变时间的增长而增,90s时致死率已到达97.78%,且此时的正突变率为37.78%,明显高于其他诱变时间的正突变率,故实验最终确定最佳诱变时间为90s,以期获得高产菌株.

图4 ZX-01菌株的生长曲线

图5 菌株ZX-01等离子诱变致死率及正突变率
(3)突变株的初筛.分解代谢物的调节对许多抗生素的生物合成起着重要作用,如青霉素发酵过程中的葡萄糖效应,灵菌红素的生产同样存在葡萄糖效应[15].葡萄糖浓度对灵菌红素产量的影响如图6所示.由图6可知,随着葡萄糖浓度的增加,灵菌红素的产量呈现下降趋势.葡萄糖浓度梯度平板实验如图7所示.由图7可知,高葡萄糖浓度会抑制灵菌红素的产生.尽管发酵过程中可应用发酵技术来克服葡萄糖效应,但如果能选育出抗分解代谢物阻遏的突变株,则更能满足工业生产的需要.

图6 葡萄糖浓度对灵菌红素产量的影响

图7 菌落在梯度平板上的菌落长势
因此,对出发菌株ZX-01进行ARTP诱变,诱变时间为90s,诱变后涂布于含有高浓度葡萄糖的筛选平板上进行初步筛选,28℃倒置培养24h后,从初筛平板上挑取红色且颜色较深的单菌落(见图8),进行摇瓶复筛.经过多轮诱变、筛选,通过平板初筛共筛选出14株突变株.
(4)突变株的摇瓶复筛.将初筛获得的14株突变株菌经活化后,按10%的接种量分别接种于发酵培养基中,28℃恒温培养箱静置发酵培养48h,测定灵菌红素产量,结果如图9所示.由图9可知,诱变后选育出高产灵菌红素的突变菌株ZX-3-10,其灵菌红素产量可达128.7mg/L,比诱变前初始菌株ZX-01的产量提高123%.

图8 菌株ZX-01等离子体诱变的初筛
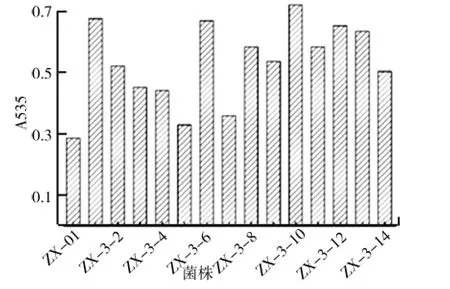
图9 菌株ZX-01等离子体诱变的复筛
(5)突变株遗传稳定性分析.将ZX-3-10菌株在LB培养基平板上连续传代5次,再分别接种至摇瓶发酵培养基中,每组设3个平行,测定传代菌种的产灵菌红素能力,试验结果如表2所示.由表2可知,诱变高产株有较高的传代稳定性.

表2 高产菌株传代稳定性实验
3 结论
土壤中筛选得到一株具有产红色素能力的菌株,通过对菌落外观特征、生理生化试验以及16SrDNA序列分析,最终鉴定该菌为黏质沙雷氏菌,并命名为Serratiamarcescens ZX-01.采用ARTP诱变筛选灵菌红素生产菌突变株的育种新技术,获得了一株灵菌红素产量明显提高的突变菌株ZX-3-10,其灵菌红素产量达到128.7mg/L,比诱变前提高了123%.通过传代培养,灵菌红素产量能稳定维持在高水平,表明经ARTP诱变获得的这株突变菌具有较高的遗传稳定性.后续将对突变菌株进行基因测序,与出发菌进行比对分析,研究突变菌的突变机理及灵菌红素产量提高的原因.
参考文献:
[1] A V Giri,N Anandkumar,G Muthukumaran,et al.A novel medium for the enhanced cell growth and production of prodigiosin fromSerratiamarcescensisolated from soil[J].BMC Microbiology,2004,4(1):11-21.
[2] T Nakashima,Y Kato,K Yamaguchi,et al.Evaluation of the anti-trichopHyton activity of a prodigiosin analogue produced byγ-proteobacterium,using stratum comeum epidermis of the Yucatan micropig[J].Journal of Infection and Chemotherapy,2005,11(3):123-128.
[3] J E Fender,C M Bender,N A Stella,et al.Serratiamarcescens quinoprotein glucose dehydrogenase activity mediates medium acidification and inhibition of prodigiosin production by glucose[J].Applied and Environmental Microbiology,2012,78(17):6 225-6 235.
[4] 刘同军,杨海龙,唐华.灵菌红素的研究进展[J].食品与药品,2007,9(8):47-50.
[5] 韦凤,蒋冬花,蔡琪敏,等.一株高产灵菌红素粘质沙雷氏菌的筛选与鉴定[J].浙江师范大学学报:自然科学版,2011,34(3):339-344.
[6] 李子武,张显,徐美娟,等.一株产灵菌红素粘质沙雷氏菌的筛选、鉴定及发酵条件[J].食品与生物技术学报,2012,31(10):1 018-1 024.
[7] 陈月琴,周世宁,戴欣,等.海洋产灵菌红素细菌的基因分析与鉴定[J].中山大学学报:自然科学版,1999,38(1):117-119.
[8] 夏顺翔,张魁,贾秉晟,等.红色素产生菌RZ21菌株的原生质体紫外诱变育种研究[J].安徽农业科学,2010,38(6):2 780-2 782,2 792.
[9] 吴欢欢,孙诗清,王玉洁,等.灵菌红素发酵工艺的初步优化[J].嘉兴学院学报,2012,24(6):66-69.
[10]P X Jiang,L Y Wang,Z L Huang,et al.Studies on the mutation breeding mechanism of streptomyces avermitilis by a novel atmospheric-pressure,low-temperature discharge plasma[J].Journal of Biotechnology,2008,136S:22-71.
[11]Y Lu,L Y Wang,K Ma,et al.Characteristics of hydrogen production of an enterobacter acrogens mutant generated by a new atmospheric and room temperature plasma(ARTP)[J].Biochemical Engineering Journal,2011,55(3):17-22.
[12]金丽华,方明月,张翀,等.常压等离子体快速诱变产油酵母的条件及其突变株的特性[J].生物工程学报,2011,27(3):461-467.
[13]T Guo,Y Tang,Q Zhang,et al.Clostridium beijerinckii mutant with high inhibitor tolerance obtained by low-energy ion implantation[J].Journal of Industrial Microbiology and Biotechnology,2012,39(3):401-407
[14]章宁娟,薛正莲,王洲,等.大曲中产3-羟基丁酮菌株的筛选及其等离子体诱变[J].安徽工程大学学报,2014,29(4):15-19.
[15]陶金莉,沈亚领,魏东芝,等.产灵菌红素沙雷氏菌的诱变育种[J].微生物学通报,2004,31(2):45-48.
Screening of prodigiosins-producing strain and its plasma mutation
ZHANG De-wei,XUE Zheng-lian*,WANG Zhou,SU Yan-nan,HE Yang-deng,ZHANG Guo-feng
(College of Biological and Chemical Engineering,Anhui Polytechnic University,Wuhu 241000,China)
Abstract:A strain was selected from soil for producing the natural pigment with bioactivity.The strain was identified as Serratiamarcescens by morphologic,biochemical test and sequence analysis of 16SrDNA,and named as ZX-01.The strain was mutated by using a novel mutagenic source-atmospheric and room temperature plasma(ARTP).The yield of prodigiosins in the mutated cells reached 128.7mg/L,which increased by 123%compared to that of the wild strain.The mutant strain ZX-3-10was relatively stable in terms ofprodigiosins production through five successive transfers of culturesand batch fermentation.
Key words:Serratiamarcescen;prodigiosin;screening and identification
通讯作者:薛正莲(1967-),女,安徽和县人,教授,硕导.
作者简介:张德伟(1991-),男,河南商城人,硕士研究生.
基金项目:安徽工程大学青年科研基金资助项目(2013YQ48)
收稿日期:2015-11-16
文章编号:1672-2477(2016)01-0010-06
中图分类号:Q939、Q931
文献标识码:A
