两相体系中羟化酶催化1,2,3,4-四氢喹啉不对称羟基化反应
2016-05-09崔宝东陈永正
李 珂, 杨 敏, 崔宝东, 陈永正
(遵义医学院 药学院,贵州 遵义 563000)
·研究简报·
两相体系中羟化酶催化1,2,3,4-四氢喹啉不对称羟基化反应
李 珂, 杨 敏, 崔宝东, 陈永正*
(遵义医学院 药学院,贵州 遵义 563000)
以菌株PseudomonasplecoglossicidasZMU-T02整细胞为生物催化剂,1,2,3,4-四氢喹啉经不对称羟基化反应合成了(R)-4-羟基-1,2,3,4-四氢喹啉,其结构经1H NMR,13C NMR, HR-MS和HPLC确证。在细胞浓度为30 g cdw·L-1, pH为9.0,整细胞悬浮液/有机溶剂比例为1 ∶1的两相体系中,底物浓度为10 mmol·L-1时,收率37%,ee值98%。
1,2,3,4-四氢喹啉; 不对称羟基化; (R)-4-羟基-1,2,3,4-四氢喹啉; 生物催化; 合成; 两相反应
手性醇作为一类重要的中间体,广泛用于药物、精细化学品及农业制品的合成中[1]。生物催化作为不对称合成领域的重要方向之一,由于通常具有高度的化学、区域和立体选择性,运用生物催化不对称合成法可获得光学活性纯度高、收率高的产物,逐渐应用到药物的合成与应用中[2]。而通过生物催化不对称羟基化反应,是实现高对映选择性合成和制备手性醇的重要方法之一。
1,2,3,4-四氢喹啉类化合物是一类重要的含氮杂环化合物,是构成许多生物活性分子和天然产物的重要结构单元,并可以应用于一些新型功能材料的合成中[3-6]。同时,对于含有四氢喹啉结构单元的化合物通常具有多种生理活性,可以预防和治疗动脉硬化、高脂血症以及心律失常等疾病。此外,其还可用于胆甾醇蛋白抑制[7]、抗寄生虫[8-9]、选择性雌激素调节[10]、PPARα/γ激动[11]及糖皮质激素受体拮抗等[12]。而手性四氢喹啉醇作为四氢喹啉类化合物中的一种,其可以引入关键的手性中心,是一类非常重要的分子骨架,存在于多数药物活性分子中,广泛运用于药物化学领域。例如手性1,2,3,4-四氢喹啉-4-醇作为关键中间体用于磷酸二酯酶抑制剂、μ阿片受体激动剂、δ阿片受体拮抗剂、糖皮质激素激动剂及大麻受体2激动剂等的合成[13](Scheme 1)。因此,有必要寻找一种高效合成手性四氢喹啉醇的方法。

Scheme 1
然而,目前对于四氢喹啉这一类含氮杂环的衍生物的不对称合成基本上都采用金属催化或者有机小分子催化来实现[14-15],但是寻求生物催化的绿色合成方法仍然是人们关心的问题,因此,寻找具有高活性和高选择性的生物催化的方法合成四氢喹啉的衍生物的生物催化剂成为关键[16]。
本课题组[17]前期采用整细胞催化的方法实现了1,2,3,4-四氢喹啉苄位亚甲基的不对称羟基化反应。因此,本文以菌株PseudomonasplecoglossicidasZMU-T02整细胞为生物催化剂,1,2,3,4-四氢喹啉经不对称羟基化反应合成了(R)-4-羟基-1,2,3,4-四氢喹啉(Scheme 2),其结构经1H NMR,13C NMR, HR-MS和HPLC确证。
阅读对学习语言有很好的促进作用,纵观语言学得比较好的人,基本都是喜欢阅读的人。好的阅读习惯能让阅读者查找到文本中的“蛛丝马迹”,理解其中的细节,从而提升对文章的理解能力,这对高职学生的英语能力提升是显而易见的。阅读根据读者的喜好等可以分为默读、略读、精读等,不管采用何种阅读方式,只要用心积累总会呈现“聚沙成塔”的结局。

Scheme 2
*细胞浓度50 g cdw/L, pH 9.0,其余反应条件同1.3;ammol·L-1。
1 实验部分
1.1 仪器与试剂
Agilent 400 MHz(G8303A)型核磁共振仪(CDCl3为溶剂,TMS为内标);LC-20AD型正相高效液相色谱仪[手性色谱柱为CHIRALCEL OD-H (4.6 mm Φ×250 mmL, 5 μm);流动相:正己烷/异丙醇(V/V=90/10);流速:1.0 mL·min-1; tR (major)=28.7 min, tS= 35.0 min,柱温: 25 ℃,检测波长:245 nm,收率采用外标法计算,并采用萃取率进行校正,外标曲线:y=2E+0.6x-125 437;R2=0.998 9,萃取率40%,绝对构型参照文献[17]确定]; BHC-1300IIA/B3型生物洁净安全柜;Multiskan Spectrun(WD2012A)型全波长酶标仪;TS-2102C型恒温制冷摇床;X-30R型冷冻离心机。
膨胀土在干湿循环的作用下会发生不可逆的胀缩变形,一旦这种变形受到限制,就会产生膨胀力,这是研究膨胀土问题的一个关键因素。当然,对于膨胀土边坡而言,除了膨胀力以外,还有其他因素也在同时影响着膨胀土边坡的稳定性。大量实际工程发现,土坡在失稳之前,边坡上往往会出现一定的裂隙,随着裂隙的发展,边坡的稳定性会随之降低[11]。因此,在了解了膨胀土边坡破坏过程中的变形特征的基础上,分析膨胀土边坡在裂隙、膨胀力和降雨历时影响下的安全系数的变化趋势,从而了解这些因素对膨胀土边坡稳定性的影响。
1,2,3,4-四氢喹啉-4-醇消旋体及其手性产品为自制标准品[17,19];1,2,3,4-四氢喹啉,辛烷,癸烷,十二烷,十四烷和十六烷,分析纯;异丙醇和正己烷,HPLC级纯。
取一级种子液1~2 mL接种到含50 mL M9液体培养基(M9液体培养基:Na2HPO4·12H2O 17.09 g·L-1, KH2PO43 g·L-1, NaCl 0.5 g·L-1, NH4Cl 1 g·L-1)的锥形瓶中,加入已灭菌1 mol·L-1MgSO4溶液100 μL和MT溶液50 μL,以50 μL甲苯作为诱导碳源,在锥形瓶中放入一支灭菌后的离心管,加500 μL甲苯于离心管作为气体诱导碳源,置于30 ℃摇床(300 rpm)培养18 h得菌液。取样测OD值。
将PseudomonasplecoglossicidasZMU-T02接种于灭菌后的LB液体培养基(LB液体培养基:蛋白胨10 g·L-1,酵母浸粉5 g·L-1, NaCl 10 g·L-1, pH 7.0),置30 ℃摇床(300 rpm)培养7 h得一级种子液。
1.2 细菌的培养
将菌液移入50 mL离心管,在8 000 rpm, 4 ℃条件下离心5 min;倾去上清液,根据OD值与细胞浓度关系加入相应的Na2HPO4-KH2PO4缓冲溶液[加入PBS量=(OD值×V×N×0.756)/Cx;V为菌液体积,N为稀释倍数,Cx为转化体系所需菌体浓度],混匀制得悬浮整细胞。
1.3 不对称羟基化反应
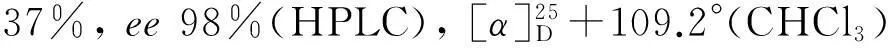
2 结果与讨论
(1) 有机溶剂
1.资源优势。吉林省有着丰富的自然资源。从气候来看,吉林省冬季平均气温可达零下15度,冰雪资源可利用时间长达四个月,适合开展冰雪活动。[4]长白山地区雪期长达八个月,雪质优良,山体落差大,有丰富的温泉资源和森林资源,是天然的滑雪场和生态休闲度假区。吉林市周边多山并且山坡平缓,无疑是天然的滑雪场,独有的自然条件所形成的雾凇被称为中国四大自然奇观之一。
音乐的节律能通过情绪影响和改变生理功能如心率、肌紧张、血压、呼吸来表达行为[23]。轻乐器演奏柔和、缓慢,平静的音乐,能够降低血压,心率,呼吸频率和血氧饱和度[24]。实际上,音乐使副交感神经优势于交感神经,形成特征性α脑电波,发生放松反应,生理上表现为肌肉放松,有节律的深呼吸,心率下降[25]。相应地,快节奏的音乐则增加心率,每分钟通气量[26],血压和交感神经活动。
2.1 反应条件优化
为了寻找最佳反应条件,分别考察了有机溶剂、细胞浓度、底物浓度和水相/有机相溶剂比例对反应效果的影响。
选择合适的有机溶剂是两相体系中能够很好的进行生物转化的关键之一。对底物和产物合适的分配以及对生物催化剂的生物相容性是选择有机溶剂的两个重要标准[20]。在进行有机溶剂选择的过程中,往往需要考察有机溶剂的生物相容性,而有机溶剂的生物相容性与logP值密切相关,在logP值为5~10时呈现出较好的生物相容性[18],因此以1,2,3,4-四氢喹啉为底物,以菌株PseudomonasplecoglossicidasZMU-T02整细胞作为生物催化剂,有机相分别考察了辛烷、癸烷、十二烷、十四烷和十六烷5种溶剂,以有机相与水相为1 ∶1的比例进行生物催化反应,结果见表1。由表1可见,在细胞浓度为20 g cdw·L-1、底物浓度为10 mmol·L-1和pH为9.0的条件下,均显示出较好的对映选择性(ee>97%),其中使用十六烷作为有机相时,收率最高(37%)。

表1 有机溶剂对反应的影响*
*细胞浓度20 g cdw·L-1,底物浓度10 mmol·L-1, pH 9.0,其余反应条件同1.3。
司马相如的赋作富有浪漫精神,与现实不符的情形也很普遍,所以司马迁认为相如作品“侈靡过其实”[1]。后人进一步认为他的赋作体物铺陈时虚构了一些该地区没有的事物,可谓无中生有。笔者在此基础上进一步发现,《上林赋》更存在虚夸地理畛域的倾向。
(2) 细胞浓度
如何避免与防范:护士应认真学习相关法律规定;认真执行《病历书写基本规范》,不可采取任何掩盖原字迹的方式进行修改,养成严谨、守则的执业行为。
*底物浓度30 mmol·L-1, pH 9.0,其余反应条件同1.3;ag cdw·L-1。

表2 细胞浓度对催化反应影响*
以十六烷作为有机相,在底物浓度为30 mmol·L-1, pH为9.0反应条件下考察细胞浓度对生物催化反应的影响,结果见表2。由表2可见,当细胞浓度为50 g cdw·L-1, 100 g cdw·L-1和150 g cdw·L-1,收率较高,而ee值则随着细胞浓度的增加而逐渐降低,在浓度为20 g cdw·L-1和50 g cdw·L-1时分别达到99%和98%。综合考虑收率及ee值,确定最适的细胞浓度为50 g cdw·L-1。
(3) 底物浓度
为了尽可能在底物浓度高的情况下获得较好的收率和对映选择性,本文采用水/有机相两相体系以降低底物的抑制作用,考察了底物浓度对反应的影响,结果见表3。由表3可见,在细胞浓度为50 g cdw·L-1, pH为9.0反应条件下,ee值均大于94%,当底物浓度为5 mmol·L-1时收率最高(44%);随着底物浓度的提高收率逐渐降低,说明较高的底物浓度仍然存在明显的抑制现象。
表3 底物浓度对催化反应影响*
Table 3 The effect of substrate concentration on the reaction
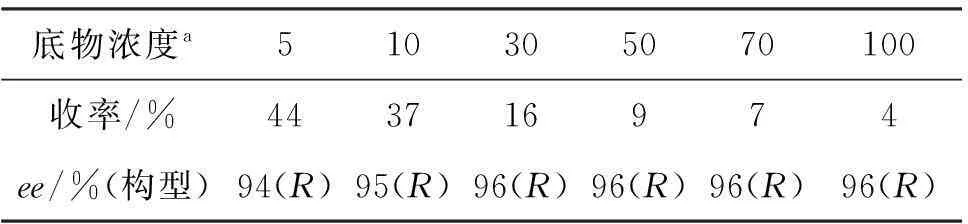
底物浓度a510305070100收率/%443716974ee/%(构型)94(R)95(R)96(R)96(R)96(R)96(R)
该方法通过培养假单胞菌进行生物催化反应,在催化过程中采用水/有机溶剂两相体系来解决底物抑制问题[18],以有机溶剂作为第二相考察非极性辅溶剂是否可以提高反应的底物浓度和产物浓度,进而促进反应的进行,实现手性的1,2,3,4-四氢喹啉-4-醇的不对称合成,并优化其生物催化反应条件,得到较高产率及高对映选择性的手性四氢喹啉醇类化合物。
(4) 溶剂配比
城市商业银行应积极培育客户品牌忠诚度,建立有效的品牌管理体系,明确品牌的市场定位,提高品牌经营意识;增加银行品牌的文化和科技含量,同时制定科学的竞争战略和策略,有针对性地在客户群中提升银行的感染力。银行还应努力塑造良好的公众形象,可以通过多种媒介进行宣传报道,大力推介银行文化和品牌。积极推行品牌市场营销战略,是城市商业银行保持其竞争优势的迫切需要,也是其有效应对金融竞争国际化趋势的需要。
考虑到水相/有机相溶剂配比对生物催化反应的过程可能存在一定程度的影响。基于前期的条件优化,我们发现产物收率随着细胞浓度的增加而增加但ee值有所降低,然而随着底物浓度的增加,收率有所降低而ee值则呈现出增加的趋势。猜想在前期优化得到的最优条件下,是否可以通过降低细胞浓度的同时增加底物浓度而得到高收率及高ee值的不对称羟基化产物,进而调整细胞浓度和底物浓度分别为30 g cdw·L-1和10 mmol·L-1,在pH为9.0的缓冲液中进行生物催化反应,结果见表4。

表4 溶剂配比对催化反应影响*
*细胞浓度30 g cdw·L-1,底物浓度10 mmol·L-1, pH 9.0,其余反应条件同1.3;a细胞浓度50 g cdw·L-1。
近又重读王重九先生《从王国维、郭沫若共认的“先汉纪录”考定司马迁父子的生年》一文,谈到《博物志》“茂陵显武里大夫司马迁”一句“司马”后究为“迁”还是“谈”作了如下解说:
由表4可见,当水相/有机相比例同为1 ∶1时,该条件下获得37%的收率及98%ee。当维持其他条件不变,细胞浓度提高为50 g cdw·L-1时,收率为37%和95%ee。因此将细胞浓度和底物浓度分别定为30 g cdw·L-1和10 mmol·L-1进行优化,通过HPLC分析结果可以观察到虽然在水相/有机相比例为5 ∶1的条件下,收率能达到实验过程中最大值65%,但是其ee值只能达到92%,而当水相/有机相比例为1 ∶1时,虽然收率只能达到37%,但是其ee值可以达到98%,因此水相/有机相比例为1 ∶1时为最佳两相体系。
首次报道了在水/有机溶剂两相体系中以1,2,3,4-四氢喹啉为底物,通过生物催化法合成了(R)-4-羟基-1,2,3,4-四氢喹啉。酶催化反应条件对其生物转化收率和对映选择性的影响研究结果表明:在细胞浓度为30 g cdw·L-1,底物浓度为10 mmol·L-1, pH为9.0反应条件下,当水相/有机相比例为5 ∶1时,获得65%的收率和92%ee;而当水相/有机相比例为1 ∶1时获得37%的收率的98%ee的(R)-4-羟基-1,2,3,4-四氢喹啉。
气体钻井过程中,压缩机向井中注入压缩气体,利用环空高压气体的能量,把岩屑从井底上返携带至井口,再经过排砂管线排入地面回收池。为实现对岩屑质量流量的实时监测,笔者设计了气体钻井返出岩屑质量流量检测系统如图1所示。微波探头安装在排砂管降尘装置之前的合适位置,环空返回的携岩气体通过微波探头发射的高频微波场,在遇上岩屑之后产生回波。探头接收到微波回波信号,通过分析检测回波信号的频率和功率变化,从而实现对返出气体携带的岩屑质量流量的连续在线检测。
[1] Chen Y Z, Lie F, Li Z. Enantioselective benzylic hydroxylation withPseudomonasmonteiliiTA-5:A simple method for the syntheses of (R)-benzylic alcohols containing reactive functional groups[J].Adv Synth Catal,2009,351(13):2107-2112.
[2] Kawano S, Horikawa M, Yasohara Y,etal. Microbial enantioselective reduction of aeetylpyridine derivatiyes[J].Biosci Biotechnol Biochem,2003,67(4):809-814.
[3] Jacquemond-Collet I, Benoit-Vical F, Valentin A,etal. Antiplasmodial and cytotoxic activity of galipinine and other tetrahydroquinolines fromGalipeaofficinalis[J].Planta Med,2002,68(1): 68-69.
[4] Nakayama H, Ferreira M E, Arias A R,etal. Experimental treatment of chronicTrypanosomacruziinfection in mice with 2-n-propylquinoline[J].Phytother Res,2001,15(7):630-632.
[5] Chen R K, Yang X C, Tian H N,etal. Effect of tetrahydroquinoline dyes structure on the performance of organic dye-sensitized solar cells[J].Chem Mater,2007,19(16):4007-4015.
[6] Malinauskas T, Stumbraite J, Getautis V,etal. Multifunctional emissive material based on 1-phenyl-1,2,3,4-tetrahydroquinoline[J].Dyes Pigments,2009,81(2):131-136.
[7] Rano T A, McMaste E S, Pelton P D,etal. Design and synthesis of potent inhibitors of cholesteryl ester transfer protein(CETP) exploiting a 1,2,3,4-tetrahydroquinoline platform[J].Bioorg Med Chem Lett,2009,19(9):2456-2460.
[8] Bendale P, Olepu S, Suryadevara P K,etal. Second generation tetrahydroquinoline-based protein farnesyltransferase inhibitors as antimalarials[J].J Med Chem,2007,50(19):4585-4605.
[9] Pagliero R J, Lusvarghi S, Pierini A B,etal. Synthesis,stereoelectronic characterization and antiparasitic activity of new 1-benzenesulfonyl-2-methyl-1,2,3,4-tetrahydroquinolines[J].Bioorg Med Chem,2010,18(1):142-150.
[10] Wallace O B, Lauwers K S, Jones S A,etal. Tetrahydroquinoline-based selective estrogen receptor modulators(SERMs) [J].Bioorg Med Chem Lett,2003,13(11):1907-1910.
[11] Parmenon C, Guillard J, Caignard D H,etal. 4,4-Dimethyl-1,2,3,4-tetrahydroquinoline-based PPARα/γagonists.Part.II:Synthesis and pharmacological evaluation of oxime and acidic head group structural variations[J].Bioorg Med Chem Lett,2009,19(10):2683-2687.
[12] Roach S L, Higuchi R I, Hudson A R,etal. Tetrahydroquinoline glucocorticoid receptor agonists:Discovery of a 3-hydroxyl for improving receptor selectivity[J].Bioorg Med Chem Lett,2011,21(1):168-171.
[13] Mosberg H I, Yeomans L, Harland A A,etal. Opioid peptidomimetics:Leads for the design of bioavailable mixed efficacyμopioid receptor(MOR) agonist/δopioid receptor (DOR) antagonist ligands[J].J Med Chem,2013,56(5):2139-2149.
[14] Vellaisamy S, Carmen A, Carlos M J. CAN-catalyzed three-component reaction between anilines and alkyl vinyl ethers:Stereoselective synthesis of 2-methyl-1,2,3,4-tetrahydroquinolines and studies on their aromatization[J].Tetrahedron,2007,63(3):673-681.
[15] Han Z Y, Xiao H, Chen X H,etal. Consecutive intramolecular hydroamination/asymmetric transfer hydrogenation under relay catalysis of an achiral gold complex/chiral Brønsted acid binary system[J].J Am Chem Soc,2009,131(26):9182-9183.
[16] Kawano S, Horikawa M, Yasohara Y,etal. Microbial enantioselective reduction of aeetylpyridine derivatiyes[J].Biosci Biotechnol Biochem,2003,67(4):809-814.
[17] Zheng D J, Yang M, Zhuo J R,etal. Regio- and stereoselective benzylic hydroxylation to synthesize chiraltetrahydroquinolin-4-ol and tetrahydro-1H-benzo[b]azepin-5-ol withPseudomonasplecoglossicidas[J].J Mol Catal B:Enzym,2014,110:87-91.
[18] Jenna L E M, Emily T B, Helen C D,etal. Enhanced bioproduction of carvone in a two-liquid-phase partitioning bioreactor with a highly hydrophobic biocatalyst[J].Biotechnol Bioeng,2008,101(4):768-775.
[19] 陈永正,郑代军,刘小卒,等. 四氢喹啉-4-醇类衍生物的合成[J].合成化学,2014,22(5):687-690.
[20] León R, Femandes P, Pinheiro H M,etal. Whole-cell biocatalysis in organic media[J].Enzyme Microb Tech,1998,23(7-8):483-500.
《合成化学》加入超星公司学术期刊“域出版”
为进一步方便读者,紧跟“互联网+”潮流,《合成化学》于2015年6月起正式加入超星公司学术期刊“域出版”。“域出版”是借助移动出版技术,通过“以智带栏”的模式,主要依托移动智能终端的在线学术交流互动平台。该平台的APP(支持Android和ios)已经上线。
欢迎广大读者浏览下载。
《合成化学》编辑部
Asymmetric Hydroxylation of 1,2,3,4- Tetrahydroquinoline by Hydroxylase-catalyzed Hydroxylation in Two-phase Reaction System
LI Ke, YANG Min, CUI Bao-dong, CHEN Yong-zheng*
(School of Pharmacy, Zunyi Medical University, Zunyi 563000, China)
(R)-4-hydroxy-1,2,3,4-tetrahydroquinoline was synthesized by hydroxylation of 1,2,3,4-tetrahydroquinoline using the whole-cell ofPseudomonasplecoglossicidasZMU-T02 as biocatalyst. The structure was confirmed by1H NMR,13C NMR, HR-MS and HPLC. Under the optimized reaction conditions[cell density 30 g cdw·L-1, pH 9.0, 50%(V/V) hexadecane as co-solvent], when substrate concentration was 10 mmol·L-1, the yield andeewere 37% and 98%, respectively.
1,2,3,4-tetrahydroquinoline; asymmetric hydroxylation; (R)-4-hydroxy-1,2,3,4- tetrahydroquinoline; biocatalysis; synthesis; two-phase reaction
2016-01-06
国家自然科学基金资助项目(21162047); 贵州省科技厅项目(QKHGZ-2011-7017)
李珂 (1992-),女,穿青族,贵州安顺人,硕士研究生,主要从事生物催化研究。
陈永正,教授, Tel. 0851-28642336, E-mail: yzchen@zmc.edu.cn
O626.3; O643.3
A
10.15952/j.cnki.cjsc.1005-1511.2016.04.16010
