高产几丁质酶的粘质沙雷氏菌株的诱变选育1)
2016-05-06胡基华陈静宇曹旭孟力强姜威刘宇帅张淑梅李晶
胡基华 陈静宇 曹旭 孟力强 姜威 刘宇帅 张淑梅 李晶
(黑龙江省科学院微生物研究所,哈尔滨,150010) (黑龙江省科学院高技术研究院)
高产几丁质酶的粘质沙雷氏菌株的诱变选育1)
胡基华陈静宇曹旭孟力强姜威刘宇帅张淑梅李晶
(黑龙江省科学院微生物研究所,哈尔滨,150010)(黑龙江省科学院高技术研究院)
摘要以黑龙江省科学院微生物研究所实验室保存的1株粘质沙雷氏菌S68为出发菌株,进行原生质体紫外线、NaNO2和复合诱变,通过透明圈对比和酶活测定,最终获得1株产酶量高于原始菌株4.3倍的粘质沙雷氏菌诱变菌株,产酶量达到4.98 μg·h(-1)。确定该菌株最佳诱变方法为复合诱变,首先进行紫外诱变(高度为30 cm,诱变时间为12 s),再用化学诱变(0.4 mol·L(-1)NaNO2诱变5 min),经验证该诱变菌株遗传稳定。
关键词粘质沙雷氏菌;几丁质酶;诱变
分类号Q93-31
High Chitinase ofSerratiamarcescensStrain Mutation
Hu Jihua, Chen Jingyu
(Institute of Microbiology, Heilongjiang Academy of Sciences, Harbin 150020, P. R. China); Cao Xu, Meng Liqiang, Jiang Wei, Liu Yushuai, Zhang Shumei, Li Jing(Institute of Advanced Technology, Heilongjiang Academy of Science)//Journal of Northeast Forestry University,2016,44(3):106-109.
WithSerratiamarcescensS68 in the Heilongjiang Academy of Sciences Institute of Microbiology Laboratory, we obtained an enzyme production 4.3 times higher than the original strain ofS.marcescensmutant strain by using protoplast ultraviolet, NaNO2and composite mutagenesis, with the enzyme production of 4.98 μg·h-1. We determined that the best methods of mutagenesis of the strain was the composite mutagenesis by first UV mutation (height of 30 cm, for mutagenesis time of 12 s), and then the chemical mutagenesis (0.4 mol·L-1NaNO2mutagenesis for 5 min).
KeywordsSerratia marcescens; Chitinase; Mutation
粘质沙雷氏菌(Serratiamarcescens)亦称灵杆菌,是革兰氏阴性兼性厌氧杆菌,属于肠杆菌科克白雷氏菌族中的沙雷氏菌属,为该属的代表菌种,多存在于沿海盐碱土壤中,能产生几丁质酶[1]。
几丁质酶具有多种生理功能,应用领域十分广泛。自Benecke首次报道了枯草芽孢杆菌(Bacilluschitinovorus)能够产生几丁质酶以来,又发现了许多产几丁质酶的微生物种类,包括细菌、放线菌和真菌等。其中对粘质沙雷氏菌、褶皱链霉菌普安变种(Streptomycesplicatusvar.puanensis)及创伤贝内克氏菌(Vibriovulnificus)[2-4]的研究较多。1986年Schlumbaum et al.[5]首次报道了提纯的菜豆几丁质酶具有抗真菌活性。接下来的研究[6]发现,提纯的烟草、马铃薯、黄瓜等多种植物几丁质酶对立枯丝核菌等20多种病原真菌和非病原真菌的菌丝生长或孢子萌发具有抑制作用。Minic et al.[7]研究表明,几丁质酶可以参与共生固氮调控;Stangarlin et al.[8]的研究发现几丁质酶参与植物光合作用等过程。几丁质酶制剂可以阻碍有害生物几丁质的正常合成,是一类长效的、具有选择性的杀虫剂或杀菌剂,在农药生产中有较高应用价值[9]。目前应用于工业化的生产菌株几乎毫无例外都是经过诱变育种、化学诱变和原生质体融合技术或基因工程等方法对菌种进行改造而获得的,其中最为突出的例子就是青霉素生产菌种的选育。目前微生物几丁质酶的研究与应用取得了一些成就,但与实际需要还有一些差距,主要表现在筛选的菌株产酶量低,且酶活不稳定。
为了获得产几丁质酶活力高的菌株,对黑龙江省科学院微生物研究所实验室分离并保存的1株粘质沙雷氏菌S68进行紫外、NaNO2单因素和复合诱变,通过平板几丁质透明圈初筛、酶活测试和摇瓶复筛,筛选出1株高产几丁质酶的诱变株,并对该菌株的遗传稳定性进行验证。
1材料与方法
1.1材料
菌种为黑龙江省科学院微生物研究所实验室保存的粘质沙雷氏菌种S68。
完全培养基的配比为葡萄糖5.00 g·L-1、牛肉膏1.50 g、蛋白胨5.00 g·L-1、酵母膏3.00 g·L-1、NaCl 3.50 g·L-1、K2HPO43.65 g·L-1、KH2PO41.32 g·L-1。在完全培养基中添加0.50 mol·L-1蔗糖、0.02 mol·L-1顺丁烯二酸、0.5%酪素即为高渗培养基。
1.2方法
1.2.1菌种培养
取粘质沙雷氏菌斜面保存的菌种1环,接入5 mL试管中,30 ℃、150 r·min-1培养16 h;将试管中培养好的菌液以2%接种量接入到装液量30 mL的250 mL的三角瓶中,30 ℃、150 r·min-1培养16 h。
1.2.2原生质体制备
取发酵18 h的菌液10 mL,16 000 r·min-1离心15 min,菌体用0.01 mol·L-1Tris缓冲液(pH=7.0)离心洗涤3次。再用高渗Tris缓冲液悬浮,加入预热的溶菌酶溶液,37 ℃水浴处理后,加入EDTA至0.01 mol·L-1,在37 ℃中保温。
1.2.3紫外诱变
取10 mL 1.2.2方法制备得到的原生质体高渗悬液转入培养皿中,放在磁力搅拌器上,在距紫外灯30 cm处搅拌状态下照射12 s,取照射后的细胞悬液,在黑暗中用SMM缓冲液稀释至原浓度的10-6倍,涂布作为对照。将上述平板做避光处理,置于培养箱中30 ℃恒温培养24 h后进行菌落计数,并计算出致死率。
1.2.4NaNO2诱变
依次取摇瓶培养16 h的菌悬液5 mL,加入2 mL 0.10 mol·L-1的NaNO2,分别作用5、10、15 min后,加入2 mL 0.7 mol·L-1的NaHPO4终止反应[10]。以相同处理方法分别再用0.2、0.4 mol·L-1的NaNO2诱变菌悬液各5、10、15 min。将上述处理及对照分别用生理盐水稀释至原浓度的10-6倍后涂布初筛平板,置于培养箱中30 ℃恒温培养24 h后进行菌落计数。重复3次,结果取其平均值。
1.2.5复合诱变
将经过原生质体紫外线诱变后的菌悬液再经NaNO2诱变处理,将上述处理及对照分别稀释至原浓度的10-6倍后涂布初筛平板,依次标记为UN和NU后,置于培养箱中28 ℃恒温培养24 h后进行菌落计数。重复3次,结果取其平均值。
1.2.6粘质沙雷氏菌S68生长曲线测定
以1%的接种量接种装有5 mL培养基的试管中培养16 h,转接到装液量为100 mL的250 mL三角瓶中培养,150 r·min-1连续培养72 h,每隔4 h取样,600 nm测生物量,制粘质沙雷氏菌的生长曲线。
1.2.7酶活测定
N-乙酰葡萄糖胺(NAG)标准曲线:配置质量浓度12.5、25.0、37.5、50.0、62.5、75.0、87.5、100.0 g·L-1的N-乙酰葡萄糖胺溶液,测定其在585 nm条件下的光吸收值,得到标准曲线(图1)。
粘质沙雷氏菌S68酶活:配制培养基500 mL,分装到10个250 mL的三角瓶中,每瓶45 mL培养基加入5 mL几丁质,1%接种量接入诱变菌株,培养条件与测生长曲线相同,分别在36、38、40、42、44 h各取2瓶,分别使用体积分数为35%和75%的硫酸铵逐级沉淀蛋白提取粗酶(每个梯度24 h),除盐浓缩后,取0.4 mL样品,0.4 mL蒸馏水为空白对照,分别加入0.4 mL的0.05 mol·L-1醋酸液,0.4 mL的胶体几丁质(1%),37 ℃水浴(2 h),降解几丁质成单糖;离心(4 000 r·min-1、4 ℃、10 min)取0.4 mL上清液加入40 μL 1%蜗牛酶水浴(37 ℃,30 min),加入0.2 mL饱和硼砂缓冲;干式恒温器100 ℃,7 min,冷却后再加入2 mL冰醋酸和1 mL体积分数为1%的DMAB水浴(37 ℃,15 min)进行显色反应,585 nm测吸光度,酶活力单位(U)表示在上述反应条件下,每1 min时间内产生1 μmol NAG所需要的酶量。

图1 N-乙酰葡萄糖胺标准曲线(OD585nm)
2结果与分析
2.1粘质沙雷氏菌S68 NaNO2诱变
通过对生物量的测量,图2显示,粘质沙雷氏菌S68生长较快,12 h进入对数生长期,20 h菌体处于稳定期,本研究取生长16 h的菌液做化学、紫外和复合诱变。

图2 粘质沙雷氏菌S68菌株的生长曲线
NaNO2不同作用浓度,不同作用时间对粘质沙雷氏菌悬液的诱变效果(致死率)见图3。相同时间条件下,浓度高的致死率高。在同一浓度下,致死率随着时间延长,0.10 mol·L-1处理在5、10、15、20 min的死亡率分别为20%、51%、82%、98%,在第25分钟时死亡率为100%;0.2 mol·L-1处理在5、10、15 min死亡率分别为41%、59%、82%,在第20分钟时死亡率为100%;0.4 mol·L-1处理在5、10、15 min死亡率分别为68%、84%、94%,在第20分钟时死亡率为100%;根据致死率选择0.1、0.2、0.4 mol·L-13个浓度,诱变时间选择5、10、15 min,进行诱变试验。

图3 化学诱变的致死曲线
通过NaNO2诱变共得到52株酶圈大于空白对照的菌株,表1显示HC值较大的5株菌,编号为M1~M5,比值按从大到小进行排列。结果显示经NaNO2诱变后,菌落直径和透明圈直径都有不同程度的缩小,但是HC值要大于空白对照,其中诱变株M1相比出发菌株CK的HC值提高了21.9%。
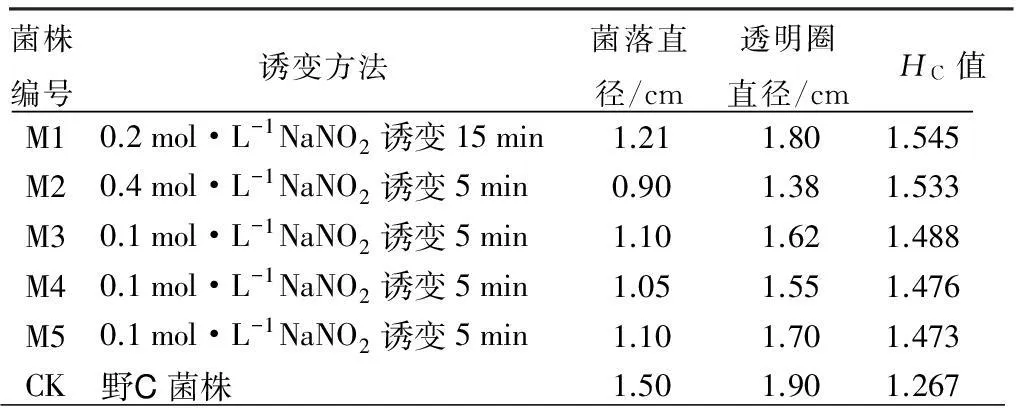
表1 化学诱变菌圈直径
2.2粘质沙雷氏菌S68紫外诱变
紫外线不同照射时间,不同照射高度作用于粘质沙雷氏菌原生质体的致死曲线见图4。随着照射时间的延长,照射源与菌液之间距离越近,致死率越高。在20 cm高度,照射5、10、15、20 min的死亡率分别为38%、68%、83%、99%,在第25分钟时死亡率为100%;在30 cm高度,照射5、10、15 min的死亡率分别为51%、78%、91%,在第20分钟时死亡率为
100%;在40 cm高度,照射5、10、15 min的死亡率分别为75%、89%、95%,在第20分钟时死亡率为100%;本研究选择照射高度在30 cm高度,作用时间为10~12 s进行试验。
通过紫外诱变共获得48株HC值大于空白对照的菌株,挑选最大的5株列于表2,编号为UM1~UM5。由表2可以看出,经原生质体紫外线诱变后,各诱变株的菌落直径差异不明显,菌落直径和透明圈直径都有不同程度的缩小,其中UM1比空白对照CK提高了6%。
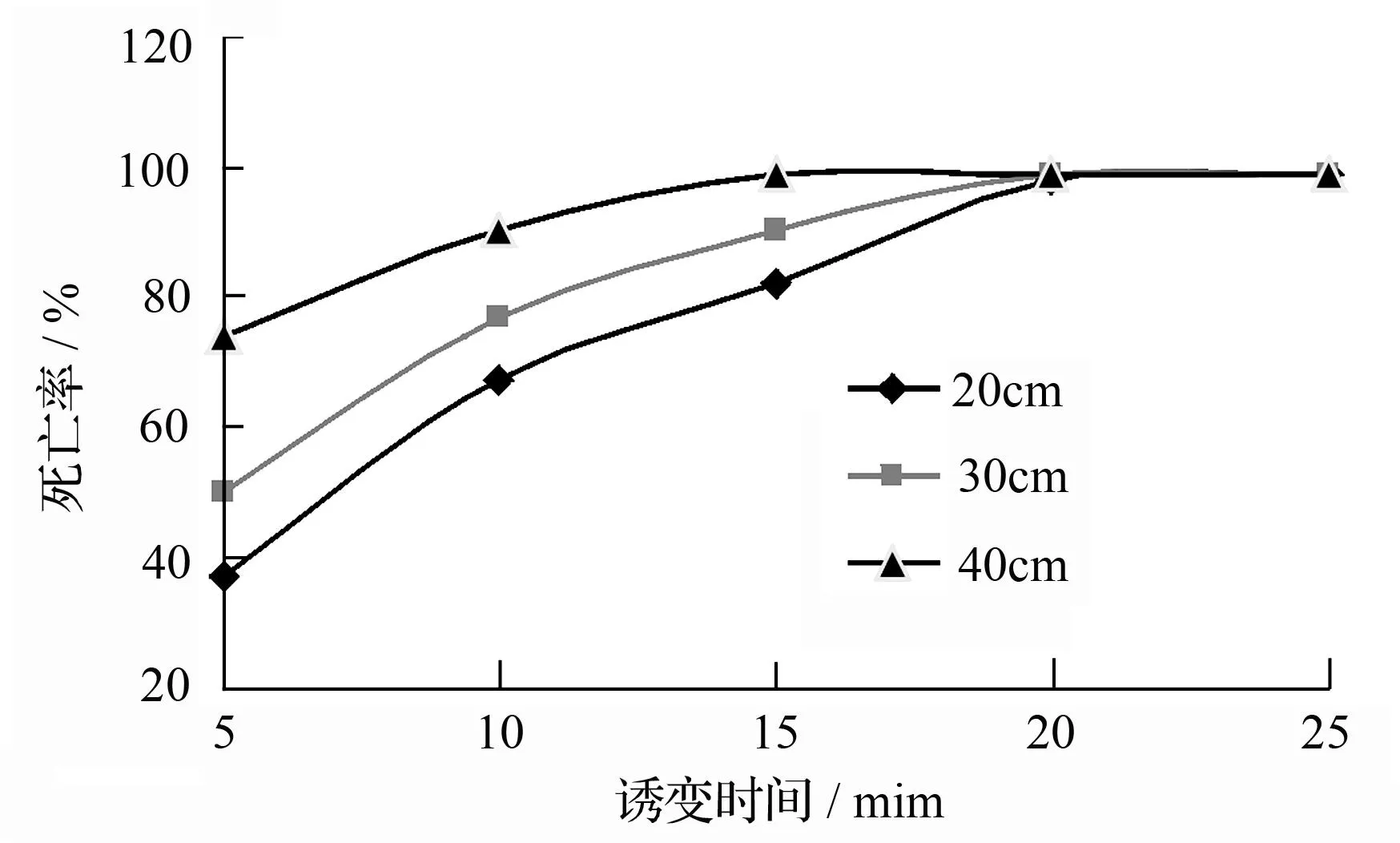
图4 原生质体紫外诱变的致死曲线

菌株编号诱变方法菌落直径/cm透明圈直径/cmHC值UM1高度30cm诱变15s1.281.701.375UM2高度30cm诱变12s0.720.961.333UM3高度30cm诱变12s1.301.701.328UM4高度30cm诱变10s1.201.651.308UM5高度30cm诱变12s1.181.541.305CK野生菌株1.301.681.292
2.3粘质沙雷氏菌S68复合诱变
将经原生质体紫外线诱变得到的菌株再用NaNO2进行诱变后,挑取HC值相对较大的10株菌依次编号为CM1~CM10(表3)。由表3可以看出,对比2种不同的单因素诱变技术,复合诱变方法对该菌株具有更好的诱变效果,菌落直径和透明圈直径都未减小,CM5号菌株HC值比出发菌株CK提高了40.7%。
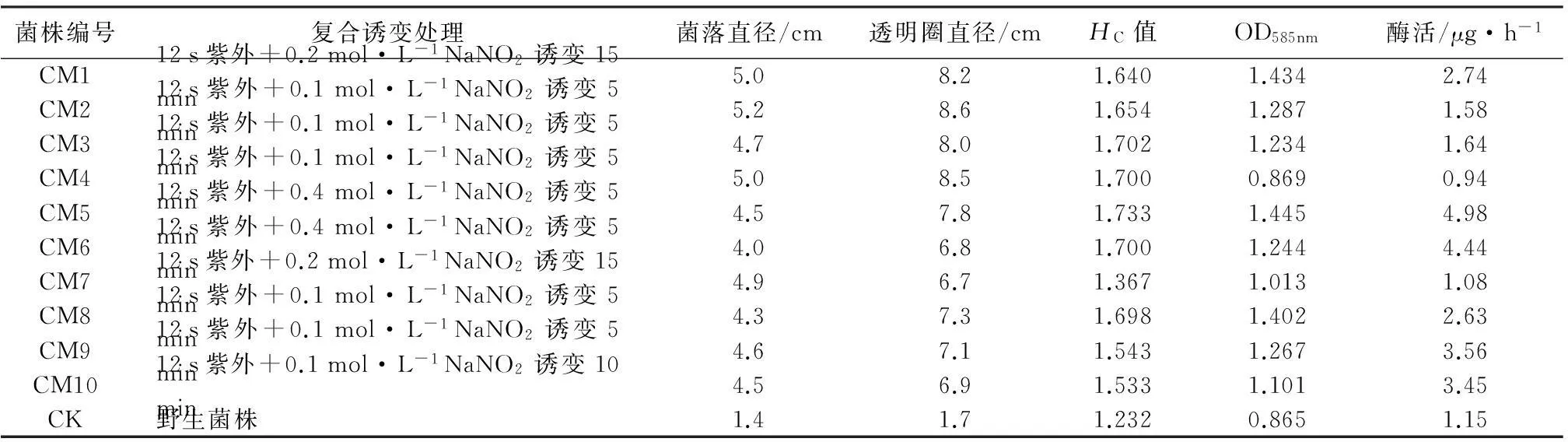
表3 不同复合诱变处理下菌株透明圈的筛选和酶活性
图5显示复合诱变株在60 h后产生透明酶圈。在培养64 h后,CM5菌株酶活值为4.98 μg·h-1,与原始菌株相比酶活提高了4.3倍(表3)。

图5 复合诱变平板初筛结果
2.4诱变菌株CM5遗传稳定性
将诱变菌株CM5培养10代,测定第2、4、6、8、10代酶活(表4),结果显示产酶均比较稳定,说明复合诱变方法在提高出发菌株几丁质酶活力的同时并具有遗传稳定性。

表4 诱变菌株CM5传代稳定性试验
3结论与讨论
以黑龙江省科学院微生物研究所实验室保存的1株粘质沙雷氏菌S68为出发菌株,利用NaNO2、紫外和复合诱变3种方法筛选出1株产几丁质酶酶活高的菌株CM5。确定其最佳诱变方法为复合诱变:在紫外诱变(高度为30 cm,诱变时间为12 s)后,再用化学诱变(0.4 mol·L-1NaNO2诱变5 min)。在单因素诱变试验中,化学诱变的效果好于紫外诱变。影响NaNO2诱变的主要因素是浓度,在相同时间条件下,随着浓度的提高,致死率也提高;在0.1、0.2 mol·L-1时,随着时间的延长,诱变对菌株致死率不明显。在对红色素产生菌RZ21的原生质体紫外诱变育种研究中也有类似现象[11],推测是由于NaNO2引起DNA链碱基之间的互换,使其在自我复制时产生DNA链分子突变,因此诱变效果随NaNO2作用时间延长而未见明显提高[12]。紫外诱变试验中,诱变时间固定时,菌液离照射源越近致死率越高,而在距离一定时,菌液随着时间加长致死率升高。
近年来,随着几丁质衍生物的研究和开发,其在医药、食品和环保等众多领域都有广阔的应用前景,微生物几丁质酶在害虫防治中具有增效作用,可以作为物理屏障阻碍寄生物入侵,海洋中也积聚有丰富的几丁质[13]。随着现代分子生物学的快速发展,基因水平的育种方法日趋成为主流,但传统的物理与化学诱变方法作为生物学诱变方法的基础,在某些领域以及基因育种的辅助手段依然具有重要的应用价值。
笔者接下来将对高产几丁质酶菌株CM5进行培养基和培养条件研究,通过对液体最佳氮碳源、pH值、培养浓度进行研究,获得酶活稳定的高活性几丁质酶成品,为细菌几丁质酶的应用提供技术支撑。
参考文献
[1]阎瑞香,张娜,关文强,等.重组几丁质酶对不同果蔬病原真菌的抑菌效果研究[J].华北农学报,2014,29(4):155-159.
[2]COHEN-KUPIEC R, CHET I. The molecular biology of chitin digestion[J]. Current Opinion in Biotechnology,1998,9(3):270-277.
[3]陈三丰,李季伦.几丁质酶研究历史和发展前景[J].微生物学通报,1993,20(3):156-160.
[4]CLARKE P H, TRACERY M V. The occurrence of chitinase in some bacteria[J]. J Gen Microbiol,1956,14(1):188.
[5]SCHLUMBAUM A, MAUCH F. Plant chitinases are potent inhibitors of fungal growth[J]. Nature,1986,324:365-367.
[6]COLLINGE D B, KRAGH K M, MIKKELSEN J D, et al. Plant chitinases[J].The Plant Jornal,1993,3(1):31-40.
[7]MINIC Z, BROWN S, KOUCHKOVSKY Y, et al. Purifieation and charaeterization of a novel chitinase-lysozyme, of another chitinase, both hydrolyzingRhizobiummelilotinod faetors, and of a pathogenesis-related protein fromMedieagosativaroots[J]. Biochemical Journal,1998,332(2):329-335.
[8]STANGARLIN J R, PASCHOLATI S F. Activities of ribulose-1,5-bisphosphate carboxylase-oxygenase (rubisco), chlorophyllase, beta-1,3 glucanase and chitinase and chlorophyll content in bean cultivars (Phaseolusvulgaris) infected withUromycesappendiculatus[J]. Phytopathologiea,2000,26(1):34-42.
[9]尹鸿翔,张杰,侯若彤,等.一株几丁质酶产生菌的分离鉴定及其灭蝗增效作用[J].植物保护,2004,30(2):37-41.
[10]范琳,牛艳芳,房耀维.高产纤维素酶菌株的诱变选育研究[J].内蒙古师范大学学报(自然科学汉文版),2004,33(2):195-198.
[11]夏顺翔,张魁,贾秉晟,等.红色素产生菌RZ21菌株的原生质体紫外诱变育种研究[J].安徽农业科学,2010,38(6):2782-2792.
[12]康乐,高园园,张魁,等.黏质沙雷氏菌产几丁质酶的诱变[J].江苏农业科学,2012,40(4):359-361.
[13]刘海燕,丁存宝,贾长虹,等.微生物几丁质酶的应用研究进展[J].河北农业科学,2008,12(11):68-69.
收稿日期:2015年9月14日。
第一作者简介:胡基华,女,1970年8月生,黑龙江省科学院微生物研究所,助理研究员。E-mail:158631375@qq.com。通信作者:李晶,黑龙江省科学院微生物研究所,黑龙江省科学院高技术研究院,研究员。E-mail:lijing0706@sohu.com。
1)黑龙江省院所基本应用技术研究专项课题。
责任编辑:程红。
