授粉对烟草花柱引导组织结构的影响
2016-05-06王玲丽刘文哲
陈 妍,王玲丽,2,刘文哲*
(1 西北大学 生命科学学院,西安 710069;2 运城学院 生命科学系,山西运城 044000)
授粉对烟草花柱引导组织结构的影响
陈妍1,王玲丽1,2,刘文哲1*
(1 西北大学 生命科学学院,西安 710069;2 运城学院 生命科学系,山西运城 044000)
摘要:花柱内引导组织是花粉管生长时的必需结构,对花粉管的生长具有支持、营养、引导生长等重要作用。为了研究授粉对花柱引导组织结构的影响,该研究对烟草开花后不授粉及授粉1~4 d内的花柱引导组织结构动态进行了观察比较。研究发现:未授粉花柱内的引导组织的变化是一个类似于衰老的死亡过程,授粉后花柱内引导组织细胞发生剧烈变化,细胞快速死亡,与未授粉花柱的引导组织的变化完全不同,它们可能是两种完全不同的调控方式。
关键词:烟草;授粉及不授粉;花柱引导组织;结构;DAPI
被子植物有性生殖的成功需要花粉内的精细胞分别与胚珠内的卵细胞及中央细胞结合,由于精细胞无法移动,因此,这一过程需要多种器官相互配合才能够顺利完成[1]。例如,柱头花粉的附着、水合作用,花粉管的萌发与生长,以及两个精细胞分别与卵细胞、中央细胞结合等过程均需要多种生殖器官参与。双受精过程主要是在柱头、花柱、珠柄、子房这些器官中完成的[2],其中柱头、花柱、珠柄是花粉管生长的主要场所[3]。
花柱连接柱头与子房,是雌性生殖器官的重要组成部分,为花粉管生长的主要部位[4]。花柱主要有两种类型:开放型和闭合型[5]。开放型花柱是中空的,例如百合(Liliumbrownii)[6]。而闭合型花柱中充满了特殊的薄壁细胞,它们被称为引导组织[7]。引导组织细胞为梭形,细胞直径小,细胞质浓厚,仅具初生壁;细胞间隙较大,其间充满了细胞外基质,主要由多糖、脂类和糖蛋白等物质构成[8]。
对于闭合或者半闭合型花柱的植物来说,花粉管从柱头萌发后向子房生长时,必须经过花柱内的引导组织,引导组织为花粉管的生长提供了良好的环境。目前对于引导组织的具体作用尚不明确,大部分研究认为引导组织为花粉管的生长提供了支持、营养以及引导花粉管的生长的作用[8-10]。但引导组织对花粉管的引导作用存在争议,因为引导花粉管生长方向的短距离信号是由胚珠释放的[11]。同时引导组织支持花粉管进行由顶部向基部生长这一运动的机制也尚未有研究证明[12]。此外,有研究认为引导组织也可能与某些物种的种间不亲和以及自交不亲和有关[13-14]。
花粉管在引导组织的生长速率要大于体外生长速率[15],说明引导组织减小了花粉管在花柱中生长的困难程度,为花粉管的生长提供了有利的条件与环境。引导组织细胞以及细胞外基质可以促进花粉管的生长。在缺少引导组织的拟南芥(Arabidopsisthaliana)突变体中,其结实率下降[16],说明引导组织直接影响了植物的结实率。在猕猴桃(Actinidiachinensisvar.deliciosa)和拟南芥中,花粉管生长时引导组织细胞会出现死亡,这说明引导组织的死亡可能也加快花粉管生长[16-17]。但是,对于授粉与引导组织细胞死亡间的时空关系并不清楚。
烟草(Nicotianatabacum)花柱为半实心花柱[4],且其花柱较长(4~5 cm),因此授粉后花柱细胞的变化较为缓慢。我们以烟草花柱为材料,通过与未授粉花柱比较,研究了授粉对花柱引导组织结构的影响。以阐明随着花粉管的生长,烟草花柱内引导组织、花粉管、细胞外基质之间的时空关系,为进一步探讨花粉管与引导组织之间的相互作用机制提供一定的理论证据。
1材料和方法
烟草于2014年8月种植于西北大学生物园内,开花后进行处理、取样。
烟草的单花花期一般为4~5 d。花粉管在授粉45 h后到达胚珠完成受精[18]。在烟草开花前1 d,选取发育时期相同的花蕾30朵,去雄后套袋。待去雄的花蕾开放后,对15朵花进行人工授粉后套袋;另15朵不授粉套袋作为对照。分别收集上述处理后1至4 d的花柱,将其固定于2.5%戊二醛(pH 7.0)中,4 ℃保存。
取固定于2.5%戊二醛的花柱,磷酸缓冲液(pH 7.0)冲洗3次,1%锇酸后固定3 h,磷酸缓冲液(pH 7.0)漂洗,对其进行梯度酒精脱水后用环氧树脂包埋。Reichert-jung(Vienna Austria)超薄型切片机切片,厚度为2 μm。甲苯胺蓝染色后,Nikon Eclipse 50i (Nikon Japan)显微镜观察拍照。
取上述样品,酒精梯度脱水后用石蜡包埋。Leica RM 2135石蜡切片机切片,厚度为8 μm。切片经二甲苯脱蜡,酒精梯度复水后,用DAPI对其细胞核进行染色。Leica DMLB荧光显微镜观察拍照,激发波长为340~380 nm。
2结果与分析
2.1烟草花柱的结构
开花时烟草花柱的长度为4~5 cm,为了比较烟草花柱上部与下部的结构差异,我们选取烟草花柱柱头下1 cm和子房上1 cm的部位进行横切(图版Ⅰ,1)。烟草的花柱由表皮、皮层、维管束和位于中央的引导组织构成(图版Ⅰ,2、3)。由于细胞外基质易被甲苯胺蓝着色,因此引导组织与周围的组织颜色差异明显(图版Ⅰ,2、3)。花柱上部引导组织整体呈哑铃型(图版Ⅰ,2),而下部分则为圆形或者椭圆形(图版Ⅰ,3)。虽然上、下部引导组织的形状不同,但其引导组织细胞结构相似,细胞直径小,细胞质浓厚,细胞间隙内充满了易被甲苯胺蓝染色的细胞外基质。
2.2未授粉烟草花柱引导组织的结构变化
通过对花开放1~4 d内花柱引导组织结构变化的比较。发现开花初期(1 d)上部引导组织呈哑铃型,染色后着色较浅。引导组织细胞排列紧密,胞间隙小,细胞质浓厚(图版Ⅰ,4、8)。第2天引导组织出现了明显的变化,其细胞间隙增大,细胞外基质明显增多(图版Ⅰ,5、9),该现象持续到开花后3 d(图版Ⅰ,6、10)。细胞出现明显的死亡迹象发生在第4天,此时细胞外基质进一步增多,着色程度明显下降(图版Ⅰ,7),细胞液泡化明显,细胞质出现皱缩(图版Ⅰ,11)。
花柱下部引导组织的变化滞后于上部。开花前2 d,除形状外,下部引导组织与上部花柱无明显差异(图版 Ⅰ,12、13、16、17)。从第3天开始,下部引导组织细胞进入死亡进程,其细胞间隙大小及出现部位、发生皱缩的细胞明显少于上部引导组织(图版Ⅰ,10、11、18、19),细胞外基质的着色情况与开花前2 d上部引导组织无显著差别(图版Ⅰ,4、5、14、15)。
2.3授粉后烟草花柱引导组织的结构变化
授粉后,引导组织上部细胞外基质的分泌明显高于未授粉花柱内引导组织(图版Ⅱ,1~16;图版Ⅰ,4~19)。同时,引导组织细胞由于花粉管的进入发生变形(图版Ⅱ,1、5;图版Ⅰ,4、8)。授粉后第3天,因大部分花粉管已进入胚珠完成受精,花柱内大部分花粉管开始降解,同时上部的引导组织细胞大量降解,仅存细胞壁,只有少量细胞可见其细胞核与少量细胞器。细胞外基质变得丰富着色较深(图版Ⅱ,3、7)。第4天,引导组织中央的细胞大部分死亡,形成了空腔(图版Ⅱ,4、8)。
授粉后前2 d,花柱下部引导组织与上部引导组织表现出明显的差异(图版Ⅱ,9、10、13、14;图版Ⅱ,1、2、5、6),而与未授粉2、3 d上部引导组织类似(图版Ⅰ,5、6、9、10)。直至授粉后第3天,下部引导组织才出现上部授粉后1 d的变化,即引导组织细胞变形(图版Ⅱ,11、15;图版Ⅱ,1、5)。在此之后,下部引导组织的变化进程明显加快,到授粉后第4天,引导组织的中央形成了一个大的空腔(图版Ⅱ,12、16)。下部引导组织2 d内经历的结构变化与上部4 d内的变化类似。
2.4烟草花柱引导组织的细胞核动态
为了进一步说明引导组织细胞内细胞核的动态变化,我们对未授粉和授粉花柱上部引导组织细胞核分别进行了DAPI染色。未授粉情况下,开花后第1天,引导组织细胞的大部分细胞的细胞核为球形,染色质分布均匀。只有少量的细胞有较强的荧光(图版Ⅲ,1)。此后,引导组织内的细胞核的荧光逐渐增强(图版Ⅲ,2),第3天,细胞核出现变形(图版Ⅲ,3)。第4天后,大部分细胞已降解,发出荧光的细胞核明显减少(图版Ⅲ,4)。
授粉后,细胞核的变化更加剧烈。授粉后1 d,细胞核的荧光强度要明显高于同一时期未授粉花柱(图版Ⅲ,5、1),这一现象一直持续到授粉后2 d(图版Ⅲ,6)。与未授粉花柱不同,授粉后第3天细胞核开始发生降解(图版Ⅲ,7),至第4天细胞核几乎完全降解(图版Ⅲ,8)。
3讨论
烟草的单花花期4~5 d,没有授粉的花朵在开放后的4~5 d会萎蔫脱落。如果不授粉,花柱内的引导组织在1~3 d内细胞外基质逐渐增加,细胞间隙逐渐增大。到第3天引导组织内细胞外基质的分泌达到了最高值,这是引导组织等待授粉的表现,与烟草柱头可授性维持时间相吻合[19]。在此过程中,其细胞液泡化程度增加,细胞核形状改变和染色质凝集现象趋于明显,一部分细胞已经开始死亡。直到花期即将结束时,大部分引导组织细胞迈入死亡的历程。由此可见,未授粉引导组织细胞死亡过程也是一个受到调控的、有序的细胞死亡的过程。
而授粉后的引导组织与不授粉的有着截然不同的表现。授粉1 d后,上部引导组织整体形状由哑铃形变为长椭圆形,花粉管周围的引导组织细胞变形,细胞核染色体凝聚,细胞外基质明显增多。而下部引导组织在授粉1 d后,并没有发生明显变化,其形态如同未授粉的花柱。下部引导组织形态结构发生变化发生在授粉第3天。烟草授粉后,花粉管要经历45 h才能到达子房,因而,授粉1 d后花粉管只长到花柱的2~3 cm处[20],此时上部引导组织变化及3 d后下部的变化,恰好说明引导组织细胞的形态结构变化是花粉管生长引起的。授粉第4天,不管上部还是下部,引导组织细胞大量降解,中央形成空腔。引导组织形态结构随授粉时间的变化,是花柱内引导组织对花粉管生长做出一系列的响应,并随着授粉的结束最终走向死亡。由此,我们认为授粉后烟草花柱引导组织的死亡是由花粉管生长所引发的,死亡信号是由花粉管生长过程所释放,而并非授粉时所释放的信号引起。因为授粉发生后,花粉管尚未长到的引导组织发生的变化并不明显。
总之,烟草花柱包括其内的引导组织,不管授粉与否,在开放后第4~5天走向死亡。但其时空变化和死亡特征似乎不尽相同。未授粉的花柱内的引导组织不会立刻死亡,或者只有少部分细胞死亡,并通过释放大量细胞外基质来等待授粉和花粉管的生长,这是植物对争取最大受精机率的一种适应。如果一直没有花粉管生长,引导组织会随整个花器官的脱落而降解,而这种死亡更类似于衰老[21]。引导组织的作用是为花粉管的生长提供营养和物理空间[22],授粉后,特别是花粉管生长会引导组织发生剧烈的变化。我们推测,花粉管生长过程中,其顶端会释放某种信号分子引发引导组织进入死亡程序,Wang等[23]认为花粉管生长会引起引导组织特有mRNA Poly(A)末端缩短,最终导致引导组织细胞进入死亡程序。拟南芥子房内引导组织在授粉后也发生相同的变化[16],但其花柱内的引导组织却似乎并未发生死亡[24]。猕猴桃的柱头臂的内引导组织在授粉后也会发生类似于烟草花柱的变化[17]。因此,授粉后花粉管生长所释放的信号类似于侧根或不定根发生时引起皮层和表皮细胞死亡的信号[25]。Gonzalez等[26]认为花粉管与花柱之间相互作用是一个类似于病原体入侵的过程。因此,引导组织与花粉管之间的相互作用机制尚需要进一步的研究。
参考文献:
[1]PALANIVELU R,TSUKAMOTO T.Pathfinding in angiosperm reproduction:pollen tube guidance by pistils ensures successful double fertilization[J].WileyInterdisciplinaryReviews:DevelopmentalBiology,2012,1(1):96-113.
[2]EDLUND A F,SWANSON R,PREUSS D.Pollen and stigma structure and function:the role of diversity in pollination[J].ThePlantCell,2004,16(S1):S84-S97.
[3]CRAWFORD B C W,YANOFSKY M F.The formation and function of the female reproductive tract in flowering plants[J].CurrentBiology,2008,18(20):R972-R978.
[4]胡正海,刘文哲.植物解剖学[M].北京:高等教育出版社,2010:279-282.
[5]KRONESTEDT-ROBARDS E C,WALLES B,JOHANSSON M.Histogenesis of the transmitting tract inStrelitziareginae[J].NordicJournalofBotany,2001,21(1):63-74.
[6]TILTON V R,HORNER J R H T.Stigma,style,and obturator ofOrnithogalumcaudatum(Liliaceae) and their function in the reproductive process[J].AmericanJournalofBotany,1980:1 113-1 131.
[7]BYSTEDT P A,VENNIGERHOLZ F.The transmitting tract inTrimeziafosteriana(Iridaceae)[J].NordicJournalofBotany,1991,11(3):345-357.
[8]HRISTOVA K,LAM M,FEILD T,etal.Transmitting tissue ECM distribution and composition,and pollen germinability inSarcandraglabraandChloranthusjaponicus(Chloranthaceae)[J].AnnalsofBotany,2005,96(5):779-791.
[9]GONZALEZ M V,COQUE M,HERRERO M.Pollen-pistil interaction in kiwifruit (Actinidiadeliciosa;Actinidiaceae)[J].AmericanJournalofBotany,1996:148-154.
[10]CHEUNG A Y,WANG H,WU H.A floral transmitting tissue-specific glycoprotein attracts pollen tubes and stimulates their growth[J].Cell,1995,82(3):383-393.
[11]HIGASHIYAMA T,YABE S,SASAKI N,etal.Pollen tube attraction by the synergid cell[J].Science,2001,293(5 534):1 480-1 483.
[12]LOSADA J M,HERRERO M.Glycoprotein composition along the pistil ofMalus×domesticaand the modulation of pollen tube growth[J].BMCPlantBiology,2014,14(1):1.
[13]SMITH A G,EBERLE C A,MOSS N G,etal.The transmitting tissue ofNicotianatabacumis not essential to pollen tube growth,and its ablation can reverse prezygotic interspecific barriers[J].PlantReproduction,2013,26(4):339-350.
[14]陈迪新.梨花粉萌发,生长及花柱S基因表达特性[D].南京:南京农业大学,2005.
[15]PALANIVELU R,PREUSS D.Distinct short-range ovule signals attract or repelArabidopsisthalianapollen tubesinvitro[J].BMCPlantBiology,2006,6(1):7.
[16]CRAWFORD B C W,DITTA G,YANOFSKY M F.The NTT gene is required for transmitting-tract development in carpels ofArabidopsisthaliana[J].CurrentBiology,2007,17(13):1 101-1 108.
[18]TIAN H Q,RUSSELL S D.Calcium distribution in fertilized and unfertilized ovules and embryo sacs ofNicotianatabacumL.[J].Planta,1997,202(1):93-105.
[19]姚志敏,刘艳华,戴培刚,等.野生烟草花粉活力与柱头可授性及繁育特性研究[J].西北植物学报,2015,35(3):614-621.
YAO Z M,LIU Y H,DAI P G,etal.Wild tobacco pollen viability,stigma receptivity and reproductive characteristics[J].ActaBot.Boreal.-Occident.Sin.,2015,35(3):614-621.
[20]葛丽丽.钙在烟草有性生殖过程中的细胞化学定位研究[D].厦门:厦门大学,2009.
[21]BUCHANAN-WOLLASTON V,EARL S,HARRISON E,etal.The molecular analysis of leaf senescence-a genomics approach[J].PlantBiotechnologyJournal,2003,1(1):3-22.
[22]胡适宜.被子植物生殖生物学[M].北京:高等教育出版社,2005:141-143.
[23]WANG H,WU H,CHEUNG A Y.Pollination induces mRNA poly (A) tail-shortening and cell deterioration in flower transmitting tissue[J].ThePlantJournal,1996,9(5):715-727.
[24]LENNON K A,ROY S,HEPLER P K,etal.The structure of the transmitting tissue ofArabidopsisthaliana(L.) and the path of pollen tube growth[J].SexualPlantReproduction,1998,11(1):49-59.
[25]STEFFENS B,KOVALEV A,GORB S N,etal.Emerging roots alter epidermal cell fate through mechanical and reactive oxygen species signaling[J].ThePlantCell,2012,24(8):3 296-3 306.
[26]GONZALEZ M V,COQUE M,HERRERO M.Pollen-pistil interaction in kiwifruit (Actinidiadeliciosa;Actinidiaceae)[J].AmericanJournalofBotany,1996:148-154.
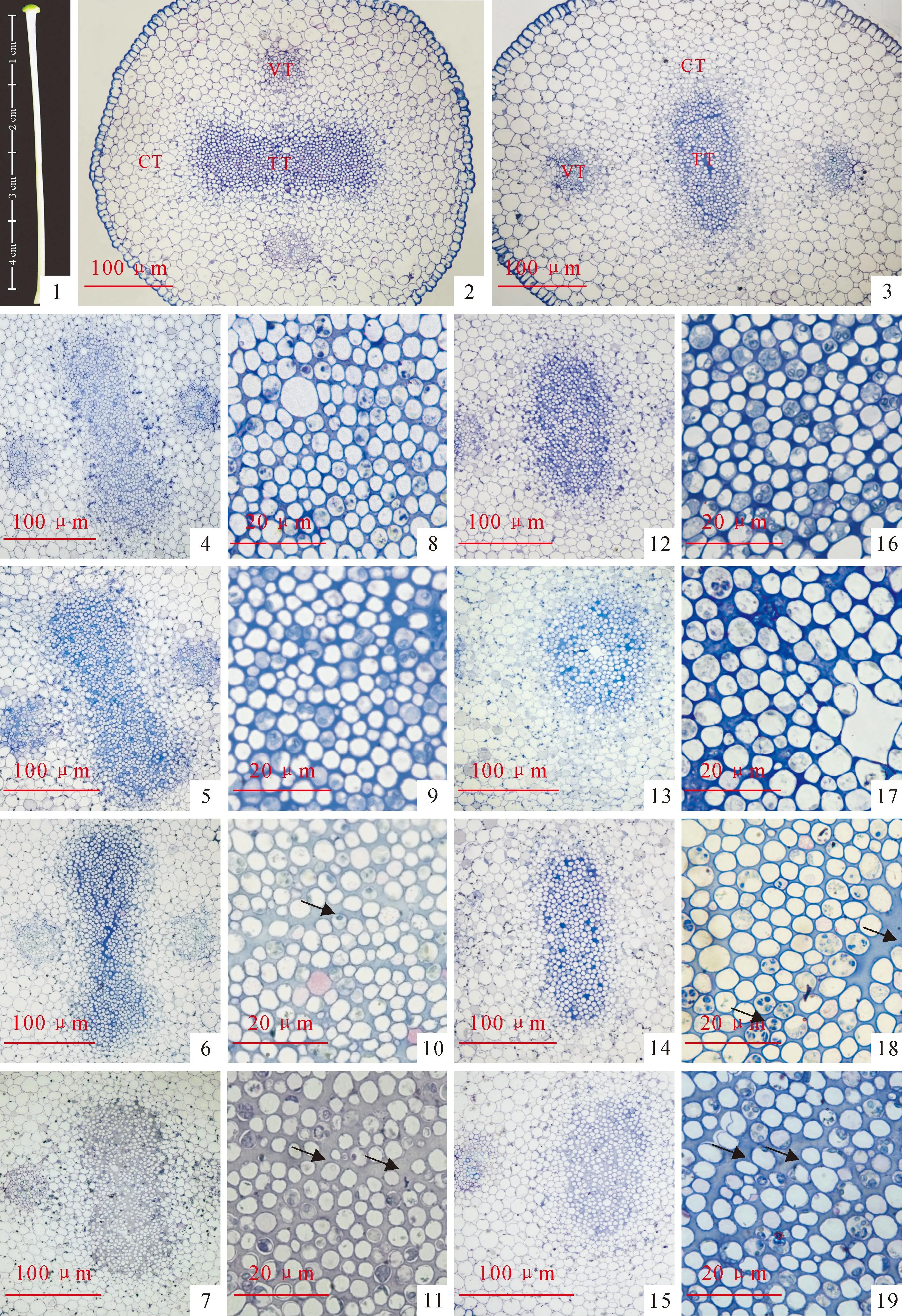
图版 Ⅰ烟草花柱及未授粉花柱的结构图(箭头为充满细胞外基质的细胞间隙)
TT.引导组织;CT.皮层;VT.维管组织
1.烟草花柱以及取样的位置;2.烟草上半部分(柱头下1 cm)的横切片;3.烟草花柱下半部分(子房上1 cm);4~11.上部分花柱的横切:4~7.未授粉1~4 d上部花柱的横切;8~11.1~4 d上部引导组织的变化过程;12~19.下部分花柱的横切:12~15.下部花柱1~4 d的横切;16~19.1~4 d下部引导组织的变化过程。
Plate ⅠThe structure of the tobacco style and non-pollinated style(Arrow is the intercellular spaces full of the extracellular matrix)
TT.Transmitting tissue;CT.Cortex tissue;VT.Vascular tissue
Fig.1.The style of tobacco and the position of sampling;Fig.2.Photograph of transverse sections from the upper part of style;Fig.3 Photograph of transverse sections from the lower part of style;Fig.4-11.The Photographs of transverse sections from the upper part of tobacco style:Fig.4-7.The images of transverse sections from the upper part of style which are 1-4 d;Fig.8-11.The changes of the upper part of transmitting tissue (1-4 d);Fig.12-19.The transverse sections from the lower part of the style:Fig.12-15.The transverse sections of lower part of style which are flowering 1-4 d;Fig.16-19.The changes of the lower part of transmitting tissue from 1 d to 4 d.

图版 Ⅱ烟草授粉后花柱的结构
★.空腔
1~8.授粉后1~4 d上部花柱的横切:1~4.授粉后上部花柱在1~4 d内的结构变化;5~8.上部引导组织细胞在授粉后1~4 d的变化;9~16为授粉后1~4 d内下部花柱的横切:9~12是授粉后下部花柱在1~4 d内的结构变化;13~16.下部引导组织细胞在授粉后1~4 d的变化。
Plate ⅡThe structure of the pollinated style
★.Cavity
Fig.1-8.The transverse sections from the upper part of style:Fig.1-4.The transverse sections from the upper part of style which are 1-4 d;Fig.5-8.The gradually changes of the upper part of transmitting tissue from 1 d to 4 d;Fig.9-16.The transverse sections from the lower part of style:Fig.9-12.The lower part of style which are flowering 1-4 d;Fig.13-16.The changes of the lower transmitting tissue from 1 d to 4 d.
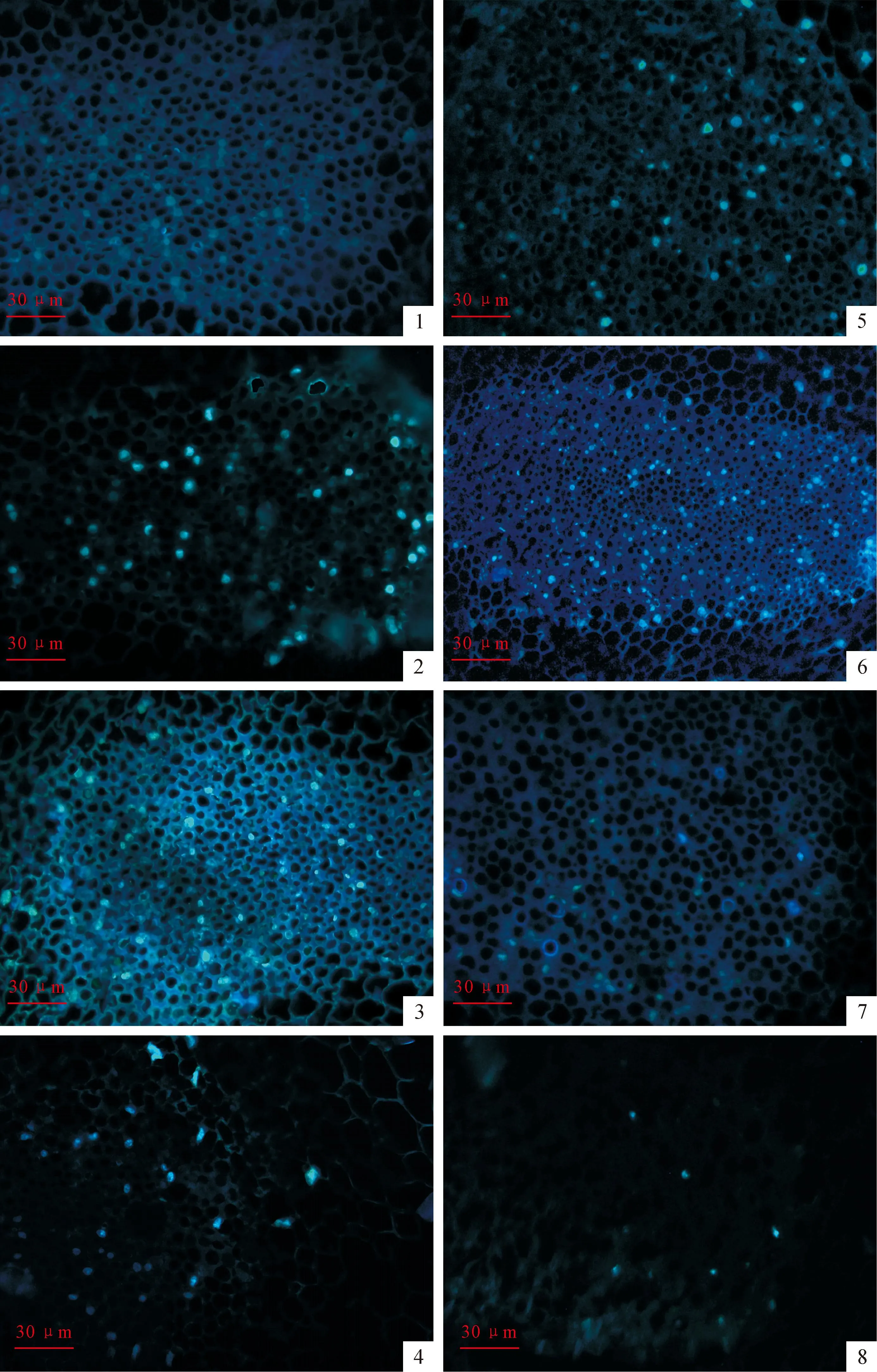
图版 Ⅲ上部引导组织细胞核动态变化
1~4.未授粉1~4 d引导组织细胞细胞核的动态变化;5~8.授粉后1~4 d引导组织细胞细胞核的动态。
Plate ⅢThe dynamic changes of nucleus of the upper part of transmitting tissue
Fig.1-4.The dynamic changes of the nucleus of transmitting tissue from non-pollinated flowers which are flowering 1-4 d;Fig.5-8.The dynamic changes of the nucleus of transmitting tissue from pollinated flowers which are flowering 1-4 d.
(编辑:潘新社)
Pollination Effects on the Structure of Tobacco’s (Nicotianatabacum) Transmitting Tissue
CHEN Yan1,WANG Lingli1,2,LIU Wenzhe1*
(1 College of Life Science,Northwest University,Xi’an 710069;2 Department of Life Science,Yuncheng University,Yuncheng,Shanxi 044000,China)
Abstract:The transmitting tissue of style is essential for the pollen tube growth.It involves pollen tube movement and has multiple roles in guidance,nutrition,adhesion.In order to study the pollination effect on the structure of style’s transmitting tissue,we observed the transmitting tissues which were pollinated or non-pollinated during the flowering of Nicotiana tabacum.The results showed that the cell death of transmitting tissue was similar to senescence in the non-pollinated style.However,the transmitting tissue had dramatic changes after pollination:the cells died rapidly.The dynamic changes of nucleus in the both pollination and non-pollination transmitting tissue were in accordance with the above.Overall,there are two different types of the death in transmitting tissue between pollination and non-pollination.
Key words:Nicotiana tabacum;pollination and non-pollination;transmitting tissue;structure;DAPI
中图分类号:Q944.5
文献标志码:A
作者简介:陈妍(1989-),女,硕士,主要从事结构植物学研究。E-mail:738273567@qq.com*通信作者:刘文哲,教授,博士生导师,主要从事结构植物学研究。E-mail:lwenzhe@nwu.edu.cn
基金项目:国家自然科学基金(31270428)
收稿日期:2015-11-25;修改稿收到日期:2016-01-26
文章编号:1000-4025(2016)03-0486-07
doi:10.7606/j.issn.1000-4025.2016.03.0486
