单核细胞CD36的荧光强度与类风湿关节炎患者颈部动脉斑块形成的关系
2016-05-04司志娟安恒庆
司志娟, 张 丽, 安恒庆
(新疆医科大学第一附属医院1医学检验中心, 2泌尿外科, 乌鲁木齐 830054)
单核细胞CD36的荧光强度与类风湿关节炎患者颈部动脉斑块形成的关系
司志娟1, 张丽1, 安恒庆2
(新疆医科大学第一附属医院1医学检验中心,2泌尿外科, 乌鲁木齐830054)
摘要:目的探讨单核细胞CD36的荧光强度与类风湿关节炎(rheumatoid arthritis,RA)颈部动脉斑块形成的关系。方法选取2014-2015年在新疆医科大学第一附属医院就诊的200例RA患者,根据颈动脉彩色超声检查结果将RA患者分为动脉硬化斑块组和无动脉硬化斑块组。采用ROC曲线评估单核细胞CD36的荧光强度对RA患者颈部动脉斑块形成的诊断价值。比较两组患者的单核细胞CD36的荧光强度,并对两组患者相关实验室指标进行Logistic回归分析。结果两组患者超敏C反应蛋白 (hypersensitive C-reactive protein,Hs-CRP)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)、甘油三酯(Triglyceride,TG)以及单核细胞CD36的荧光强度差异均有统计学意义(P<0.05)。Logistic回归分析结果显示Hs-CRP、LDL-C、TG及单核细胞CD36的荧光强度与RA患者颈部动脉斑块形成呈负相关(OR=1.921,P<0.01,95%CI:1.231~2.295)。单核细胞CD36的荧光强度每下降1个单位,RA患者颈部动脉斑块形成的风险增加1.9倍。ROC曲线下面积为0.906,敏感度为84.8%,特异度为81.5%,最佳诊断点的CD36荧光强度为0.61。结论单核细胞CD36荧光强度与RA患者颈部动脉斑块形成密切相关,单核细胞CD36荧光强度可提示RA患者颈动脉斑块形成的风险。
关键字: 单核细胞CD36; 类风湿关节炎; 颈动脉斑块; 超敏C反应蛋白
类风湿关节炎(rheumatoid arthritis,RA)是一种以侵犯关节滑膜为主并具有多种关节外表现的慢性自身免疫性疾病,也涉及到机体的炎症反应[1]。已有研究表明,RA存在较高的心血管疾病发生的风险[2]。动脉粥样硬化在心血管疾病的发生中扮演了重要的角色。单核细胞CD36作为一种清道夫受体,其参与包括动脉粥样硬化在内的众多疾病的生理和病理过程[3]。而颈部动脉斑块形成是心血管发生危险的重要标志[4]。本研究旨在探讨单核细胞CD36的表达及其荧光强度与颈动脉斑块形成的关系。
1对象与方法
1.1研究对象选取2014-2015年在新疆医科大学第一附属医院就诊的200例RA患者,其中男性43例,年龄(49.00±15.67)岁,女性157例,年龄(51.00±20.56)岁。所有RA患者的诊断符合1987ACR标准[5]。动脉斑块诊断标准 :内膜局限性突出管腔(回声可不均匀或伴声影),厚度>1.33 mm[6]。根据劲动脉彩色超声检查结果将RA患者分为动脉硬化斑块组和无动脉硬化斑块组。两组患者性别、年龄、药物使用年数及柳氮磺胺吡啶、氯喹、甲氨蝶呤、咪唑硫嘌呤、糖皮质激素服用情况差异均无统计学意义(表1)。排除标准:高血压、糖尿病、心肌病、肝功能损伤患者、患其他免疫性疾病以及恶性肿瘤患者,本研究经过本院伦理委员会同意。

表1 两组患者相关指标水平比较
1.2检测指标与方法
1.2.1生化指标和炎症因子的检测酶比色法检测高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)。GPO-PAP法检测甘油三酯(triglyceride,TG)。氧化酶法检测总胆固醇(total cholesterol,TC)。速率法检测肌酐(creatinine,Cr)。魏氏自然沉降法测定血沉(erythrocyte sedimentation rate,ESR )。免疫比浊法检测超敏C反应蛋白 (hypersensitive C-reactive protein,Hs-CRP)。
1.2.2单核细胞CD36荧光强度的计算受检者晨起空腹排便后测量身高、体质量。计算体质指数(Body mass index,BMI):MBI=体质量(kg)/身高2(m2)。因每位测试者单位毫升单核细胞计数和BMI均存在一定的差异,故计算每位患者的单位毫升外周血、单位BMI的CD36表达水平的平均荧光强度,计算公式如下:平均荧光强度= CD36相对荧光强度×外周血单核细胞计数(×109/L)/BMI。
1.2.3单核细胞CD36的检测单核细胞CD36抗体标记操作步骤严格按照说明书进行,取患者新鲜血液于乙二胺四乙酸二钠(EDTA-2Na)抗凝管,抗体标记白细胞,黑暗放置30 min,在红细胞裂解后,于流式细胞仪计数104个细胞数。在以侧向散射光为纵坐标、以CD14藻红蛋白(CD14-PE)为横坐标的散点图上圈定单核细胞群并设门,然后分析异硫氰酸荧光素(FITC)和藻红蛋白(PE)双阳性细胞单核细胞CD36表达的相对荧光强度。
1.3统计学处理采用SPSS16.0统计软件对实验数据进行统计学分析。计量数据的正态性采用K-S检验,符合正态分布的计量资料组间比较采用两独立样本t检验,非正态分布计量资料组间比较采用mann-whitney U检验,计数资料的组间比较采用χ2检验。采用Logistic 回归分析分析与类风湿关节炎患者颈部动脉斑块形成的相关因素。采用ROC曲线评价相关指标对于RA患者颈部动脉斑块形成的诊断价值。P<0.05表示差异有统计学意义。
2结果
2.1两组患者相关指标的比较两组患者Hs-CRP、LDL-C、TG及单核细胞CD36的荧光强度差异有统计学意义(P<0.05),见图1。两组患者HDL-C以及TC差异无统计学意义(P>0.05)(表2)。

表2 两组患者相关指标水平比较
2.2相关实验室指标的Logistic回归分析结果Hs-CRP、LDL-C、TG及单核细胞CD36的荧光强度与RA患者颈部动脉斑块形成呈负相关(表3)。单核细胞CD36的荧光强度每下降1个单位,RA患者颈部动脉斑块形成的风险增加1.9倍(图1)。
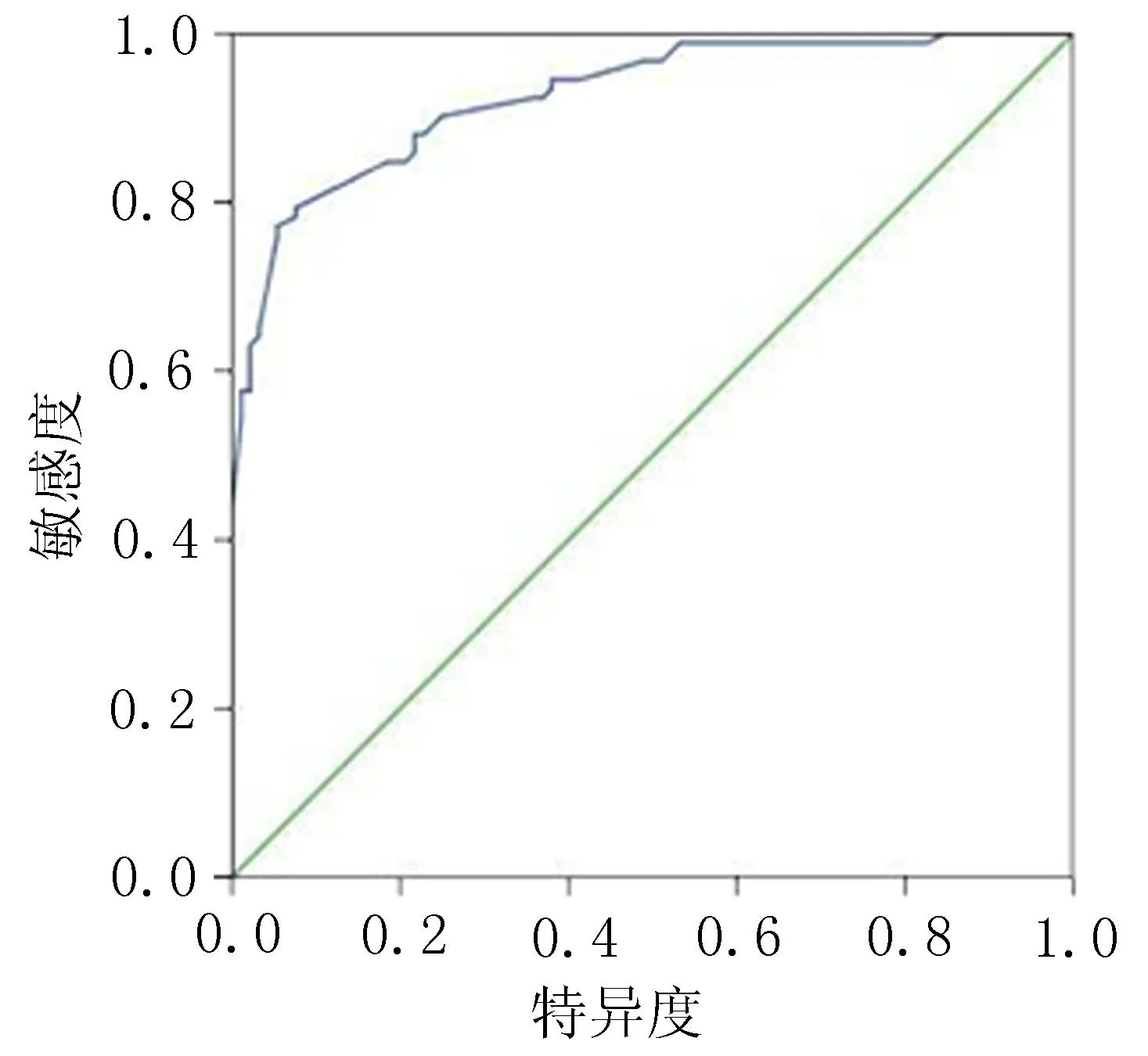
2.3单核细胞CD36的荧光强度对RA患者cIMT的ROC曲线分析结果ROC曲线下面积为0.906,敏感度为84.8%,特异度为81.5%,最佳诊断点的CD36荧光强度为0.61,见图2。
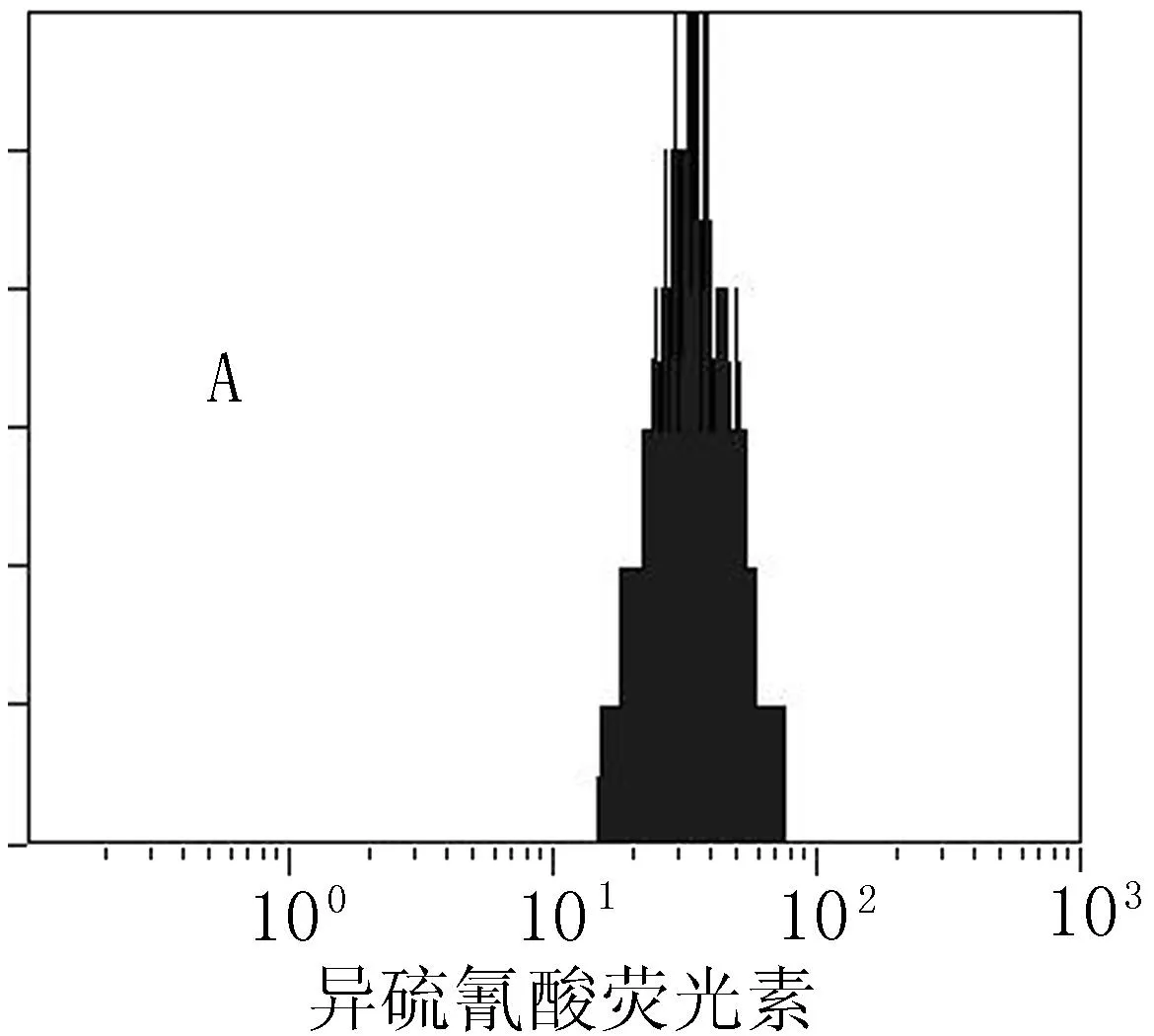
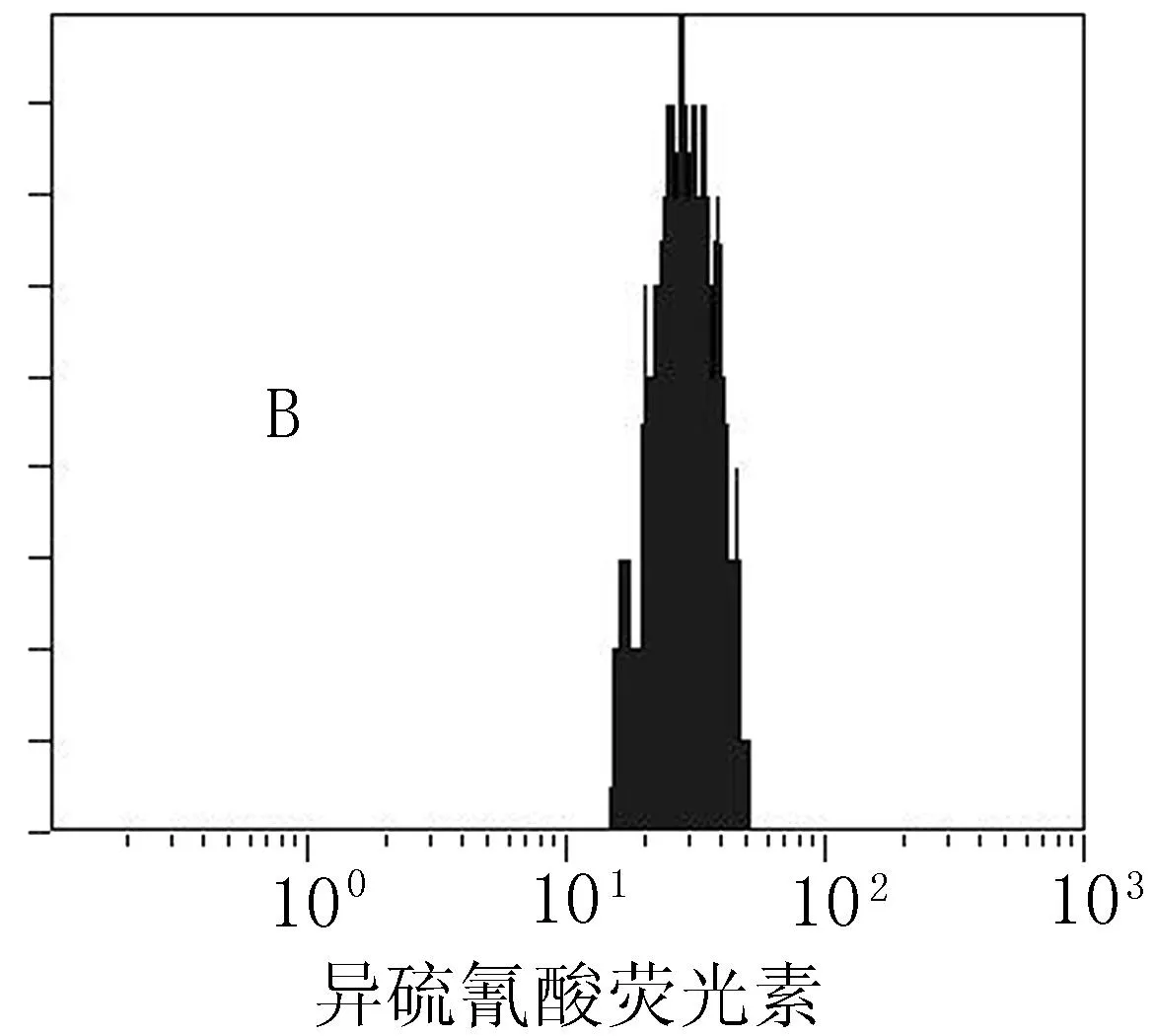
A:单核细胞CD36在RA无颈部动脉斑块患者中的平均荧光强度(MFI=36.8); B:单核细胞CD36在RA颈部动脉斑块患者中的平均荧光强度(MFI=20.5)
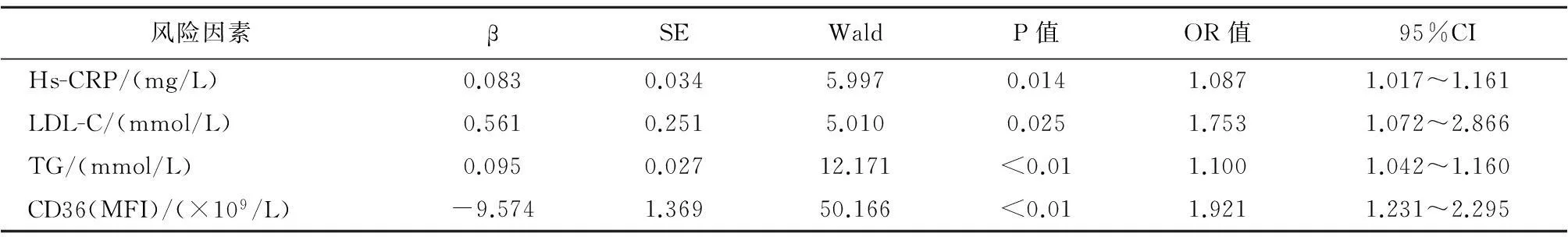
图1 单核细胞CD36在RA患者中的平均荧光强度
3讨论
CD36是一种跨膜糖蛋白,属于B族清道夫受体,广泛分布于多种细胞表面,如单核/巨噬细胞、血小板内皮细胞以及平滑肌细胞等[7]。CD36的表达在动脉硬化、高血压、糖尿病等疾病的发病过程中起着极为重要的作用[8-9]。雷娟等[10]研究表明,外周血单核细胞CD36在冠心病患者表达水平升高,CD36水平能够在一定程度上反映动脉粥样硬化所致的冠状动脉病变。以往的研究也证实了CD36和动脉粥样硬化的关系[11]。血清可溶性CD36水平在2型糖尿病患者与动脉粥样硬化风险正相关[12]。陈欣等[13]研究表明, CD36通过参与脂类代谢,而与动脉粥样硬化风险密切相关。本研究发现,单核细胞CD36与RA患者颈部动脉斑块密切相关,低表达的单核细胞CD36水平可能可以作为RA患者颈部动脉斑块形成的风险因素。
早期研究证实,RA患者动脉粥样硬化的形成与全身性炎症反应、免疫反应以及易感基因密切相关,炎症介质通过改变LDL-C的结构,诱导脂质异常,从而增强其致粥样硬化作用[14]。实际上,脂代谢异常或紊乱在早期RA疾病进展中被证实,脂质代谢异常或紊乱一直是动脉粥样硬化形成的风险因素,比如血清TG、LDL-C以及载脂蛋白B(Apolipoprotcin B,Apo-B)升高,此种血脂异常更易发生动脉粥样硬化[15]。同时,亚临床炎症通过抑制环氧化酶活性致内皮功能障碍,促进动脉粥样硬化的形成[16]。有研究报道,血清HS-CRP升高可以作为老年高血压患者亚临床动脉粥样硬化的一个预警[17],血清中HS-CRP浓度的升高与颈动脉粥样硬化相关[18]。本研究证实了LDL-C、TG及HS-CRP与 RA患者颈部动脉粥样硬化的关系,与上述研究相符。重要的是,本研究发现单核细胞CD36的低表达与RA患者颈部动脉斑块形成密切相关。Park[19]的研究表明,单核巨噬细胞上的CD36可以介导泡沫细胞形成,促进炎症反应和氧化、凋亡,是巨噬细胞泡沫化和动脉粥样硬化发生、发展的重要因素。单核细胞能与内皮细胞相互作用,通过上调单核细胞CD36的表达参与动脉粥样硬化的发展[20]。在这个过程中,炎症是介导单核细胞CD36与动脉粥样硬化关系的关键角色,众多炎症因子参与动脉粥样硬化的的形成和发展[21]。Driscoll等[22]研究表明,动物模型中,抗炎制剂的使用通过抑制机体的炎症应答而上调CD36在单核细胞的表达。Park[19]研究证实,单核细胞CD36可以通过调节凋亡细胞的吸收而具有抗炎功能,TNF可以通过低密度脂蛋白信号旁路下调单核细胞CD36的表达。另一方面,白介素-6、白介素-10及TNF可以通过减少过氧化物酶体增殖物激活受体配体化合物而抑制CD36在巨噬细胞的表达[23]。众所周知,TNF、IL-6及IL-10等炎症因子在RA的发病机制中扮演重要的角色[24],这些炎症因子释放入血液循环中作用于血管内壁,导致一系列促进动脉粥样硬化的代谢和功能改变,同时也是下调RA患者单核细胞CD36表达的关键因素。
综上所述,Hs-CRP、LDL-C、TG和单核细胞CD36荧光强度与RA患者颈部动脉斑块存在密切关系,单核细胞CD36荧光强度的检测可能有利于提示RA患者颈部动脉斑块形成的风险,需今后进行进一步的研究证实。
参考文献:
[1]Carlos GJ, Javier L, González-Gay MA. Correlation between endothelial function and carotid atherosclerosis in rheumatoid arthritis patients with long-standing disease [J]. Arthritis Res Ther, 2011,13(3):173-174.
[2]Christophe M, Emmanuel T, Ludovic T, et al.Trends in cardiovascular mortality in patients with rheumatoid arthritis over 50 years: a systematic review and meta-analysis of cohort studies [J]. Rheumatology (Oxford), 2009, 48(10):1309-1313.
[3]Elghetany MT. CD36: a multiligand molecule [J]. Lab Hematol,2005,11(1):31-37.
[4]陈德行, 李建中. 老年人颈动脉斑块的相关危险因素分析[J]. 浙江临床医学, 2015, 37(2):199-200.
[5]Arnett FC, Edworthy SM, Bloch DA, et al. The american rheumatism association 1987 revised criteria for the classification of rheumatoid arthritis[J]. Arthritis Rheum, 1988,31(3):315-324.
[6]许竹梅,赵水平,范平. 超声测量颈动脉内膜中层厚度与颈动脉斑块的关系[J].中国动脉硬化杂志, 2000,8(2): 165-168.
[7]Matsonloto K, Hirano K, Nozaki S, et a1. Expression of macrophage (Mphi) scavenger receptor, CD36, in cultured human aortic smooth muscle cells in association with expression of peroxisome proliferator activated receptor-gamma,which regulates gain of Mphi-like phenotype in vitro, and its implication in atherogenesis[J]. Arterioscler Thromb Vasc Biol, 2000, 20(4):1027-1032.
[8]Handberg A, Norberg M, Stenlund H, et al. Soluble CD36 (sCD36) clusters with markers of insulin resistance, and high sCD36 is associated with increased type 2 diabetes risk[J]. J Clin Endocrinol Metah, 2010, 95(4):1939-1946.
[9]Iwao Y, Nakajou K, Nagai R, et al. CD36 is one of important receptors promoting renal tubular injury by advanced oxidation protein products[J].Am J Physiol Renal Physiol, 2008, 295(6):1871-1880.
[10]雷娟, 罗招凡, 魏菁,等. 冠心病患者单核细胞CD36表达水平与冠状动脉病变程度的关系[J]. 中华临床医师杂志:电子版, 2009,13(8):36-39.
[11]靳文英, 陈红. CD36与动脉粥样硬化[J]. 中国动脉硬化杂志, 2010, 18(7):582-585.
[12]陈蕊华, 蒋晓真, 江泉,等. 2型糖尿病患者血浆可溶性CD36与动脉粥样硬化的关系[J]. 中国糖尿病杂志, 2013, 21(11):341-345.
[13]陈欣, 薛金红, 张淑翼, 等. 肝移植术后血清道夫受体-B I和CD36表达变化与动脉粥样硬化[J]. 中华心血管病杂志, 2014, 42(2):136-139.
[14]薛超, 胡大一. 类风湿关节炎与动脉粥样硬化的关系[J]. 国际心血管病杂志, 2011, 38(2):82-85.
[15]陈楠, 马丽, 吕书勤,等. 老年2型糖尿病合并颈动脉粥样硬化斑块中医证型分布特点临床研究[J]. 新疆医科大学学报, 2014,37(2):168-171.
[16]Ong KL, Ding J, Mcclelland RL, et al. Relationship of pericardial fat with biomarkers of inflammation and hemostasis, and cardiovascular disease: The Multi-Ethnic Study of Atherosclerosis[J]. Atherosclerosis, 2015, 239(2):386-392.
[17]艾山江·吾马尔, 买买提·阿布都热依木. 老年高血压患者微量白蛋白尿与高敏C-反应蛋白及下肢动脉粥样硬化的关系[J]. 中国老年学杂志, 2015,12(3):134-138.
[18]臧永发, 冯艳, 吴立梅,等. 脑卒中患者血浆高敏CRP变化与颈动脉粥样硬化斑块的关系[J]. 山东医药, 2008, 48(7):80-81.
[19]Park YM. CD36, a scavenger receptor implicated in atherosclerosis[J]. Exp Mol Med, 2014, 46(6):99.
[20]罗俊一, 马依彤, 谢翔, 等. CD36基因多态性与急性冠脉综合征关联性的研究[J]. 中华流行病学杂志, 2014, 35(2):200-204.
[21]徐也鲁. 动脉粥样硬化:一种慢性炎症过程[J]. 中国动脉硬化杂志, 2001, 9(2): 93-95.
[22]Driscoll WS,Tomas V,Jingjing T, et al. Macrophage ADAM17 deficiency augments CD36-dependent apoptotic cell uptake and the linked anti-inflammatory phenotype[J]. Circ Res, 2013,113(1):52-61.
[23]Hashizume M, Mihara M. Blockade of IL-6 and TNF-α inhibited oxLDL-induced production of MCP-1 via scavenger receptor induction[J]. Eur J Pharmacol, 2012,689(3):249-254.
[24]Peng YF, Cao L, Zeng YH, et al. Platelet to lymphocyte ratio and neutrophil to lymphocyte ratio in patients with rheumatoid arthritis[J]. Open Med, 2015, 10(1):249-253.
(本文编辑周芳)
Monocyte CD36 fluorescence intensity as a risk factor of carotid artery plaque in patients rheumatoid arthritis
SI Zhijuan1, ZHANG Li1, AN Hengqing2
(1DepartmentofLaboratoryMedicine,2DepartmentofUrologicSurgery,TheFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China)
Abstract:ObjectiveOur study is to investigate risk factors associated carotid artery plaque in patients with rheumatoid arthritis (RA) by detecting monocyte CD36 fluorescence intensity. MethodsA total of 200 RA patients were divided into atherosclerotic plaques groups and non-atherosclerosis plaque groups according to the result of color ultrasound. ROC curve was used to analyze performance of monocyte CD36 fluorescence intensity in RA patients with cervical artery plaque. ResultsHypersensitive C-reactive protein (Hs-CRP), low density lipoprotein-cholesterol (LDL-C), triglyceride (TG) and monocyte CD36 fluorescence intensity had statistical differences between the two groups (P<0.05), and fluorescence intensity of monocyte CD36 was lower in RA patients with carotid artery plaque compared to RA patients without carotid artery plaque (P<0.01). In logistic regression analyzes, Hs-CRP TG, LDL-C and fluorescence intensity of monocyte CD36 were associated with cervical artery plaque in RA patients (OR=1.921, P<0.01, CI95%:1.231-2.295). With the fluorescence intensity of monocyte CD36 decreased one unit, the risk of the formation of carotid plaque in patients with RA increased 1.9 times The area under curve of ROC was 0.906 with a sensitivity of 84.8% and specificity of 81.5%, and the best diagnostic points of CD36 fluorescence intensity was 0.61. ConclusionMonocyte CD36 fluorescence intensity is associated with carotid artery plaque in patients with RA. The monocyte CD36 fluorescence intensity can predict the risk of the formation of carotid plaque in patients with RA.
Keywords:Monocyte CD36 fluorescence intensity; rheumatoid arthritis; carotid artery plaque; Hypersensitive C-reactive protein
[收稿日期:2015-11-08]
doi:10.3969/j.issn.1009-5551.2016.04.013
中图分类号:R446
文献标识码:A
文章编号:1009-5551(2016)04-0437-04
作者简介:司志娟(1977-),女,大专,检验技师,研究方向:临床生物化学。通信作者:安恒庆,男,博士,副主任医师,研究方向:泌尿外科,E-mail:9269735@qq.com。
基金项目:新疆医科大学人文社会科学改革与发展专项(2105XYFG15)
