Nrf2蛋白在维吾尔族妇女宫颈鳞癌中的表达及意义
2016-05-04焦淑娟郑士奇王世雯阿仙姑哈斯木尼加提热合木
焦淑娟, 郑士奇, 王世雯, 阿仙姑·哈斯木, 尼加提·热合木
(新疆医科大学基础医学院1病理解剖学教研室, 2法医学2012-2班, 乌鲁木齐 830011)
·民族肿瘤学·
Nrf2蛋白在维吾尔族妇女宫颈鳞癌中的表达及意义
焦淑娟1, 郑士奇2, 王世雯2, 阿仙姑·哈斯木1, 尼加提·热合木1
(新疆医科大学基础医学院1病理解剖学教研室,2法医学2012-2班, 乌鲁木齐830011)
摘要:目的探究Nrf2蛋白在维吾尔族宫颈鳞癌组织中的表达以及对宫颈癌细胞增殖、迁移、侵袭和凋亡等生物学行为的影响。方法运用免疫组织化学方法检测宫颈鳞癌组织、宫颈上皮内瘤变(CIN)和正常宫颈组织中Nrf2与Keap1蛋白的表达。在细胞水平,运用基因沉默技术下调SiHa细胞中NFE2L2基因的表达,并通过qRT-PCR和蛋白印迹法检测NFE2L2 mRNA和蛋白水平相应变化;Transwell小室实验及流式细胞术等技术检测转染NFE2L2-siRNA后SiHa细胞迁移、侵袭、凋亡及细胞周期的改变。结果免疫组化结果显示维吾尔族宫颈鳞癌组织中Nrf2蛋白的阳性表达率(66.3%)明显高于CIN组织(56.5%)和正常宫颈组织(27.3%)(P<0.001);转染NFE2L2-siRNA下调宫颈癌SiHa细胞中NFE2L2基因的表达后,NFE2L2 mRNA水平和蛋白水平表达下降,同时SiHa细胞的迁移的细胞数目(103.00±37.58/125.33±34.67)和侵袭数目(82.25±23.56/54.75±9.07)较空白对照组和阴性对照组明显减少(P<0.01),细胞周期阻滞在G0/G1期,SiHa细胞凋亡率显著增加(P<0.01)。结论维吾尔族宫颈鳞癌组织中存在Keap1-Nrf2通路的激活,NFE2L2基因沉默可明显抑制宫颈癌SiHa细胞的增殖、迁移及侵袭能力,并促进细胞凋亡。
关键词:宫颈鳞癌; Nrf2; RNA干扰
宫颈癌(cervical cancer,CC)是女性最常见的恶性肿瘤之一,具有恶性程度高、病死率高的特点。尤其在新疆南疆地区,维吾尔族妇女宫颈癌发病率明显高于同地区的其他民族,是当地汉族人群的3~4倍,患病率约527/10万,病死率居全国少数民族之首,约15.78/10万[1-3],而且发病趋势更加年轻化[4]。目前复发和转移仍是宫颈癌治疗失败和死亡的主要原因,且大多数患者对化疗药物抵抗,对初始的化疗通常没有反应[5]。因此,寻找宫颈癌早期诊断敏感可靠的分子标志物并降低化疗药物的耐药性临床意义重大。
核因子E2相关因子2(nuclear factor erythroid 2-related factor,NFE2L2)是一个重要的保护性转录因子,其编码的蛋白为Nrf2,在氧化应激应答中起核心调控作用。Nrf2蛋白通过与胞浆蛋白Kelch样环氧氮丙烷相关蛋白1(kelch-like ECH2 associated protein 1,Keap1)以及抗氧化反应原件(antioxidant response elements,ARE)相互作用,启动下游编码抗氧化蛋白和二相解毒酶的基因表达,发挥细胞保护作用。由于Nrf2-ARE信号通路在抗肿瘤、抗炎、抗凋亡等方面可发挥重要的细胞保护作用,并与抗肿瘤药物的耐药性有关,逐渐引起人们的重视[6]。Nrf2蛋白在人类肺癌、食管癌、卵巢癌等肿瘤中过表达,被认为肿瘤发生发展的“催化分子”[7-11]。但目前对于Nrf2蛋白在宫颈癌中是否存在表达异常,也可作为一个催化分子触发和加强HPV的致癌性的报道较少。因此,本研究旨在探讨Nrf2蛋白在维吾尔族宫颈癌组织中的表达及在宫颈癌发生与发展过程中的作用,进一步揭示宫颈癌浸润、转移的分子调控机制,为宫颈癌生物学治疗提供理论依据。
1材料与方法
1.1材料
1.1.1细胞系人子宫颈癌SiHa细胞株购自Procell公司,人子宫颈癌Hela和C33a细胞株由新疆医科大学第一附属医院临床医学研究中心提供。
1.1.2组织标本收集新疆医科大学第一附属医院妇科2013年1月—2015年6月门诊及住院手术患者的石蜡包埋组织标本,所有标本入组前均由病理科确诊。宫颈鳞状细胞癌石蜡包埋组织89例,术前未接受放化疗或其他特殊处理。其中高分化38例,中分化23例,低分化28例;按照临床分期(FIGO,2009)分为:ⅠB期以下54例,ⅡB期以上35例;有淋巴结转移或远处转移58例,无淋巴结转移或远处转移31例。另选取宫颈上皮内瘤变(CIN)Ⅱ~Ⅲ组织46例,正常宫颈组织66例。所有患者的临床病理学资料收集前均征得患者本人及家属同意,并签署知情同意书。实验经新疆医科大学第一附属医院伦理委员会批准通过。
1.1.3主要仪器PCR 扩增仪(Thermo),酶标仪(Bio-Rad),蛋白转膜仪(Bio-Rad),Real Time PCR instrument(ABI),Transwell小室(Coming),化学发光成像仪(上海勤祥公司Chemiscope 3000),手动单道移液器(Eppendorf)。
1.1.4主要试剂DMEM(高糖)、0.25%胰酶、胎牛血清均购自Gibco,青霉素-链霉素双抗(美国Hyclone公司),Nrf2鼠抗人多克隆抗体、Keap1鼠抗人多克隆抗体均购自美国Abcam公司,β-actin(BOSTER),SYBR Select Master Mix(ABI),LipofectamineRNAiMAX试剂、Lipofectamine 3000转染试剂盒、Negative RNAi均购自美国Life technologies公司。
1.2方法
1.2.1免疫组织化学法用免疫组织化学检测宫颈鳞癌组织、CIN组织以及正常宫颈组织中Nrf2和Keap1蛋白的表达。按照免疫组织化学SP法进行染色,Nrf2和Keap1工作液浓度分别为1∶300和1∶5000。每张切片随机选取5个高倍视野,按阳性细胞数占同类细胞的百分比进行判断,阳性细胞数<10%定义为阴性,≥10%定义为阳性。
1.2.2NFE2L2 siRNA细胞转染SiHa细胞生长至贴壁80%~90%时准备转染,胰酶消化,接种于6孔培养板,孵育24 h。实验选取2条NFE2L2siRNA靶序列,分别命名为siRNA1和siRNA2,siRNA1的靶序列为5′-CAAACUGACAGAAGUUGACAAUUAU-3′,siRNA2的靶序列为5′-UGAAGCUCAACUUGCAUUAAUU-3′。以正常生长的SiHa细胞作为空白对照,阴性对照为转染随机序列。按照说明书制备siRNA/lipofectamin3000复合物后将其加到含有细胞和培养基的培养板的孔中,细胞在CO2培养箱中37℃温育48 h后,进行转染后的其他检测步骤。
1.2.3蛋白印记法检测取≥1×106的细胞,加入500 μL RIPA裂解液,充分混匀。冰上放置20 min,4℃,1 2000 r/min离心15 min,收集上清,BCA蛋白定量试剂盒测定蛋白浓度。蛋白经凝胶进行电泳分离后,稳压冰浴电转至PVDF膜上,5%脱脂牛奶封闭2 h,一抗孵育4℃过夜(Nrf2的抗体稀释比为1∶500,β-actin抗体稀释比为1∶500),二抗孵育后,AP法显色,化学发光仪检测、拍照,与β-actin比较,计算目的蛋白的表达丰度。
1.2.4RNA提取及qRT-PCR检测收集细胞,加入1 mLTrizol,室温静置15 min,加入200 μL氯仿,室温静置5 min离心15 min后取上清加入等体积异丙醇,颠倒混匀,-20℃静置30 min,离心15 min后弃上清,加入75%乙醇清洗RNA沉淀,离心弃上清保留沉淀,室温干燥2~3 min后用RNase-free H2O溶解RNA,检测RNA浓度和纯度。NFE2L2cDNA引物:正义链:5′-TCAGCGACGGAAAGAGTATGA -3′,反义链:5′-CCACTGGTTTCTGACTGGATGT-3′。β-actincDNA引物:正义链:5′-ATGATGATATCGCCGCGCTC -3′,反义链:5′-TCGATGGGGTACTTCAGGG -3′。利用SYBR Green染料检测目的基因的表达情况,并将β-actin作为内参照。总反应体积为20 μL,反应条件:50℃ 2 min ,95℃ 2 min预变性后,95℃变性15 s,60℃退火60 s,共进行 40个循环扩增。采用相对定量公式2-△△Ct计算目的基因的相对表达量。
1.2.5细胞凋亡实验取处于对数生长期SiHa细胞,消化、收集细胞,用4℃预冷的PBS洗细胞2次,以1 mL结合缓冲液重新悬浮细胞,使其浓度为1×106个/mL,将100 μL的细胞悬液加入5 mL流式管中,每管加入10 μL的碘化丙啶,避光均匀15 min后,流式细胞仪上机检测。
1.2.6Transwell小室体外迁移实验待测细胞培养至对数生长期,消化细胞,在下室加入600 μL含10%血清的培养基,上室加入100 μL细胞悬液,继续培养24 h后用镊子取出小室移到4%的甲醛室温固定10 min,后转入甲醇中,室温透化20 min Giemsa染液的孔中室温染色15~30 min,移至载玻片上,显微镜下取5个随机视野计数,统计结果。
1.2.7Transwell小室体外侵袭实验Matrigel在4℃过夜融化,用4℃无血清培养基稀释Matrigel至终浓度1 mg/mL,在小室的上室底部中央加入100 μL稀释后的Matrigel,37℃温育4~5 h使其干成胶状;后续步骤同迁移实验。
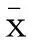
2结果
2.1免疫组织化学检测及临床病理学特征分析免疫组化结果显示:在宫颈正常组织中Nrf2阳性表达主要定位于细胞浆中(图1a),在CIN和宫颈癌组织中Nrf2阳性表达主要定位在细胞胞核(图1b、1c);在宫颈正常组织和CIN组织中Keap1阳性表达主要定位于细胞核中(图1d、1e),在癌组织中Keap1阳性表达主要定位在细胞胞浆(图1f)。在89例维吾尔族宫颈鳞状细胞癌组织中,Nrf2蛋白的阳性表达率为66.3%(59/89),显著高于CIN组织(56.5%)和正常宫颈组织(27.3%)中的表达,差异有统计学意义(P<0.001);Keap1蛋白的阳性表达率为22.5%(20/89),显著低于CIN组织(41.3%)和正常宫颈组织(57.6%)中的表达,差异有统计学意义(P<0.001)。在维吾尔族妇女宫颈鳞癌中Nrf2蛋白的表达与肿瘤的临床分期(P<0.001)、分化程度(P<0.05)和淋巴结转移(P<0.05)有关;在维吾尔族妇女宫颈鳞癌中Keap1的表达与肿瘤的临床分期(P<0.05)有关(表1)。

a: 正常宫颈组织 b: CIN组织 c:宫颈鳞癌组织

d: 正常宫颈组织 e: CIN组织 f:宫颈鳞癌组织

图1 免疫组化检测Nrf2、Keap1蛋白在维吾尔族宫颈病变组织中的表达(×200)
2.2Nrf2蛋白在宫颈癌细胞株SiHa、Hela、C33a中的表达qRT-PCR结果显示,SiHa、Hela及C33a细胞中NFE2L2 mRNA的相对表达量分别为(1.058±0.408)、(0.843±0.086)、(0.695±0.073)。SiHa细胞中NFE2L2 mRNA的表达量显著高于Hela和C33a细胞(P<0.05),故选用SiHa细胞作为后续的实验对象。
2.3Nrf2表达的鉴定蛋白印迹法结果显示,Nrf2蛋白条带在90 KDa处显色,内参β-actin蛋白条带在42 KDa处显色(图2a)。经软件分析各条带的灰度值,以β-actin蛋白为内参,对Nrf2蛋白的相对表达量进行统计学分析,在SiHa细胞中,siRNA1组中Nrf2蛋白的相对表达量为(0.417±0.068),siRNA2组中Nrf2蛋白的相对表达量为(0.350±0.046),均显著低于空白对照组(1.283±0.086)中Nrf2蛋白的相对表达量(图2b,P<0.001)。qRT-PCR结果显示,siRNA1组中NFE2L2 mRNA水平相对表达量为(0.263±0.090), siRNA2组中NFE2L2 mRNA水平相对表达量为(0.319±0.098),均显著低于空白对照组的(1.058±0.408)和阴性对照组的(0.965±0.223)表达(P<0.05)。

a: SiHa细胞中Nrf2及β-actin蛋白表达 b: 各组SiHa细胞中Nrf2蛋白相对表达量
注: 与正常对照组比较,*P<0.001。
图2蛋白印迹法检测SiHa细胞中各组Nrf2蛋白的表达
2.4下调Nrf2对SiHa细胞迁移和侵袭的影响Transwell迁移结果显示,siRNA1组中细胞迁移的数目为(103.00±37.58)个,siRNA2组中细胞迁移的数目为(125.33±34.67)个,明显少于空白对照组的(194.00±33.85)和阴性对照组的(216.75±12.28)(表2、图3),差异具有统计学意义(P<0.01)。Transwell侵袭结果显示,siRNA1中穿过小室基质胶的细胞数目为(82.25±23.56)个,siRNA2中穿过小室基质胶的细胞数目为(54.75±9.07)个,明显少于空白对照组的(159.00±7.55)和阴性对照组的(170.67±12.86)(表2、图4),差异具有统计学意义(P<0.01)。
表2NFE2L2siRNA转染SiHa细胞48h后各组细胞

组别SiHa细胞迁移数目/个SiHa细胞侵袭数目/个空白对照组194.00±33.85159.00±7.55阴性对照组216.75±12.28170.67±12.86siRNA1组103.00±37.58*#82.25±23.56*#siRNA2组125.33±34.67*#54.75±9.07*#
注: 与空白对照组比较,*P<0.01; 与阴性对照组比较,#P<0.01。
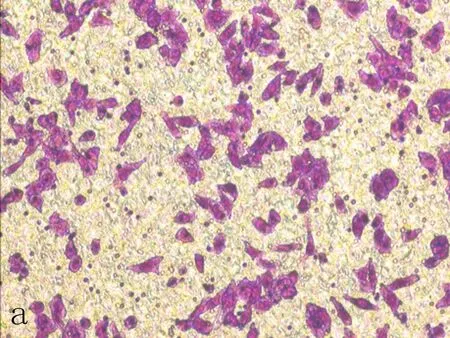
a: 空白对照组
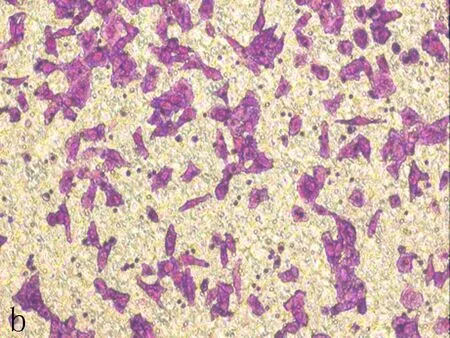
b: 阴性对照组

c: siRNA1组
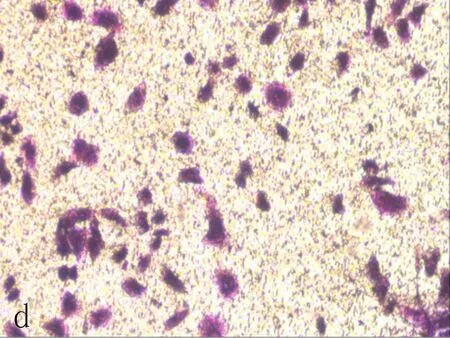
d:siRNA2组
图3Transwell迁移实验检测NFE2L2-siRNA转染SiHa后细胞迁移能力变化
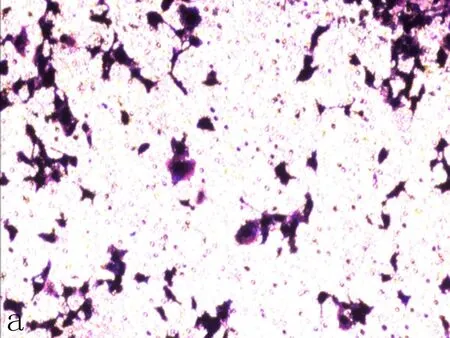
a: 空白对照组
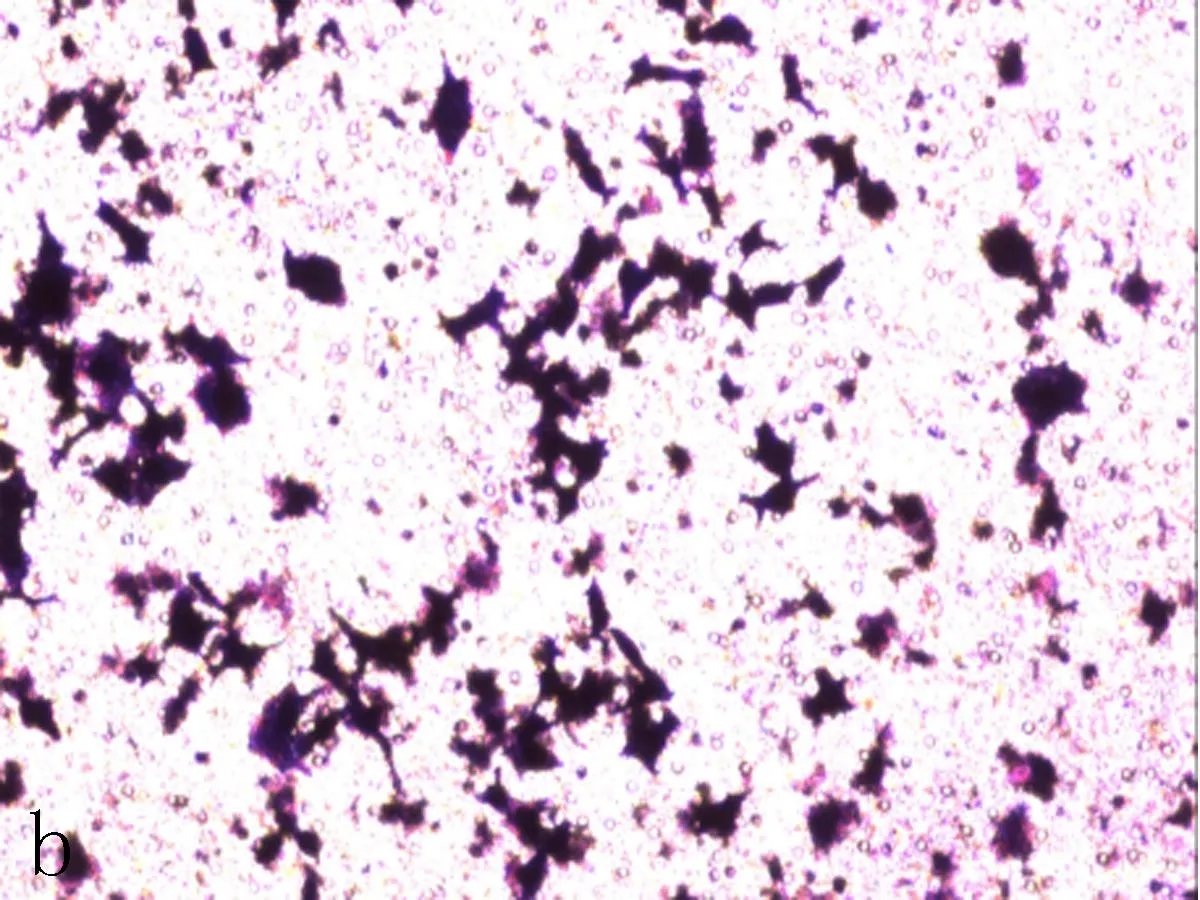
b: 阴性对照组
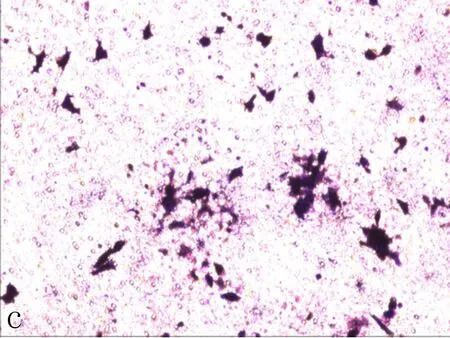
c: siRNA1组

d:siRNA2组
图4Transwell侵袭实验检测NFE2L2-siRNA转染SiHa后细胞侵袭能力变化
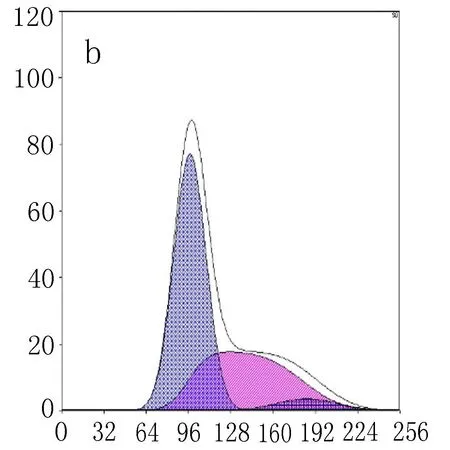
2.5下调NFE2L2表达对细胞周期的影响细胞周期结果显示, NFE2L2-siRNA转染SiHa细胞48 h后,siRNA1组中G0/G1期细胞数为(63.83±3.2)%,siRNA2组中细胞G0/G1期细胞数为(64.60±4.06)%,明显多于阴性对照组的(53.27±2.11)%和空白对照组的(54.47±3.01)%(表3、图5),差异有统计学意义(P<0.001)。siRNA1组中S期细胞数为(35.87±2.79)%,siRNA2组中细胞S期细胞数为(33.97±1.82)%,明显少于阴性对照组的(42.93±1.95)%和空白对照组的(41.60±1.56)%(表3、图5),差异有统计学意义(P<0.001)。
表3NFE2L2siRNA转染SiHa细胞48 h后细胞周期时
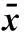

组别G0/G1SG2/MSiHa细胞凋亡率空白对照组54.47±3.0141.60±1.563.93±3.192.93±0.67阴性对照组53.27±2.1142.93±1.953.73±3.612.678±0.38siRNA1组63.83±3.29*35.87±2.79*0.27±0.4613.73±0.50*#siRNA2组64.60±4.06*33.97±1.82*1.40±2.4214.13±0.51*#
注: 与空白对照组比较,*P<0.001; 与阴性对照组比较#P<0.001。

a: 空白对照组
b: 阴性对照组

c: siRNA1组

d:siRNA2组
图5流式细胞术检测NFE2L2-siRNA转染SiHa后细胞周期时相的改变
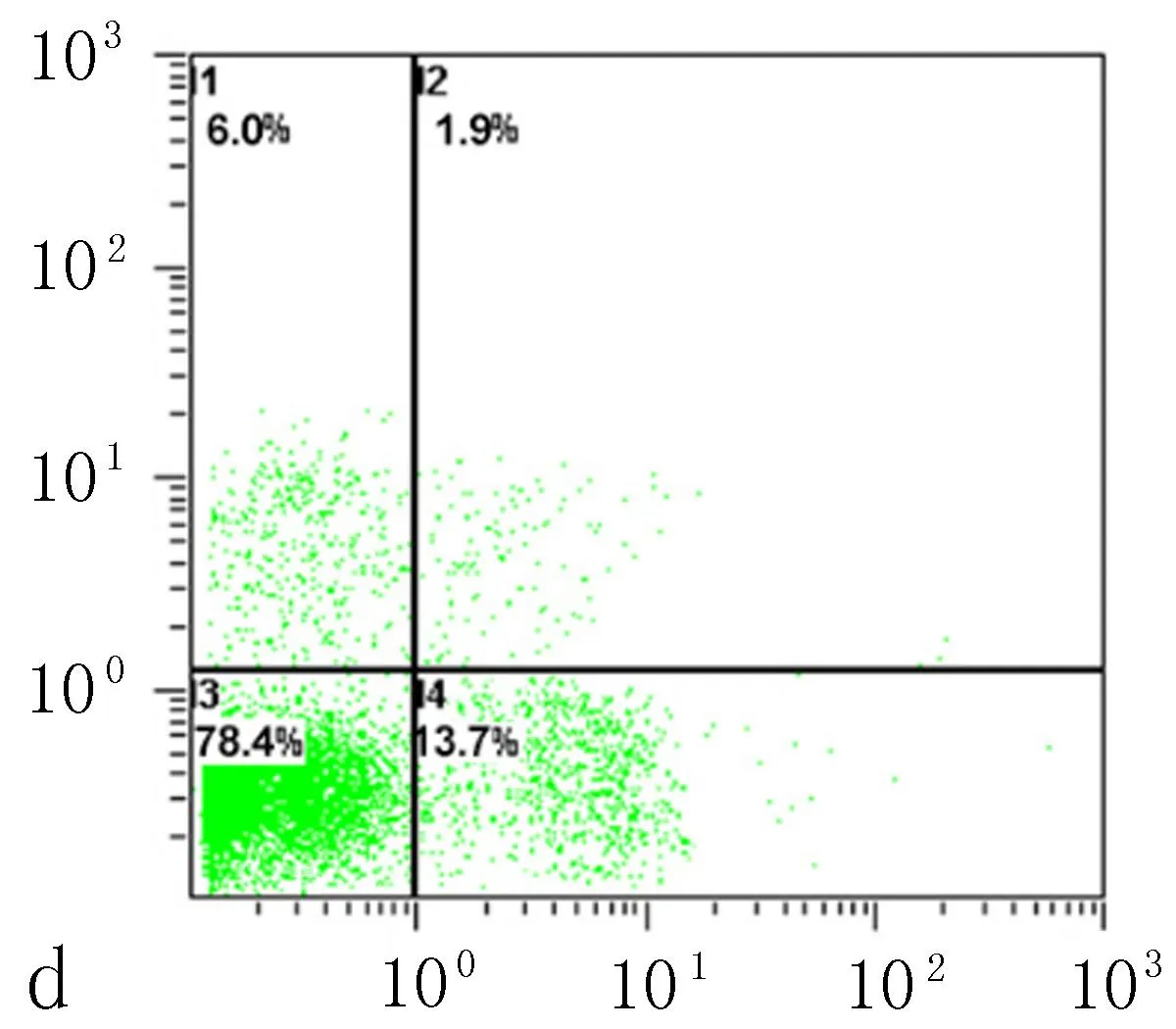
2.6下调NFE2L2表达对细胞凋亡的影响细胞凋亡结果显示,siRNA1组中细胞早期凋亡率为(13.73±0.50)%,siRNA2组中细胞早期凋亡率为(14.13±0.51)%,均显著高于空白对照组的(2.93±0.67)%和阴性对照组的(2.678±0.38)%(表3、图6),差异有统计学意义(P<0.001)。

a: 空白对照组

b: 阴性对照组

c: siRNA1组
d:siRNA2组
图6流式细胞术检测NFE2L2-siRNA转染SiHa后细胞凋亡率的改变
3讨论
Nrf2蛋白是Moi等[12]于1994年首次报道,属CNC(cap’N’collar)转录因子家族,是位于细胞质中的可溶性蛋白,碳端有一个亮氨酸拉链结构蛋白的DNA结合区。Nrf2蛋白是外源性有毒物质和氧化应激的感受器,在参与细胞抗氧化应激和外源性有毒物质诱导的主要防御机制中发挥重要的作用。近年来研究结果发现Keap1-Nrf2通路在氧化应激应答中起核心调控作用,其一方面保护正常细胞免受致癌作用发生恶性转化,另一方面又促进恶性转化细胞的生存。动物研究发现敲除NFE2L2基因的小鼠更易受到化学性致癌因子的影响[13-14]。静脉注射Lewis肺癌细胞系的小鼠敲除NFE2L2基因后肺癌转移的结节增加[15]。表明NFE2L2在防止原发性肿瘤的生长和抗肿瘤转移方面发挥着至关重要的作用。另一方面Nrf2蛋白与肺癌、食管癌、卵巢癌等肿瘤的研究都证实了增加Nrf2蛋白的活化与肿瘤的增殖和化疗药物的抵抗有关,这可能是通过诱导抗氧化基因实现的,病人的生存和多元统计分析也进一步证实在肿瘤患者中Nrf2蛋白是一个不良的预后因素[16-20],上述研究提示Nrf2蛋白在肿瘤中有双面性,有关Nrf2蛋白对宫颈癌细胞的增殖、浸润、转移和凋亡的影响,国内外尚无相关报道,其作用机制尚需进一步研究。
Ma等[21]报道在宫颈癌组织中Nrf2蛋白表达量显著增加,Ⅱ期和Ⅲ期宫颈鳞癌组织中Nrf2蛋白的表达量明显高于Ⅰ期,并与患者的生存期呈负相关,与宫颈癌的病理分级、临床分期和淋巴结转移无明显相关性。毛景涛等[22]报道Nrf2蛋白在食管癌中阳性率为78.13%,显著高于癌旁组织,并与淋巴结转移有关。Kawasaki等[16]研究也表明在胃癌中Nrf2蛋白高表达与肿瘤的大小、分化程度、病理分期和淋巴结转移密切相关,Nrf2蛋白阳性患者比阴性患者预后差。本研究的免疫组化结果显示,宫颈癌及CIN组织中Nrf2蛋白阳性表达主要定位于细胞核,而正常宫颈组织中Nrf2蛋白阳性表达主要定位于细胞浆,提示在宫颈癌中Nrf2被激活,入核发挥作用。Nrf2蛋白的表达与肿瘤分化程度、淋巴结转移以及病理分期相关(P<0.05)。这一结果与Ma等[21]的研究结果并不完全一致,尽管都是针对国内宫颈鳞癌人群的研究,可能是由民族差异导致的,后期需要进一步扩大样本量进行验证。基于在正常宫颈组织、CIN和宫颈癌中Nrf2蛋白的表达存在显著差异,且随着宫颈病变的进展Nrf2的表达量逐渐升高,因此检测Nrf2蛋白的表达可以作为宫颈癌的早期筛查的指标。
本研究选用SiHa、Hela、C33a 3株宫颈癌细胞株,运用qRT-PCR技术检测NFE2L2在宫颈癌不同细胞株的本底表达,结果显示NFE2L2在SiHa细胞中呈相对高表达,而在Hela和C33a细胞中表达量相对较低。提示在不同细胞类型的肿瘤中,NFE2L2可能通过不同的作用机制对细胞的生物学行为产生不同的影响。
多项研究表明Nrf2下游抗氧化基因血红素氧合酶1(hemeoxygenase-1,HO-1)与NAD(P)H苯醌氧化还原酶-1(NAD(P)H-quinoneoxidoreductase 1,NOQ1)通过调节细胞内谷胱甘肽(glutathione,GSH)水平协同性地促进肿瘤增殖,抑制肿瘤凋亡[23]。Singh等[24]的研究发现在非小细胞肺癌的模型中,通过siRNA抑制NFE2L2的表达并联合卡铂可以显著抑制肿瘤的生长。Ma等[21]研究结果显示,在宫颈癌Caski细胞中通过shRNA下调NFE2L2的表达后,显著抑制肿瘤细胞增殖,并增加对化疗药物的敏感性。张钧等[25]报道抑制食管癌细胞中NFE2L2的表达后,细胞增殖能力明显减弱,细胞凋亡增加,抗凋亡蛋白Bcl-2和HO-1表达量明显下调。本研究结果也证实了沉默NFE2L2表达后促进细胞凋亡,SiHa细胞G0/G1细胞数显著增加,S期细胞数显著减少,细胞周期阻滞在G0/G1期,细胞增殖受阻。由于HO-1有促进细胞增殖和抗凋亡作用,推测Nrf2可能通过上调HO-1抑制细胞凋亡,具体机制有待进一步研究。
Shen等[9]的研究发现在缺氧微环境下,抑制食管癌中NFE2L2的表达后MMP2、HIF-1ɑ和HO-1的表达降低,而E-cadherin mRNA表达上调,细胞的迁移和侵袭能力受到明显抑制。本研究首次发现,抑制NFE2L2 表达后细胞的侵袭和迁移能力明显下降,这与Zhang等[26]在肝癌中的研究报道是一致的,表明NFE2L2可促进宫颈癌细胞的迁移和侵袭能力。NFE2L2促进肿瘤侵袭和迁移的机制目前尚不完全清楚,结合NFE2L2在不同肿瘤中的研究报道推测,NFE2L2可能通过上调MMPs的表达降解细胞外基质,促进肿瘤细胞进入血管,侵袭邻近正常组织或远处转移。
综上所述,维吾尔族宫颈鳞癌组织中存在Keap1-Nrf2通路激活,下调宫颈癌SiHa细胞中NFE2L2的表达可以抑制细胞增殖、侵袭和迁移能力,并促进细胞凋亡。本课题组后期将对与细胞增殖、迁移、侵袭及细胞周期、凋亡等相关的信号转导通路及分子机制进行深入研究,力求为宫颈癌的靶向治疗提供新的理论依据。
参考文献:
[1]拉莱·苏祖克,彭玉华,周康,等. 新疆不同民族宫颈癌发病趋势分析[J].新疆医科大学学报,2006,29(7):569-571.
[2]张国庆,刘开江,赖小军,等.新医大附属肿瘤医院1989~2002年住院病人恶性肿瘤分布[J]. 新疆医科大学学报,2003,26(4):393-395.
[3]古扎丽努尔·阿不力孜,彭芝兰.HPV及其亚型在四川西北地区汉族及新疆南部地区维吾尔族妇女宫颈癌组织中的差异表达[J].中华微生物学和免疫学杂志,2004,24(5):408-408.
[4]彭玉华,拉莱·苏祖克,周康,等.子宫颈癌4505例临床分析[J].中华妇产科杂志,2003,38(12):764-765.
[5]Pectasides D, Kamposioras K, Papaxoinis G, et al. Chemotherapy for recurrent cervical cancer[J].Cancer Treat Rev,2008,34(7):603-613.
[6]Kim SK,Yang JW,Kim MR,et al.Increased expression of Nrf2/ARE dependent anti-oxidant proteins in tamoxifen-resistant breast cancer cells[J]. Free Radic Biol Med,2008,45(4):537-546.
[7]Anju S,Vikas M, Thimmulappa RK, et al. Dysfunctional KEAP1-NRF2 Interaction in Non-Small-Cell Lung Cancer[J].PLoS Med,2006,3(10):e420.
[8]Kawasaki Y,Okumura H,Uchikado Y,et al.Nrf2 is useful for predicting the effect of chemoradiation therapy on esophageal squamous cell carcinoma[J].Ann Surg Oncol,2014,21(7):2347-2352.
[9]Shen H,Yang Y,Xia S,et al.Blockage of Nrf2 suppresses the migration and invasion of esophageal squamous cell carcinoma cells in hypoxic microenvironment[J].Dis Esophagus,2014,27(7):685-692.
[10]Bao LJ,Jaramillo MC,Zhang ZB,et al.Nrf2 induces cisplatin resistance through activation of autophagy inovariancarcinoma[J].Int J Clin Exp Pathol,2014,7(4):1502-1513.
[11]Konstantinopoulos PA,Spentzos D,Fountzilas E,et al. Keap1 mutations and Nrf2 pathway activation in epithelial?ovarian cancer[J]. Cancer Res,2011,71(15):5081-5089.
[12]Moi P, Chan K, AsunisI, et al. Isolation of NF-E2-related factor 2 (Nrf2), a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region[J].Proc Natl Acad Sci USA,1994,91(21):9926-9930.
[13]Ramos GM,Kwak MK,Dolan PM,et al. Sensitivity to carcinogenesis is increased and chemoprotective efficacy of enzyme inducers is lost in Nrf2 transcription factor-deficient mice[J].Proc Natl Acad,2001, 98 (6):3410-3415.
[14]Iida K,Itoh K,Kumagai Y,et al.Nrf2 is essential for thechemopreventive efficacy of oltipraz against urinary bladder carcinogenesis[J].Cancer Res,2004,64 (18):6424-6431.
[15]Satoh H, Moriguchi T, Taguchi K, et al. Nrf2-deficiency creates a responsive microenvironment for metastasis to the lung[J].Carcinogenesis,2010,31(10):1833-1843.
[16]Kawasaki Y,Okumura H,Uchikado Y ,et al.Nrf2 is useful for predicting the effect of chemoradiation therapy on esophageal squamous cell carcinoma[J].Ann Surg Oncol,2014,21(7):2347-2352.
[17]Yang H,Wang W,Zhang Y,et al.The role of NF-E2-related factor2 in predicting chemoresistance and prognosis in advanced non-small-cell lung cancer[J].Clin Lung Cancer,2011,12(3):166-171.
[18]Konstantinopoulos PA,Spentzos D,Fountzilas E,et al.Keap1 mutations and Nrf2 pathway activation in epithelial ovarian cancer[J]. Cancer Res, 2011,71(15):5081-5089.
[19]Hartikainen JM,Tengstrom M,Kosma VM,et al.Genetic polymorphisms and protein expression of NRF2 and sulfuredoxin predict survival outcomes in breast cancer[J]. Cancer Res,2012,72(21):5537-5546.
[20]Hu XF,Yao J,Gao SG,et al.Nrf2 overexpression predicts prognosis and 5-fu resistance in gastric cancer[J]. Asian Pac J Cancer Prev,2013,14(9):5231-5235.
[21]Ma XD,Zhang JF,Liu SJ ,et al.Nrf2 knockdown by shRNA inhibits tumor growth and increases efficacy of chemotherapy in cervical cancer[J].Cancer Chemother Pharmacol,2012,69(2):485-494.
[22]毛景涛,叶尔买克·唐沙哈尔,沈辉,等.Nrf2在食管鳞癌组织中的表达及意义[J].细胞与分子免疫学杂志,2011,27(11):1231-1233.
[23]Wagner M, Cadetg P, Ruf R, et al.Heme oxygenase-1 attenuates ischemia/reperfusion induced apoptosis and improves survival in rat renal allografts[J].Kidney Int,2003,63(4):1564-1573.
[24]Singh A,Boldin-Adamsky S,Thimmulappa RK,et al.RNAi-mediated silencing of nuclear factor erythroid-2-related factor 2 gene expression in non-small cell lung cancer inhibits tumor growth and increases efficacy of chemotherapy[J].Cancer Res,2008,68(19):7975-7984.
[25]张钧,孔德友,张舰,等.RNA干扰Nrf2表达对食管癌生物学行为的影响[J].临床肿瘤学杂,2014,19(12):1057-1061.
[26]Zhang MX,Zhang C,Zhang LM,et al.Nrf2 is a potential prognostic marker and promotes proliferation and invasion in human hepatocellular carcinoma[J].BMC Cancer,2015,15:531.
(本文编辑杨晨晨)
Expression and significance of Nrf2 protein in cervical squamous cell carcinoma of Uygur women
JIAO Shujuan1, ZHENG Shiqi2, WANG Shiwen2, Ayshamgul Hasimu1, Nijat Rehemu1
(1DepartmentofPathologyandPathophysiology,2Forensic2012-2Class,CollegeofPrellinialMedicine,XinjiangMedicalUniversity,Urumqi830000,China)
Abstract:ObjectiveTo explore the expression of Nrf2 protein in cervical squamous cell carcinoma and its affection on the invasion, migration, cell cycle and apoptosis of cervical cancer cells. MethodExpression of Nrf2 and Keap1 protein in carcinoma tissues and CIN and normal cervical tissues were detected by immunohistochemistry. The NFE2L2 gene was down-regulated by gene silencing technology in SiHa cell, and the mRNA and protein expression of NFE2L2 was detected by qRT-PCR and western blot respectively. The cell migration, invasion, apoptosis and cell cycle of SiHa cell which was transfected with NFE2L2-siRNA were analyzed by transwell and flow cytometry. ResultsIn Uighur patients, the results of immunohistochemistry showed that the positive rate of Nrf2 (66.3%) in cervical squamous carcinoma tissue was obviously higher than in CIN (56.5%) and normal cervical tissue (27.3%) (P<0.001) . When the expression of NFE2L2 was down-regulated in SiHa cell, the mRNA and protein expression of NFE2L2 were declined, and the migrated cells (103.00±37.58/125.33±34.67) and invasion cells (82.25±23.56/54.75±9.07) were reduced compared to the blank control and negative control. The cell cycle of SiHa were arrested at G0/G1 phase, and the apoptosis rate of SiHa cell was increased significantly (P<0.01). ConclusionKeap1-Nrf2 pathway was activated in cervical squamous cell carcinoma of Uighur patient. The gene silence of NFE2L2 could obviously inhibit the cell proliferation, migration and invasion ability, and promote cell apoptosis of cervical cancer cell SiHa.
Keywords:Cervical cancer; Nrf2; siRNA
[收稿日期:2016-03-15]
doi:10.3969/j.issn.1009-5551.2016.04.007
中图分类号:R737.33
文献标识码:A
文章编号:1009-5551(2016)04-0411-07
作者简介:焦淑娟(1991-),女,在读硕士,研究方向:肿瘤分子病理。通信作者:尼加提·热合木,男,维吾尔族,教授,硕士生导师,研究方向:肿瘤病理基础研究, E-mail: njt60@sina.com。
基金项目:国家自然科学基金(81360332)
