微生物比浊法测定注射用替考拉宁的效价含量
2016-05-04张文杰沈阳医学院附属第二医院药剂科辽宁沈阳110002
张文杰(沈阳医学院附属第二医院药剂科,辽宁 沈阳 110002)
微生物比浊法测定注射用替考拉宁的效价含量
张文杰*(沈阳医学院附属第二医院药剂科,辽宁 沈阳110002)
DOI10.14009/j.issn.1672-2124.2016.03.031
摘要目的:建立比浊法测定注射用替考拉宁效价含量的方法,以用于其质量控制。方法:分别采用微生物比浊法和管碟法对注射用替考拉宁的效价进行检定,比较2种方法的效果。结果:替考拉宁线性范围为5.0~15.0 u/ml,浓度的对数与吸光度成良好的线性关系,线性方程为A=1.372-0.792 6l gC(r=0.997),平均回收率为100.46%,RSD为0.85%。结论:比浊法和管碟法测定注射用替考拉宁效价含量的结果无显著差异。微生物比浊法灵敏、准确、可靠、重现性好,可用于注射用替考拉宁的质量控制。
关键词效价; 含量; 比浊法; 管碟法; 替考拉宁
Determination of Content of Teicoplanin for Injection by Microbiological Turbidimetric Method
ZHANG Wenjie (Dept.of Parmacy, the Second Affiliated Hospital of Shenyang Medical College, Liaoning Shenyang 110002, China)
ABSTRACTOBJECTIVE:To establish a microbiological turbidimetri method for the determination of content of teicoplanin for injection, so as to control its quality. METHODS: Microbiological turbidimetri method and cup-plate method were respectively adopted to detect and compare the the potency of teicoplanin for injection, and the effects of two methods were compared. RESULTS: The calibration curve was linear with the logarithm of concentration range of 5.0-15.0 (μ/ml) of teicoplanins, the linear equation wasA=1.372-0.792 6l gC(r=0.997), the average recovery was 100.46%,RSDwas 0.85%. CONCLUSIONS: There was no significant difference in the determination of content of teicoplanin for injection between turbidimetric method and cup-plate method. Microbiological turbidimetri method is sensitive, accurate, reliable and reproducible, suitable for quality control of teicoplanin for injection.
KEYWORDSPotency; Content; Turbidimetric method; Teicoplanin
替考拉宁作为一种重要的抗菌药物,临床主要用于多重耐药菌感染的治疗[1]。为了更好的控制药品的质量,保证药品的安全有效,参考相关文献[2-7],本研究采用微生物比浊法《中国药典》(2005年版)对该制剂含量进行测定,并与该制剂含量测定的现行标准的管碟法进行比较,以评价该制剂的质量控制方法,现报告如下。
1仪器与试药
岛津UV-260型紫外分光光度计(日本岛津公司);WBS-200多功能微生物比浊法自动测量分析仪与ZY-300微生物管碟效价测定仪(北京先驱威烽技术开发公司生产)。
金黄色葡萄球菌 [CMCC(B)26003]和枯草芽孢杆菌 [CMCC(B)63501] 由中国食品药品检定院提供。替考拉宁标准品(批号130374-201201;效价847 u/mg)由中国食品药品检定院提供。注射用替考拉宁(批号:2012016,2012017,2012018;规格1.0 g)为市场上购买。营养肉汤培养基(批号120509);抗菌药物检定培养基Ⅱ(pH 6.5,批号120107)由北京三药科技开发公司提供。甲醛、氯化钠、磷酸氢二钾和磷酸二氢钾为分析纯;0.9%氯化钠注射液和磷酸盐缓冲液(pH 6.0)均按《中国药典2部》(2010年版)附录配制。
2方法与结果
2.1管碟法
取装量差异项下的供试品细粉适量,精密称定,用pH 6.0的磷酸盐缓冲液制成每1 ml中约含1 000 u/ml的溶液,按照《中国药典2部》(2010年版)附录Ⅺ A中抗菌药物微生物检定法测定。高、低浓度分别为40 u/ml和20 u/ml,试验菌为枯草芽孢杆菌 [CMCC(B)63501],培养温度36~37 ℃,培养时间14~16 h。
2.2比浊法
2.2.1菌液及含菌培养基的制备:取金黄色葡萄球菌新鲜斜面培养物一白金耳,接种于营养肉汤培养基100 ml中,摇匀,使其在530 nm波长处的吸光度约为1.0,为含菌培养基。
2.2.2溶液的配制:取替考拉宁标准品,精密称定,加灭菌水稀释至1 000 μ/ml备用;作为标准品溶液;另取装量差异项下的注射用替考拉宁,精密称定,加灭菌水稀释至1 000 μ/ml制成溶液,取样3批,分别制备,作为供试品溶液。
2.2.3测定方法:精密量取供试品溶液1 ml置灭菌试管中,每个浓度9管,分别精密加入菌液培养基9 ml,立刻摇匀,放入比浊法自动测量分析仪中,于37 ℃培养5 h取出,立即加入甲醛溶液(1→5)0.5 ml,充分混匀;标准品溶液测定同上述方法一样。以含9.0 ml菌液培养基、1.0 ml磷酸盐缓冲液和0.5 ml甲醛溶液(1→5)同条件培养的溶液为空白液;分别于紫外分光光度计530 nm波长处测定供试液和空白液试管中金黄色葡萄球菌对数生长期内的不同培养时间吸光度值(A)。
2.2.4线性关系及范围:精密量取标准品溶液适量,分别用磷酸盐缓冲液稀释成浓度分别为5.0、7.0、9.0、11.0、13.0、15.0 u/ml的溶液,作为供试液,照“2.2.3”项下测定方法测得吸收度,以浓度(C)的负对数値为横坐标,吸收度(A)为纵坐标进行线性回归,得线性方程:A=1.372-0.792 1 gC(r=0.997)。结果,替考拉宁在5.0~15.0 μ/ml的浓度范围内与吸光度线性关系良好,并通过t检验可靠性测验结果判定证明回归效果显著。
2.2.5回收率试验:精密量取标准品溶液适量,用磷酸缓冲溶液分别稀释成浓度为5.0、10.0、15.0 μ/ml的溶液各6份,按“2.2.3”项下测定方法测定吸收度,计算回收率和RSD%,见表1。由表1可见,平均回收率为100.46%,RSD为0.85%。
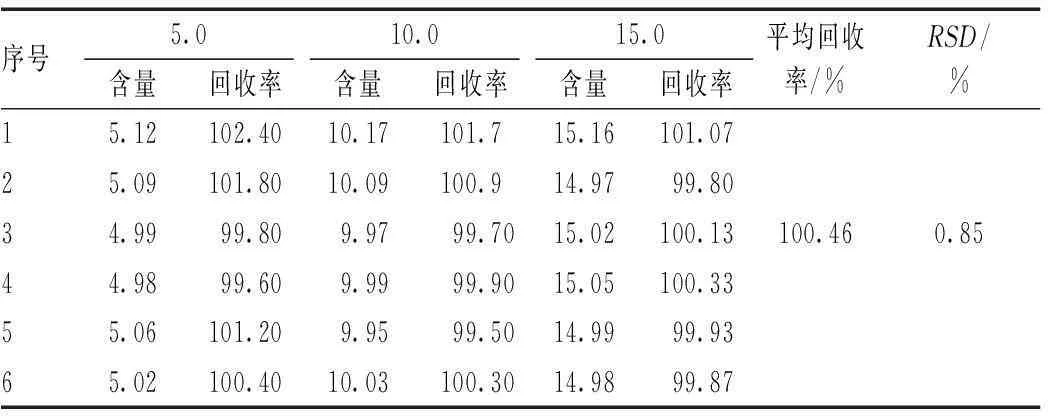
表1 回收率试验结果(μ/ml)
2.2.6精密度试验:取“2.2.5”项下回收率试验10.0 μ/ml浓度标准品溶液作9支管,按“2.2.3”项下测定方法测定吸收度,计算吸光度RSD为1.7%。
2.2.7稳定性试验:取10.0 μ/ml浓度标准品溶液经0、1、3、4 h分别测其吸光度値,计算RSD为0.97%。
2.2.8样品的测定:分别用管碟法和比浊法对3批样品进行含量测定:取样品分别用磷酸盐缓冲液稀释浓度为10.0 μ/ml作为供试液。按“2.2.3”项下测定方法测定吸收度,并计算含量,并与管碟法含量进行了比较,2种方法结果一致,见表2。
3讨论
由于任何影响液体培养基内微生物生长的因素和仪器的性能均会影响测定的准确性,因此,在试验中应考虑培养时间的控制、培养温度均一性及试验菌液的配制和培养管的均一性。《中国药典》(2005年版)新增比浊法,与管碟法比较,比浊法具有快速灵敏,精密度好的特点。
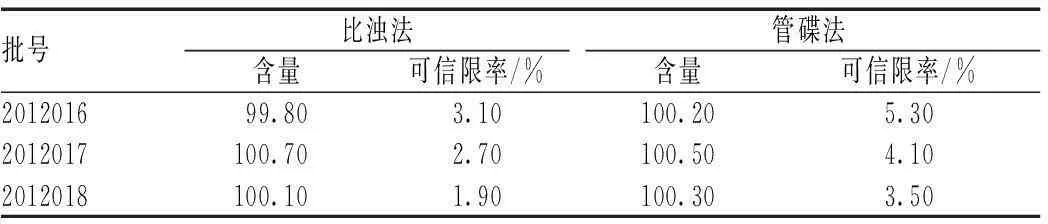
表2 种方法测定结果比较
本研究中试验培养4 h,当日出结果。采用管碟法测定时,高低剂量的剂距不大,且易产生双圈现象,效价测定时的可信限率不是很好。比浊法测定时高低剂量的剂距较大,避免了上述影响,且培养时间短,因此测定更为快速,准确,可信限率较小[8-11]。
综上所述,替考拉宁是种多组分抗菌药物主要通过微生物发酵法生成,同管碟法比较,比浊法测定注射用替考拉宁的效价含量操作方便、灵敏度高、重复性好、检验时间短、辅料无干扰、可信限率低、人为影响因素少。因此,比浊法能够应用于注射用替考拉宁效价测定[12-14]。
参考文献
[1]国家药典委员会.中华人民共和国药典2部[S].北京:中国医药科技出版社,附录93.
[2]胡昌勤,刘炜.抗生素微生物检定法及其标准操作[M].北京:气象出版社,2004:11.
[3]俞树荣.微生物学和微生物学检验[M].北京:人民卫生出版社,2001:25-27.
[4]英国药品委员会.英国药典[S].(2008年版)英国:The stationery office,2008:1328.
[5]欧洲药典委员会.欧洲药典[S].(6版)欧洲药品质量管理局:2007:2291.
[6]日本药典委员会.日本药局方[S].(15改正版)东京:日本厚生省,2006:15.615
[7]曾杰,王刚林.比浊法测定乙酰螺旋霉素片的效价含量[J].医药导报,2009,28(12):1630-1631.
[8]王洪家,郭福庆.微生物比浊法测定妥布霉素地塞米松眼膏的效价[J].天津药学,2013,25(2):7-9.
[9]郭福庆,王洪家.微生物比浊法测定妥布霉素、硫酸妥布霉素注射液及妥布霉素滴眼液的效价[J].天津药学,2010,22(6):4-7.
[10]李哲媛,康勇,范兵,等.微生物比浊法测定硫酸庆大霉素注射液的效价[J].中国药业,2005,14(3):38-39.
[11]崔学文,孙雪奇.微生物比浊法测定乙酰螺旋霉素片的效价[J].华西药学杂志,2008,23(2):231-232.
[12]杨红,秦川萍.HPLC法测定替考拉宁组分和有关物质[J].中国抗生素杂志,2006,31(3):184-186,192.
[13]耿艳辉,刘素彦,贺广锋,等.替考拉宁的HPLC法测定[J].现代中西医结合杂志,2014,23(3):307-309.
[14]陈悦,汪素岩,胡功允.微生物检定法测定替考拉宁及注射用替考拉宁的含量[J].中国药物杂志,2002,37(4):302-304.
(收稿日期:2015-07-02)
中图分类号R927
文献标志码A
文章编号1672-2124(2016)03-0364-02
*副主任中药师。研究方向:药物分析。E-mail:593438436@qq.com
