云南地方稻种抗稻瘟病基因Pi-d3序列变异分析
2016-04-29杨奕孙一丁马继琼王炎炎许明辉
杨奕 孙一丁 马继琼 王炎炎 许明辉
(云南省农业科学院 生物技术与种质资源研究所/ 云南省农业生物技术重点实验室/ 农业部西南作物基因资源与种质创制重点实验室, 昆明 650223; *通讯联系人,E-mail:xuminhui@sohu.com)
云南地方稻种抗稻瘟病基因Pi-d3序列变异分析
杨奕孙一丁马继琼王炎炎许明辉*
(云南省农业科学院 生物技术与种质资源研究所/ 云南省农业生物技术重点实验室/ 农业部西南作物基因资源与种质创制重点实验室, 昆明 650223;*通讯联系人,E-mail:xuminhui@sohu.com)
杨奕,孙一丁,马继琼,等. 云南地方稻种抗稻瘟病基因Pi-d3序列变异分析. 中国水稻科学, 2016, 30(1): 17-26.
摘要:对来自云南的80份地方稻种抗稻瘟病基因Pi-d3编码区序列进行了PCR扩增并测序分析。结果表明,与地谷相比,80份云南地方稻种的Pi-d3编码区序列(全长2775 bp)存在39个变异位点,平均变异率为1.41%。所有材料可以归为37种单倍型,频率较高的单倍型是H8(28.8%)、H4(11.3%)、H23(5.0%),其他单倍型频率较低,显示了云南地方稻种Pi-d3基因变异丰富,单倍型类型多,但频率较低。37种单倍型中存在28个氨基酸差异位点,共编码33种蛋白,其中18种单倍型共计32份材料(包括12份籼稻品种)出现了假基因,假基因化的频率较高,可能是粳稻Pi-d3假基因化向籼稻渗透。除已发现的737位氨基酸假基因位点外,新发现32和467两个假基因位点。Pi-d3基因在籼稻、粳稻亚种,水稻、陆稻,黏稻、糯稻的单倍型类型及频率两方面均存在差异,表明亚种间或生态型间发生了一定的遗传分化。37种单倍型在云南的地理分布呈大分散、小聚居的特点,普洱、版纳、临沧的单倍型种类最丰富,并以之为中心向外扩展,单倍型种类随之减少。
关键词:云南地方稻种; 稻瘟病; Pi-d3基因; 单核苷酸多态性
水稻是世界上重要的粮食作物,稻瘟病是由稻瘟病菌(Magnaportheoryzae;无性态:Pyriculariaoryzae)引起的水稻真菌病害[1],在世界各水稻种植区均有发生,可引起水稻大幅减产,甚至绝收,严重阻碍了水稻生产的可持续发展。稻瘟病抗性可分为垂直抗性和水平抗性两种类型,垂直抗性由单个主效抗性基因控制,水平抗性则由微效多基因控制[2-4]。到目前为止,通过广泛的遗传分析,水稻中至少已鉴定和定位了86个抗稻瘟病基因(国家水稻数据中心),这些基因大部分成簇地分布于水稻除第3染色体以外的其他11条染色体上[5],其中,已有24个稻瘟病主效抗性基因被成功克隆[6-9]。
水稻抗稻瘟病基因Pi-d3由Shang等[10]在比较籼粳稻全基因组NBS-LRR基因等位间假基因化差异时,利用假基因化标记在分离的感病小群体内克隆得到。Pi-d3基因位于水稻第6染色体上,属于组成型表达基因,含有2775 bp的编码区,编码924个氨基酸,含有NBS-LRR结构域和MHD基序。由于Pi-d3抗性基因LRR序列中有一个碱基突变形成终止子,所以存在等位的假基因。
云南高原地形气候复杂,位于中国与南亚两个稻种起源中心之间,云南境内海拔76~2700 m区域均有亚洲栽培稻地方品种分布,是世界上最大的稻种遗传多样性中心之一,基因多样性大于中国其他地理群[11]。本研究对云南不同生态区的80份地方稻种Pi-d3基因编码区进行扩增并测序,通过分析Pi-d3基因在核苷酸水平上的多态性,明确云南稻种Pi-d3基因序列变异类型和地理分布特点,旨在为研究稻种传播过程中生态环境变化与基因变异的关系提供依据,为筛选抗稻瘟病地方品种提供材料。
1材料与方法
1.1供试材料
从保存于云南省农业科学院生物技术与种质资源研究所内的云南地方稻种资源核心种质库中随机抽取80份来源于云南省不同州市(县)的地方品种作为本研究的材料。按籼粳亚种分类,粳稻46份,籼稻34份;按水陆稻分类,水稻48份,陆稻32份;按黏糯稻分类,黏稻62份,糯稻18份。本研究以日本晴Pi-d3基因序列为测序对照。
1.2水稻基因组DNA的提取
在水稻3~4叶期,取新鲜叶片,采用改进的CTAB法提取基因组DNA[12]。
1.3Pi-d3基因同源序列的获取及分析
根据已知的Pi-d3基因的保守序列设计引物对(Pi-d3-1F:5′-GCGAGAAGGAAGTAACACCCA-3′;Pi-d3-1R:5′-CGGAGGATATCGTGCATTTGG-3′;Pi-d3-2F:5′-GTACGACTCTGGGTTGCTGAA-3′;Pi-d3-2R:5′-AGAATGAATGTCCTGACTGAAACC-3′),由华大基因公司合成后,对云南地方稻种抗稻瘟病基因Pi-d3进行扩增。
PCR反应体系总体积为40 μL,包括10×缓冲液 4 μL,dNTPs 2 μL,4 mol/L正向和反向引物2 μL,ExTaq酶 0.5 μL,20 ng/μL DNA模板 1 μL,ddH2O 28.5 μL。PCR反应程序如下:95℃下预变性5 min;94℃下变性40 s,57℃下退火30 s,72℃下延伸2 min,35个循环;72℃下再延伸10 min。PCR扩增产物用0.5%的琼脂糖凝胶电泳。电泳后于紫外投射仪下检测条带合格后,送华大基因公司进行测序,每个材料重复测序两次。

2结果与分析
2.1云南地方稻种Pi-d3等位基因编码区序列的变异
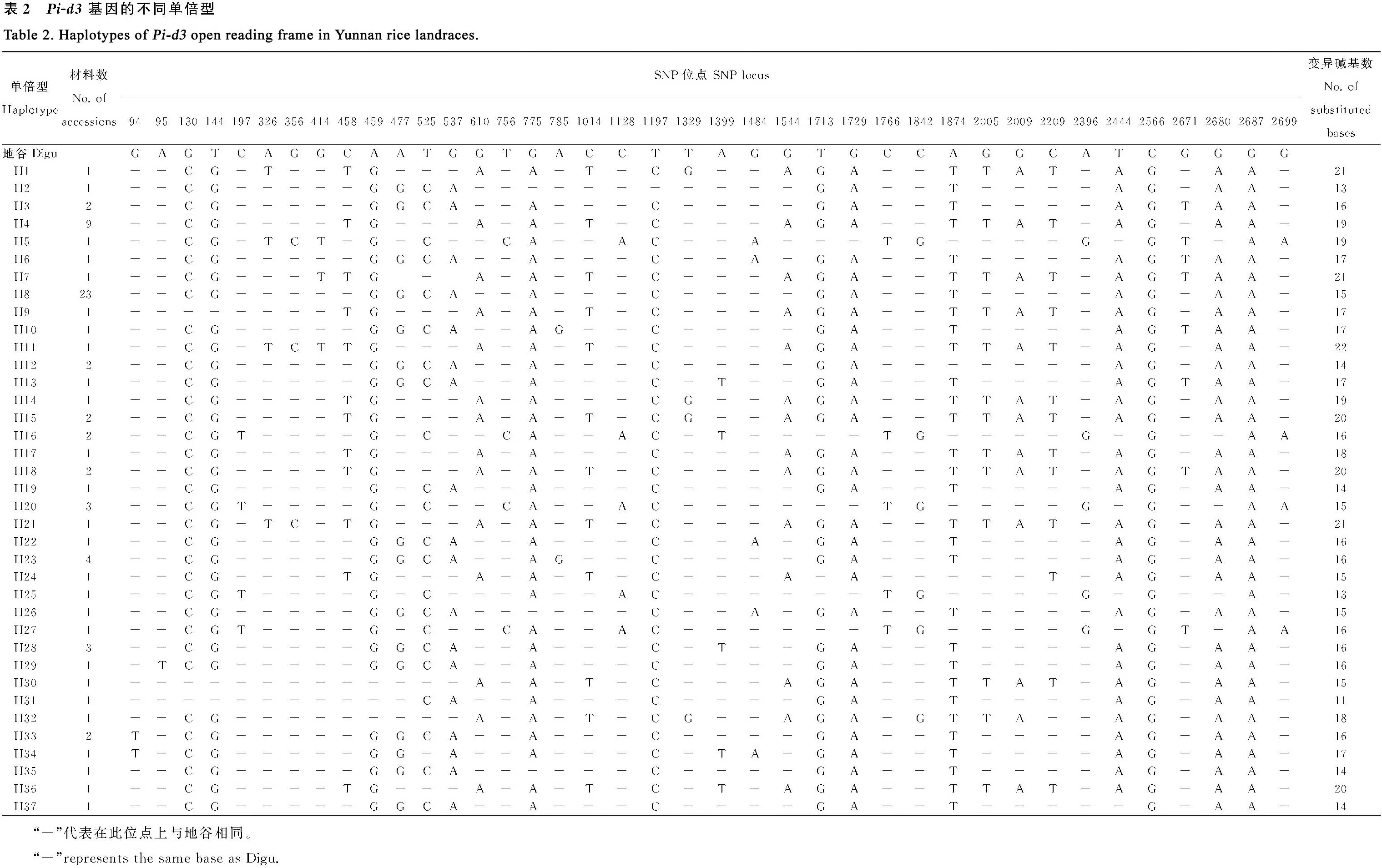
在水稻中,Pi-d3基因编码区的长度为2775 bp,实验获得的日本晴序列长度及碱基顺序与从GenBank获得的序列No. FJ773286.1一致,表明测序数据可靠。与地谷序列(GenBank Accession No.FJ773285.1)相比,80份云南地方稻种的Pi-d3编码序列中,共发现39个核苷酸变异位点,分别位于94,95,130,144,197,326,356,414,458,459,477,525,537,610,756,775,785,1014,1128,1197,1329,1399,1484,1544,1713,1729,1766,1842,1874,2005,2009,2209,2396,2444,2566,2671,2680,2687,2699位点(表1),平均变异率1.41%。39个不同位点的变异频率为1.25%~100.00%,值得注意的是,位点2566、2687处的变异率均达到100.00%,表明所检测的云南稻种在2566和2687位点与地谷完全不同。39个变异位点中17个发生颠换,占总突变位点的43.59%,其中G/T颠换7个(占17.95%),A/T颠换5个(占12.82%),C/G表1云南地方稻种Pi-d3基因编码区序列的变异
Table 1. Sequence variations of Pi-d3 open reading frame in Yunnan rice landraces.

变异位点Variationsite地谷碱基BaseinPi-d3Digu替代碱基Substitutedbase替换类型Substitutiontype测序材料数Sequencedaccessionnumber替代材料数No.ofsubstitutedaccessions频率Frequence/%94GT颠换Transversion8033.895AT颠换Transversion8011.3130GC颠换Transversion807796.3144TG颠换Transversion807796.3197CT转换Transition8078.8326AT颠换Transversion8045.0356GC颠换Transversion8033.8414GT颠换Transversion8033.8458CT转换Transition802227.5459AG转换Transition807796.3477AG转换Transition804657.5525TC转换Transition805568.8537GA转换Transition804860.0610GA转换Transition802430.0756TC转换Transition8078.8775GA转换Transition807796.3785AG转换Transition807593.81014CT转换Transition802227.51128CA颠换Transversion80810.01197TC转换Transition807998.81329TG颠换Transversion8056.31399AT颠换Transversion80810.01484GA转换Transition8056.31544GA转换Transition802430.01713TG颠换Transversion807188.81729GA转换Transition807290.01766CT转换Transition80810.01842CG颠换Transversion80911.31874AT颠换Transversion806986.32005GT颠换Transversion802328.82009GA转换Transition802328.82209CT转换Transition802328.82396AG转换Transition80810.02444TA颠换Transversion807188.82566CG颠换Transversion8080100.02671GT颠换Transversion801012.52680GA转换Transition807290.02687GA转换Transition8080100.02699GA转换Transition8078.8
颠换4个(占10.26%),A/G颠换1个(占2.56%);22个位点发生转换,占总突变位点的56.41%,其中G/A转换14个(占35.90%),C/T转换8个(占20.51%)。经过DNA序列的比对,可将80份云南地方稻种归为37种单倍型(表2),日本晴归于H4。每种单倍型的变异碱基数均在10个以上,平均变异碱基数17个,其中单倍型H11的变异碱基数最多(22个),单倍型H31的变异碱基数最少(11个)。从表2中还可以看出,37种单倍型中H8(28.8%),H4(11.3%),H23(5.0%)所占比例较高,是云南的主要类型,而其他单倍型的频率较低,每个单倍型仅有1~2个品种。可见,云南地方稻种在Pi-d3位点上具有变异丰富、单倍型类型多、频率较低的特点。
2.2抗稻瘟病基因Pi-d3蛋白的氨基酸分析
对比分析云南地方稻种Pi-d3基因的37种单倍型与地谷编码蛋白质情况,发现存在28个氨基酸的变异。37种单倍型共编码33种蛋白质,单倍型H2与H35、H4与H17、H8与H19、H14与H15编码的蛋白质不存在差异(表3)。这33种不同的蛋白质中,有16种提前出现终止子为非完整蛋白,其余的17种为完整蛋白。
结合表2、表3可以看出H1、H4、H17、H7、H9、H11、H14、H15、H18、H21、H24、H30、H36共13种单倍型由于在核苷酸2209位处发生C/T颠换,使氨基酸737位出现终止子,导致Pi-d3基因成为假基因,这是Shang等发现的假基因位点,由此可以推测这些单倍型的植株易感病[10]。此外,本研究中新发现单倍型H33、H34由于在核苷酸94位出现G/T颠换,致使氨基酸32位出现终止子;单倍型H13、H16、H28、H34、H36在核苷酸1399位发生A/T颠换,导致氨基酸467位出现终止子,这些是新发现的易感病假基因单倍型。
80份云南地方材料中有32份出现假基因化现象,假基因出现频率高达40%。这些假基因化材料包含粳稻20份,籼稻12份,虽然籼稻中出现假基因的频率(35.3%)明显低于粳稻(43.5%),但检测出了籼稻中存在假基因化现象。而Shang等在发现Pi-d3基因时认为,Pi-d3假基因化只存在于粳稻和杂草稻中,而在检测过的野生稻和籼稻中都没有假基因化[10]。云南地方稻种Pi-d3假基因化在水稻和陆稻中出现的数量同为16份,但在水稻中出现频率(33.3%)低于陆稻(50.0%)。按黏糯稻分类,供试材料中有23份黏稻和9份糯稻材料出现Pi-d3假基因化,糯稻的出现频率(50.0%)高于黏稻(37.1%)。Pi-d3假基因化在云南的10个州市均有分布,以普洱(8份)、版纳(7份)、临沧(6份)为主,德宏出现3份,文山、昭通各出现2份,玉溪、红河、丽江、保山均出现1份。版纳出现Pi-d3假基因化的频率最高,达87.5%。在普洱、版纳、临沧这些地区,籼稻和粳稻同时进行种植,天然杂交几率较高,云南籼稻品种中发现了假基因化现象,推测云南地方稻种中Pi-d3假基因化从粳稻向籼稻的渗透。
表3不同单倍型中Pi-d3基因氨基酸序列变化
Table 3. Amino acid variation of Pi-d3 in 37 haplotypes.
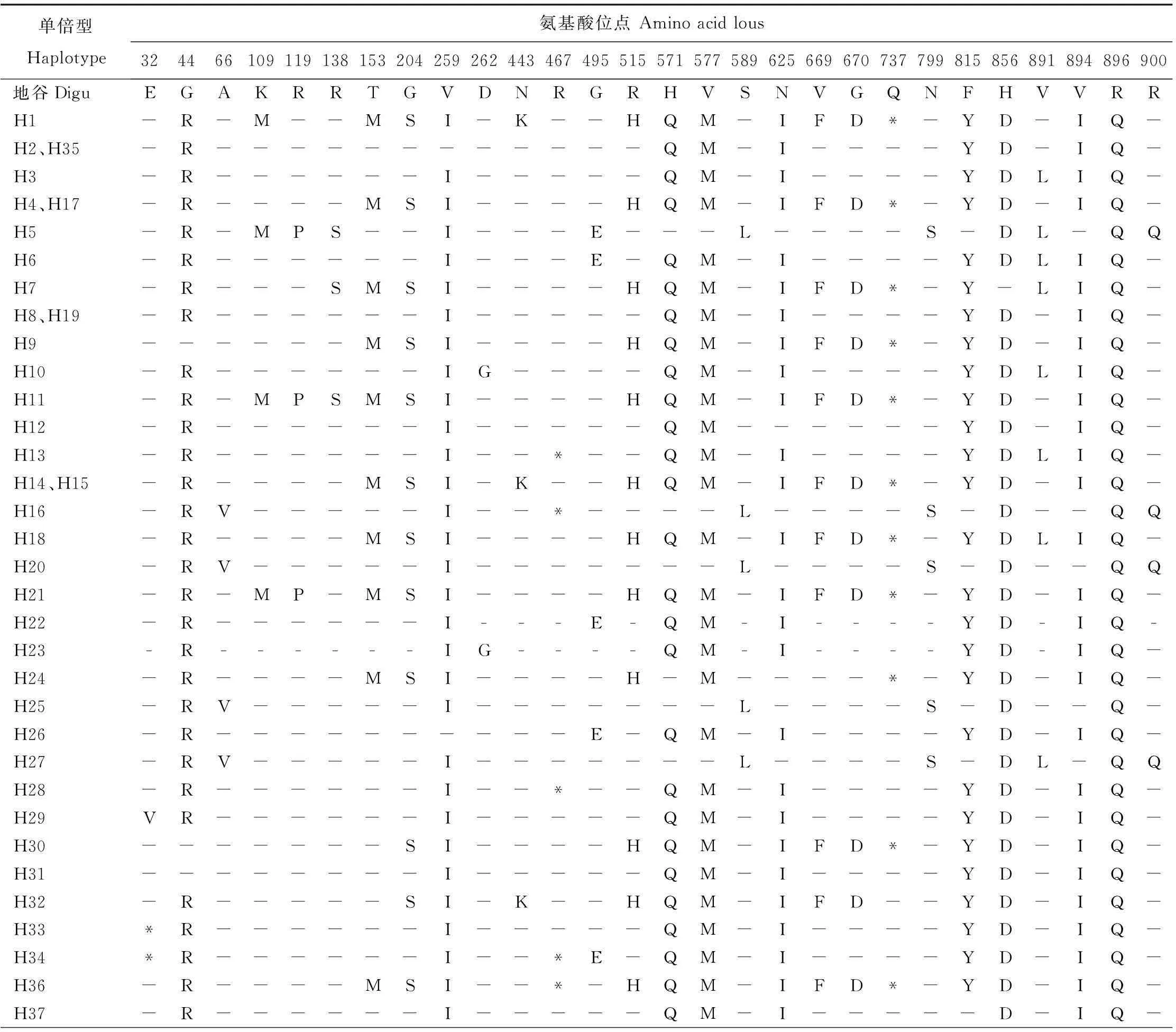
单倍型Haplotype氨基酸位点Aminoacidlous324466109119138153204259262443467495515571577589625669670737799815856891894896900地谷DiguEGAKRRTGVDNRGRHVSNVGQNFHVVRRH1-R-M--MSI-K--HQM-IFD*-YD-IQ-H2、H35-R------------QM-I----YD-IQ-H3-R------I-----QM-I----YDLIQ-H4、H17-R----MSI----HQM-IFD*-YD-IQ-H5-R-MPS--I---E---L----S-DL-QQH6-R------I---E-QM-I----YDLIQ-H7-R---SMSI----HQM-IFD*-Y-LIQ-H8、H19-R------I-----QM-I----YD-IQ-H9------MSI----HQM-IFD*-YD-IQ-H10-R------IG----QM-I----YDLIQ-H11-R-MPSMSI----HQM-IFD*-YD-IQ-H12-R------I-----QM------YD-IQ-H13-R------I--*--QM-I----YDLIQ-H14、H15-R----MSI-K--HQM-IFD*-YD-IQ-H16-RV-----I--*----L----S-D--QQH18-R----MSI----HQM-IFD*-YDLIQ-H20-RV-----I-------L----S-D--QQH21-R-MP-MSI----HQM-IFD*-YD-IQ-H22-R------I---E-QM-I----YD-IQ-H23-R------IG----QM-I----YD-IQ-H24-R----MSI----H-M----*-YD-IQ-H25-RV-----I-------L----S-D--Q-H26-R----------E-QM-I----YD-IQ-H27-RV-----I-------L----S-DL-QQH28-R------I--*--QM-I----YD-IQ-H29VR------I-----QM-I----YD-IQ-H30-------SI----HQM-IFD*-YD-IQ-H31--------I-----QM-I----YD-IQ-H32-R-----SI-K--HQM-IFD--YD-IQ-H33*R------I-----QM-I----YD-IQ-H34*R------I--*E-QM-I----YD-IQ-H36-R----MSI--*-HQM-IFD*-YD-IQ-H37-R------I-----QM-I-----D-IQ-
“-”代表在此位点上与地谷相同; “*”代表终止子。
“-”represents the same base as Digu; “*”represents terminator.
2.3抗稻瘟病基因Pi-d3不同单倍型在云南各地区的分布
分析Pi-d3基因在云南省各州市的地理分布发现(表4),主要单倍型中H4集中分布在普洱、临沧等地,在普洱的分布频率最高,达44.4%,为普洱的优势单倍型。单倍型H8在云南省的分布范围较为广泛,主要分布在德宏、普洱、临沧、保山、玉溪、文山、昭通等地,其中在普洱和临沧的分布频率较高(17.4%),是普洱和临沧两地的优势单倍型。单倍型H23在普洱的分布频率同样较高(50.0%)。云南各地区的单倍型多样性指数表现为:普洱市(0.885)>版纳州(0.875)>临沧市(0.871)>玉溪市(0.861)>文山州(0.735)>德宏州(0.722)>保山市(0.720)>丽江市(0.667)>昭通市(0.560)。显而易见,普洱、版纳、临沧拥有较多类型的单倍型。这些结果进一步表明Pi-d3基因在云南各地不同的生态类型之间存在显著的遗传分化。
2.4抗稻瘟病基因Pi-d3不同单倍型在水稻各类型中的分布
Pi-d3基因在云南地方品种的粳稻、籼稻亚种间的分布存在差异,H1、H2、H3、H5、H6、H7、H9、H10、H11、H13、H14、H17、H18、H19、H20、H21、H22、H24、H25、H26、H27等单倍型只在粳稻中出现;H28、H29、H30、H31、H32、H33、H34、H35、H36、H37等单倍型只在籼稻中出现。在Pi-d3位点上,粳稻和籼稻的共享基因型有H4、H8、H12、H15、H16、H23,根据共享基因型频率可以看出H4为粳稻的优势单倍型,H8为籼稻的优势单倍型。单倍型H4的序列与粳稻日本晴(GenBank Accession No. FJ773286.1)完全相同,单倍型H8的序列与籼稻 93-11(GenBank Accession No.FJ773285.1)的序列完全相同。可见,籼稻和粳稻均有优势单倍型,表明两个亚种在此位点上已发生明显的遗传分化,粳稻单倍型类型更为丰富。
Pi-d3基因在水稻和陆稻间的分布同样存在差异,H1、H2、H3、H5、H6、H7、H11、H12、H13、H14、H17、H21、H26、H27、H32等单倍型只在陆稻中出现;H9、H10、H19,H22、H24、H25、H28、H29、H30、H31、H33、H34、H35、H36、H37等单倍型只在水稻中出现;H4、H8、H15、H16、H18、H20、H23等单倍型在水陆稻种均有出现,其中H4为陆稻的优势单倍型、H8、H20、H23为水稻的优势单倍型。
Pi-d3基因在黏性稻和糯性稻间的分布存在差异,H1、H2、H5、H6、H7、H9、H13、H14、H15、H16、H17、H20、H22、H23、H26、H27、H29、H31、H32、H33、H34、H35、H36、H37只在黏稻中分布;H10、H11、H19、H21、H24、H25、H30只在糯稻中分布;H3、H4、H8、H12、H18、H28等单倍型在黏稻和糯稻中均有分布,其中H4、H8为黏稻的优势单倍型,H28为糯稻的优势单倍型。
2.5进化树的构建
所有材料可分为两大枝(图1),对应氨基酸577、589、799、894位点的变异,其中Ⅰ枝包括H20、H16、H27、H5、H25和地谷,其余的32种单倍型归为第Ⅱ枝。在第Ⅰ枝中,地谷单独为一个小枝,H25、H5、H27、H16、H20为一个群,它们与地谷的亲缘关系较近,特征是氨基酸577、894位点无变异,589位点变异为L(亮氨酸),799位点变异为S(丝氨酸)。在第Ⅱ枝中,H37单独为一个小枝,另外的31个单倍型聚为一个亚枝,这个亚枝中H2、H35、H26、H6、H22、H34、H3、H13、H10、H23、H8、H19、H28、H29、H33、H31聚为一个群,它们在氨基酸669和670位点均无变异。H24、H32、H9、H30、H7、H18、H17、H36、H4、H14、H15、H1、H11、H21聚为一个群,它们的特征是在氨基酸204位点变异为S(丝氨酸),515位点变异为H(组氨酸),H12单独为一小枝。从进化关系看H37、H12、H8、H19、H28、H29、H33更为原始。
3讨论
云南省地形气候复杂,位于中国与南亚两个稻种起源中心之间,是世界上最大的稻种遗传多样性中心之一,基因多样性大于中国其他地理群[11]。本研究通过核苷酸序列分析将80份云南地方稻种的Pi-d3基因归为37种单倍型;单倍型分析表明云南地方稻种Pi-d3基因单倍型种类丰富,低频率的单倍型较多,籼稻和粳稻均有优势单倍型,两个亚种间已发生明显的遗传分化,出现这种现象也可能是籼稻和粳稻由不同的野生稻进化而来。
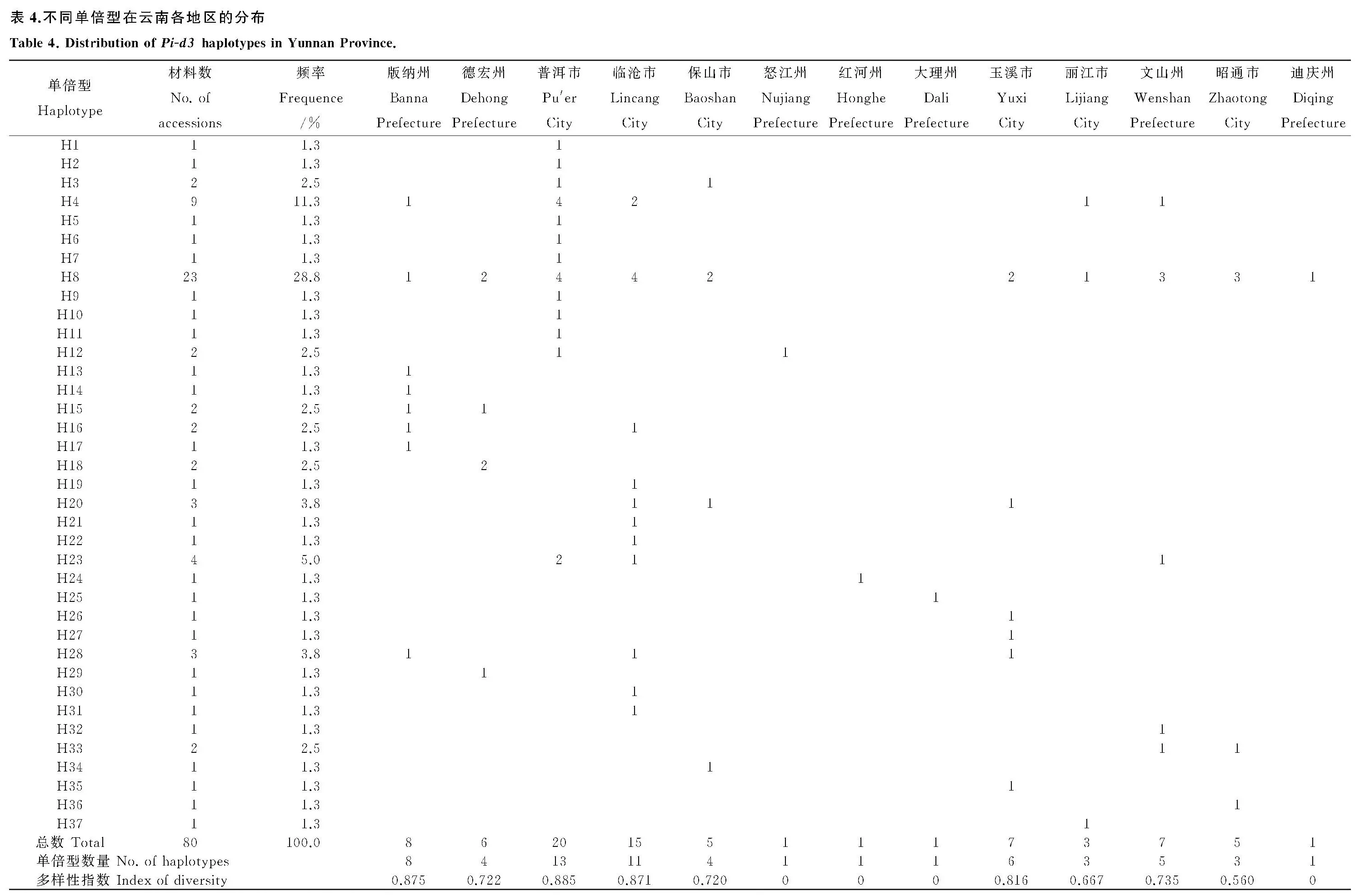
表5Pi-d3不同单倍型在水稻各类型中的分布
Table 5. Distribution of Pi-d3 haplotype in different rice types.
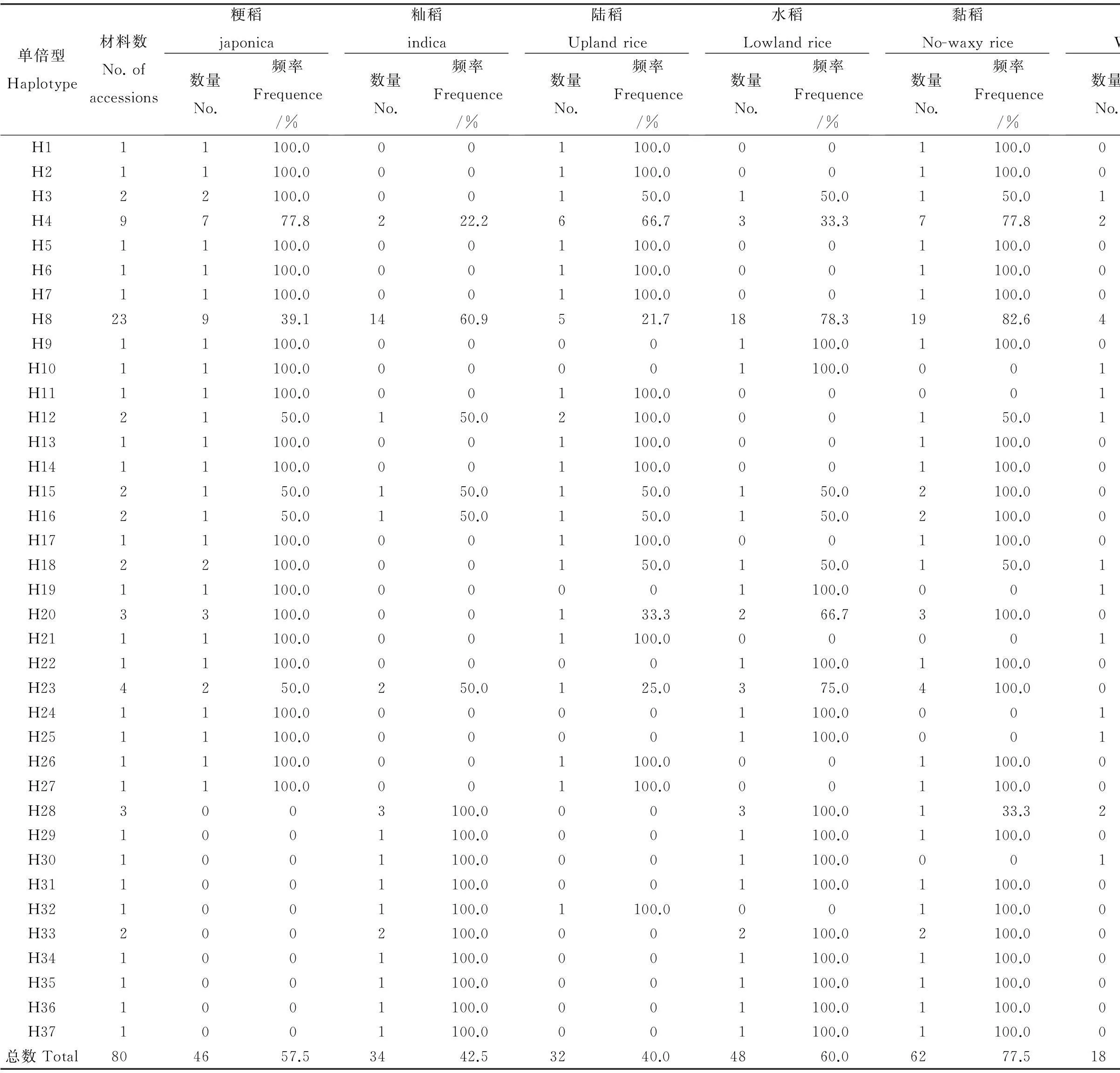
单倍型Haplotype材料数No.ofaccessions粳稻japonica数量No.频率Frequence/%籼稻indica数量No.频率Frequence/%陆稻Uplandrice数量No.频率Frequence/%水稻Lowlandrice数量No.频率Frequence/%黏稻No-waxyrice数量No.频率Frequence/%糯稻Waxyrice数量No.频率Frequence/%H111100.0001100.0001100.000H211100.0001100.0001100.000H322100.000150.0150.0150.0150.0H49777.8222.2666.7333.3777.8222.2H511100.0001100.0001100.000H611100.0001100.0001100.000H711100.0001100.0001100.000H823939.11460.9521.71878.31982.6417.4H911100.000001100.01100.000H1011100.000001100.0001100.0H1111100.0001100.000001100.0H122150.0150.02100.000150.0150.0H1311100.0001100.0001100.000H1411100.0001100.0001100.000H152150.0150.0150.0150.02100.000H162150.0150.0150.0150.02100.000H1711100.0001100.0001100.000H1822100.000150.0150.0150.0150.0H1911100.000001100.0001100.0H2033100.000133.3266.73100.000H2111100.0001100.000001100.0H2211100.000001100.01100.000H234250.0250.0125.0375.04100.000H2411100.000001100.0001100.0H2511100.000001100.0001100.0H2611100.0001100.0001100.000H2711100.0001100.0001100.000H283003100.0003100.0133.3266.7H291001100.0001100.01100.000H301001100.0001100.0001100.0H311001100.0001100.01100.000H321001100.01100.0001100.000H332002100.0002100.02100.000H341001100.0001100.01100.000H351001100.0001100.01100.000H361001100.0001100.01100.000H371001100.0001100.01100.000总数Total804657.53442.53240.04860.06277.51822.5
Pi-d3基因在云南的分布范围广泛,云南省13个州市的不同生态类型中都有分布,呈现出大分散、小聚居的特点。水稻与稻瘟病菌之间存在特异互作现象,且符合“基因对基因”的关系。云南稻瘟病菌群体遗传多样性水平较高[15-16],不同海拔地区稻瘟病菌生理小种和遗传多样性存在差异[17]。在“稻-稻瘟病菌”的长期协同进化中,复杂多样的稻瘟病菌群体参与了品种的自然选择,为云南稻种资源稻瘟病抗性提供了进化的动力[18]。因此,云南地方稻种Pi-d3基因的多样性及广泛分布与相关稻瘟病菌生理小种的遗传多样性密切相关。
Shang等在检测中发现,Pi-d3假基因化只存在于粳稻和杂草稻中,在大部分被测的粳稻品种中Pi-d3基因转录起始位点开始的第2208位核苷酸处的CAG突变成为终止子TAG,使之成为了假基因,而在检测过的非洲栽培稻、AA组型野生稻和籼稻中都未发现假基因,由此推测这种突变是籼粳稻分化后发生的[10]。本研究在检测的80份云南地方稻种中发现20份粳稻和12份籼稻出现假基因化现象,假基因化频率较高,新发现核苷酸94、1399位两个假基因位点。Pi-d3假基因出现频率较高的地区一般同时种植籼粳稻,天然杂交的几率高,籼稻中出现假基因化可能是粳稻与籼稻杂交,粳稻假基因向籼稻渗透的结果。

图1Neighbor-joining 法构建水稻抗稻瘟病基因Pi-d3系统进化树
Fig. 1. Neighbor-joining phylogenetic tree for 37 Pi-d3 haplotypes.
Shang等[10]研究发现,抗稻瘟病基因Pi-d3在水稻品种地谷、93-11、TP309以及日本晴中均被检测到,但只有籼稻品种地谷和93-11中该基因对稻瘟菌具有抗性,在粳稻品种TP309和日本晴中,由于基因内部一个C/T的颠换,导致终止子提前,仅编码一个带有737个氨基酸的多肽,破坏了该蛋白的LRR区域,进而导致该基因功能的丧失。本研究新发现Pi-d3基因在籼稻中出现假基因化现象,这些假基因化的品种是否具有抗病性,需要进一步的抗病性研究。此外,除了出现Pi-d3假基因的单倍型,另外19种单倍型的Pi-d3氨基酸序列与地谷不同,它们的功能需要进一步研究。
参考文献:
[1]Couch B C,Hohn L M. A multilocus gene genealogy concordant with host preference indicates segregation of a new species,Magnaportheoryzae, fromM.grisea.Mycologia, 2002, 94: 683-693.
[2] Ezuka A. Field resistance of rice varieties to rice blast disease.RevPlantProtRes, 1972, 5: 1-21.
[3] Bonman J M, Mackill D J. Durable resistance to rice blast disease.Oryza, 1988, 25: 103-110.
[4]Wang G L,Mackill D J, Bonman M, et al. RFLP mapping of genes conferring complete and partial resistance to blast in a durably resistant rice cultivar.Genetics, 1994, 136: 1421-1434.
[5]Chen M, Presting G, Barbazuk W B, et al. An integrated physical and genetic map of the rice genome.PlantCell, 2002, 14: 537-545.
[6]Hua L, Wu J, Chen C, et al. The isolation ofPil, an allele at the pik locus which confers broad spectrum resistance to rice blast.TheorApplGenet, 2012, 125(5): 1047-1055.
[7]Zhu X, Chen S, Yang J, et al. The identification of Pi50(T), a new member of the rice blast resistance Pi2/Pi9 mukigene family.TheorApplGenet, 2012, 124(7): 1295-1304.
[8]Lee S W, Han S W, Sririyanum M, et al. A type I-secreted, sulfated peptide triggersXa21-mediated innate immunity.Science, 2009, 326(5954): 850-853.
[9] 杨勤忠,林菲,冯淑杰,等. 水稻稻瘟病抗性基因的分子定位及克隆研究进展. 中国农业科学 2009,42(5): 1601-1615.
Yang Q Z, Lin F, Feng S J, et al. Recent progress on molecular mapping and cloning of blast resistance genes in rice (OryzasativaL.).SciAgricSin, 2009, 42(5): 1601-1615. (in Chinese with English abstract)
[10]Shang J J, Tao Y, Chen X W, et al. Identification of a new rice blast resistance gene,Pi-d3, by genomewide comparison of paired nucleotide-binding site-leucine-rich repeat genes and their pseudogene alleles between the two sequenced rice genomes.Genetics, 2009, 182(4): 1303-1311.
[11]黄燕红,孙新立,王象坤. 中国栽培稻遗传多样性中心和起源研究. 植物遗传资源学报, 2005,6(2): 125-129.
Huang Y H, Sun X L, Wang X K. Study on the center of genetic diversity and its origin of cultivated rice in China.JPlantGenetRes, 2005, 6(2): 125-129.(in Chinese with English abstract)
[12]许明辉,郑明慧,刘彦中. 烟草品种RAPD分子标记多态性与品种鉴定.种子,1998(5): 23-25.
Xu M H, Zheng MH, Liu Y Z. Genetic diversity and identifieation in varieties of Nicotiana tabaccum L. by RAPD markers.Seed, 1998(5): 23-25.(in Chinese with English abstract)
[13]Fontaine C, Lovett P, Sanou H, et al. Genetic diversity of the shea tree.VitellariaparadoxaC.F. Gaertn, detected by RAPD and chloroplast microsatellite markers.Heredity, 2004, 93:639-648.
[14]Ballini E, Morel J B, Droc G, et al. A genome-wide meta-analysis of rice blast resistance genes and quantitative trait loci provides new insights into partial and complete resistance.PlantMicrobeInteract, 2008, 21: 859-868.
[15]李进斌,李成云,张 庆,等. 两套鉴别品种对云南稻瘟病菌株鉴别能力的比较. 中国农业科学,2009,42(2): 486-491.
Li J B, Li C Y, Zhang Q, et al. Comparison of differentiating capacity of two sets of differential lines using isolates ofMagnaporthegriseacollected from China′s Yunnan Province.SciAgricSin, 2009, 42(2): 486-491.(in Chinese with English abstract)
[16]Li J B, Yang J, Liu L, et al. Geographic distribution of avirulence genes in rice blast fungusin Yunnan Province.ChinaJResEcol, 2011, 2(2):181-185.
[17]林菁菁,李进斌,刘林,等. 云南元阳哈尼梯田稻瘟病菌遗传多样性分析. 植物病理学报,2009,39(1): 43-51.
Lin J J, Li J B, Liu L, et al. Genetic diversity ofMagnaporthegriseaof Hani terrace from Yuanyang County in Yunnan.ActPhytaSin, 2009, 39(1): 43-51.(in Chinese with English abstract)
[18]黄兴奇. 云南作物种质资源(稻作篇). 昆明:云南科学技术出版社,2005.
Huang X Q. Yunnan crop germplasm resources (volume rice). Kunming: Yunnan Science and Technology Press, 2005.
[19]李进斌,王甜,许明辉. 云南地方稻种抗稻瘟病基因Pi-ta和Pi-b的鉴定. 中国水稻科学,2012,26(5): 593-599.
Li J B, Wang T, Xu M H. Identification ofPitaandPi-bgenes for rice blast resistance of rice landraces from Yunnan Province.ChinJRiceSci, 2012, 26(5): 593-599.(in Chinese with English abstract)
[20]赵国珍,蒋春苗,刘吉新,等. 云南野生稻抗稻瘟病Pi-ta基因的检测及分析. 中国水稻科学,2014,28(6): 675-680.
Zhao G Z, Jiang C M, Liu J X, et al. Identification and analysis on the rice blast resistance genePi-tain wild rice from Yunnan, China.ChinJRiceSci, 2014, 28(6): 675-680.(in Chinese with English abstract)
Sequence Variation ofPi-d3 for Rice Blast Resistance in Yunnan Rice Landrace
YANG Yi, SUN Yi-ding, MA Ji-qiong, WANG Yan-yan, XU Ming-hui*
(InstituteofBiotechnologyandGeneticResources/KeyLaboratoryofBiotechnologyResearchofYunnanProvince/KeyLaboratoryofSouthwesternCropGeneResourcesandGermplasmInnovationofMinistryofAgriculture,YunnanAcademyofAgriculturalSciences,Kunming650223,China;*Corresponding author, E-mail:xuminhui@sohu.com)
YANG Yi, SUN Yiding, MA Jiqiong, et al. Sequence variation ofPi-d3 for rice blast resistance in Yunnan rice landrace. Chin J Rice Sci, 2016, 30(1): 17-26.
Abstract:The sequence variations of Pi-d3 for rice blast resistance in 80 Yunnan rice landraces were analyzed by resequencing open reading frame (ORF). Compared with Pi-d3(Digu )ORF, a total of 39 nucleotide variations were found in 2775-bp ORFs of 80 rice accessions with the average mutation rate of 1.41%. The WTBXPi-d3ORF of 80 rice accessions was divided into 37 haplotypes based on the nucleotide variations. H8(28.8%), H4(11.3%) and H23(5.0%) are high-frequency types, while other types occurred at low frequency. The results showed that the WTBXPi-d3 in Yunnan rice landraces was rich in genetic variations and haplotypes,but low frequency. A total of 28 amino acids variations were found in 33 translation proteins of 37 haplotypes. 18 haplotypes with 32 rice landraces including 12 indica accessions possessde the Pi-d3 pseudogenes. The frequency of pseudogene was high. It was possible due to that the Pi-d3 pseudogene permeated to indica. Terminators were newly founded at position 32 and 467 of protein except the published terminator at position 737. Pi-d3 differed in both type and frequency of haplotypes between the subspecies of indica and japonica, the ecotypes of lowland and upland rice, no-waxy and waxy rice. It indicated that genetic differentiation occurred between subspecies or ecotypes. Geographical distribution showed that 37 haplotypes spread over a large area while concentrated in small areas. Puer, Banna and Lincang were the central area with abundant haplotypes, and based on this scale, the types of haplotypes decreased outward progressively.
Key words:Yunnan rice landraces; rice blast; Pi-d3; single nucleotide polymorphism
文章编号:1001-7216(2016)01-0017-10
中图分类号:Q756; S435.111.4+1
文献标识码:A
基金项目:国家自然科学基金资助项目(31360331);科技部基础性工作专项(2012FY110200); 云南省自然科学基金资助项目(2013FZ146)。
收稿日期:2015-06-13; 修改稿收到日期: 2015-07-30。
