例析化学等效平衡解题技巧
2016-04-27陈正高
例析化学等效平衡解题技巧
■陈正高
一、紧抓速率,判断平衡
A.N2的消耗速率等于N2的生成速率
B.H2的消耗速率等于N2的生成速率的3倍
C.NH3的消耗速率等于N2生成速率的2倍
D.单位时间内生成nmol N2,同时生成3nmol NH3
分析:有两种类型可以判断反应达到平衡:如果是同一物质,则需要生成速率等于消耗速率;如果是不同物质,需通过反应速率来表示,应符合两个方面,一是表示两个不同的方向;二是速率之比=化学计量数之比。A很明显是正确的,属于第一种类型,只是判断N2的消耗速率与生成速率。而选项B也是正确的,这是属于第二种类型,是不同的物质,其速率之比也是成比例的。本题选C。
二、加水稀释,移动方向
对于化学可逆反应,很多习题的考查方式都是通过改变反应物或者生成物的比例,使得平衡发生移动,进而判断平衡所导致的各个状态的改变。
例2A、B、C、D都是极易溶于水的弱电解质或者离子,且在水溶液中达到下列化学平衡,则加水稀释后,平衡向正反应方向移动的是()。


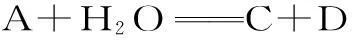
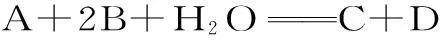
分析:加水稀释是令平衡移动的一种手段,它是同等程度下减小了反应物与生成物的浓度,其实这就相当于有气体反应物参加时扩大了容器的体积。对于选项A,反应物与生成物的系数和是相同的,扩大容器体积其平衡不会移动。而对于选项B和选项D,都是反应物的系数和大于生成物的系数和,增大体积,会使化学平衡向逆反应方向移动。只有选项C,反应物的系数和小于生成物的系数和,扩大体积使压强减小,平衡才会向正反应方向移动。本题选C。
三、状态改变,分析细节

A.两种方式达到平衡时,体系内混合气体的百分组成不同
B.两种方式达到平衡时,体系内混合气体的百分组成相同
C.达到平衡时,两种方式得到的平均相对分子质量相同
D.达到平衡时,第二种的气体密度是第一种的2倍
分析:这道题需要根据所给的化学反应式进行判断,第二种方式所加的物质完全转化为A、B时,可以生成4 mol A和4 mol B,与第一种方式物质的量的比值是相同的。再根据化学反应前后气体的化学计量数是相等的,压强对平衡的移动没有影响,所以第一种方式与第二种方式所达到的平衡是等效平衡,所以体系内混合气体百分比组成相同,平均相对分子质量也是相同的。又由于容器的体积是相等的,第二种方式气体质量是第一种气体质量的2倍,所以,达到平衡时,第二种方式的密度是第一种方式的二倍。本题选A。
作者单位:云南省会泽县实验高中
