化学反应原理在高考综合题中的应用
2016-04-27
化学反应原理在高考综合题中的应用
■高启锋
高考理综的化学部分,反应原理综合题属于其中一道必考题型,该试题涉及的内容主要包括氧化还原反应原理的综合应用、热化学方程式的书写及盖斯定律的应用、电化学原理的应用、化学反应速率及化学平衡移动的判断与应用、化学平衡图像的分析与计算、强弱电解质的判断、电解质溶液的pH值与离子浓度的大小比较、沉淀溶解平衡的判断及计算等。
化学反应原理的综合试题一般以与生产、生活联系紧密的物质为背景材料出组合题,知识覆盖面广、综合性较强,分值一般为15分左右,各小题之间有一定的独立性。纵观近三年的高考试题,化学反应原理试题常以选择、填空、读图、作图、计算等形式出现。
题型一:以图表形式考查盖斯定律、化学反应速率与限度
这类题型的格式比较固定化,考点也比较固定,一般会考查热化学方程式的书写及盖斯定律的应用、化学反应速率的计算、化学平衡图像的分析与判断,有时电化学题也会在最后呈现。2015年的新课标将氧化还原反应、电解质溶液的计算也设计在该类题型中,增大了试题的容量与考查范围。
例1(2015新课标Ⅰ,28)(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛图。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____。
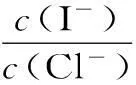
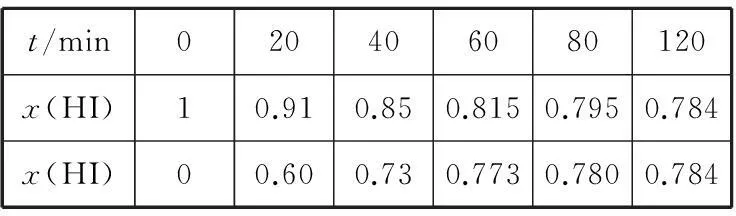
t/min020406080120x(HI)10.910.850.8150.7950.784x(HI)00.600.730.7730.7800.784
①根据上述实验结果,该反应的平衡常数K的计算式为____。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为____(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=____ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图1表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为____(填字母)。
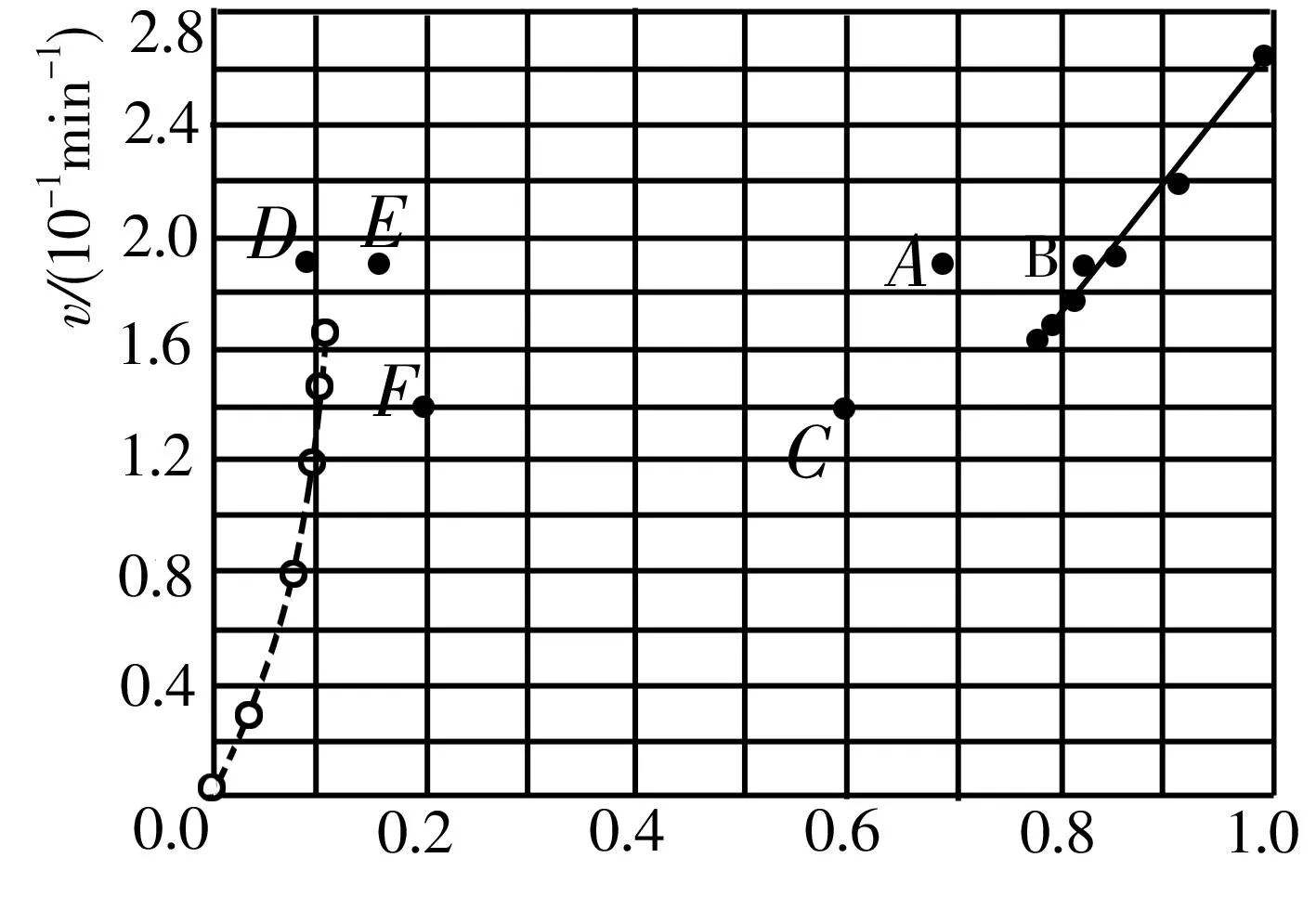
图1
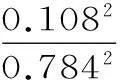
试题分析:本题考查化学反应原理,属于知识的迁移及能力的综合应用方面的考查。(1)反应中碘元素被氧化,则Mn元素被还原,酸性环境中Mn的还原产物应为Mn2+(MnSO4)。
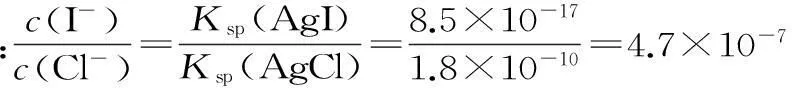
(3)设1 mol HI(g)分子中的化学键断裂时需吸收的能量为akJ,则ΔH=(2a-436-151)kJ·mol-1=11 kJ·mol-1,解得a=299。
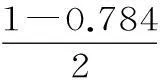
题型二:以工艺流程、实验形式等考查电解质溶液
工艺流程题是近几年出现的一种题型,以制备某种物质为主线,考查电解质溶液的酸碱性、离子反应方程式、实验的基本操作、酸碱中和滴定的计算等。
例2(2014江苏,16)(12分)烟气脱硫能有效减少二氧化硫的排放,如图2。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液,并用于烟气脱硫研究。

图2
(1)酸浸时反应的化学方程式为____,滤渣Ⅰ的主要成分为____(填化学式)。
(2)加CaCO3调节溶液的pH值至3.6,其目的是中和溶液中的酸,并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x。滤渣Ⅱ的主要成分为____(填化学式);若溶液的pH值偏高,将会导致溶液中铝元素的含量降低,其原因是____(用离子方程式表示)。
(3)上述流程中经完全热分解放出的SO2量总是小于吸收的SO2量,其主要原因是____;与吸收SO2前的溶液相比,热分解后循环利用的溶液的pH值将____(填“增大”“减小”或“不变”)。
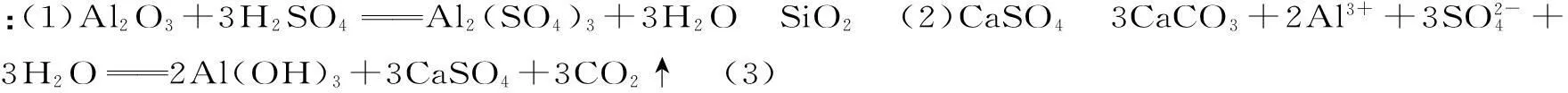
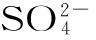
从历年的高考化学卷得出,化学反应原理将继续统领整个化学试题。高考化学试卷中以化学反应能量变化的理解为主题,涉及反应中能量变化的实质、反应热的概念及其与反应速率的关系、盖斯定律的应用、焓变的影响因素,还会考查酸碱中和滴定、沉淀溶解平衡的有关概念和原理,以及化学反应速率、化学反应平衡、弱电解质电离、原电池原理、原电池和金属的腐蚀与防护等核心知识。因此把握好化学反应原理的复习是高考备考的一个中心环节。
作者单位:陕西省韩城市西庄中学
