高中化学等效平衡的解题方法与技巧分析
2016-04-27
高中化学等效平衡的解题方法与技巧分析
■刘志斌
一、恒温恒容条件的应用
第一,如果在化学反应的前后,气体分子数发生了改变,要想实现等效,就要等同,也就是“一边倒”后,所对应的摩尔数相同。
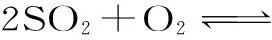
(1)如果x=0,y=0,那么z值为多少?
(2)如果x=0.5,那么,y与z值分别是多少?
(3)题目中,x、y、z三者之间所必须满足的一般条件应为什么?
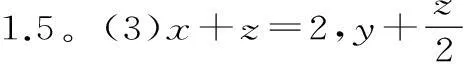
第二,如果化学反应前后的气体体积不发生改变,是可逆反应,那么在“一边倒”后,相同的起始物质摩尔数的比值相同,就是可等效。
分析:该题型中,所参与反应的都是气体,而且,反应前后,气体的体积不发生改变,这种反应需要实现新的平衡以后要等效,所以,只要“一边倒”以后,其对应的物质等比即可。如果对应物质摩尔数比例同原有平衡相同,加入1molZ物质能够完全反应,那么就可以生成0.5mol的X物质与0.5mol的Y物质,如果投入量是第一种投入方法的一半,那么压强也会相应的降低一半。然而,由于该反应物前系数同生成物前系数的和是相等的,所以,需要加压或者是减压,并且平衡不移动,这就是平衡等效。所以,在两种情况之下,Z物质体积分数都是一样的,仅仅是在第二种情况下,Z物质浓度为上一平衡状态一半。所以,a与b的关系是相等的。
二、恒温恒压条件的应用
在恒温恒压的情况下,不管可逆反应在反应前后的体积是否改变,都是等比即等效,也就是在“一边倒”以后,所对应的各种物质摩尔数比值应与原有平衡相同,也就是实现等效。由此可以看出,在恒温恒压的条件下,反应前后的体积是否改变,该反应都是等比即等效。在定温定压的条件下,化学反应方程式为:
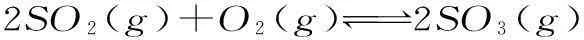
2SO2(g)+O2(g)2SO3(g)
途径一起始2mol1mol0
途径二起始4mol2mol0
如果反应方程式是:
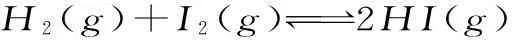
H2(g)+I2(g)2HI(g)
途径一2mol1mol0
途径二4mol2mol0
其中,上述两个题型的途径二就相当于将两个途径一合并在一起,所以就是等效。
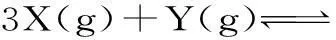
分析:该题目的条件是恒温恒容,而且要求Z体积分数始终是w,也就是等效要求。但是,方程式当中的Z前的系数不知晓,因此,有两种可能情况。如果a的值是4,那么反应前后的气体分子数不变,这种可逆反应要等效,只要在“一边倒”以后,所对应的物质摩尔数比同原有平衡相同就可以。因此,答案可以是4。那么,如果a值不是4,那么,反应前后的气体分子数会发生变化,这种可逆反应就是等效就等同,也就是在“一边倒”以后,所对应物质摩尔数同原有初始状态的对应相同就可以,那么,此时a的值就是1。
作者单位:江西省湖口中学
