“Al及其化合物”复习策略
2016-04-27许峰
“Al及其化合物”复习策略
■许峰
“Al及其化合物”涉及如下方面的复习目标:(1)理解并能应用常见金属的活动性顺序。(2)了解Al及其重要化合物的主要性质和重要应用。(3)了解金属材料在生产和生活中的重要应用。(4)认识化学在金属矿物等自然资源综合利用和实现物质间转化等方面的实际应用。下面结合具体的例子就这部分内容的复习进行简单的分析。
一、铝的性质及用途
1.Al的化学性质图式化复习
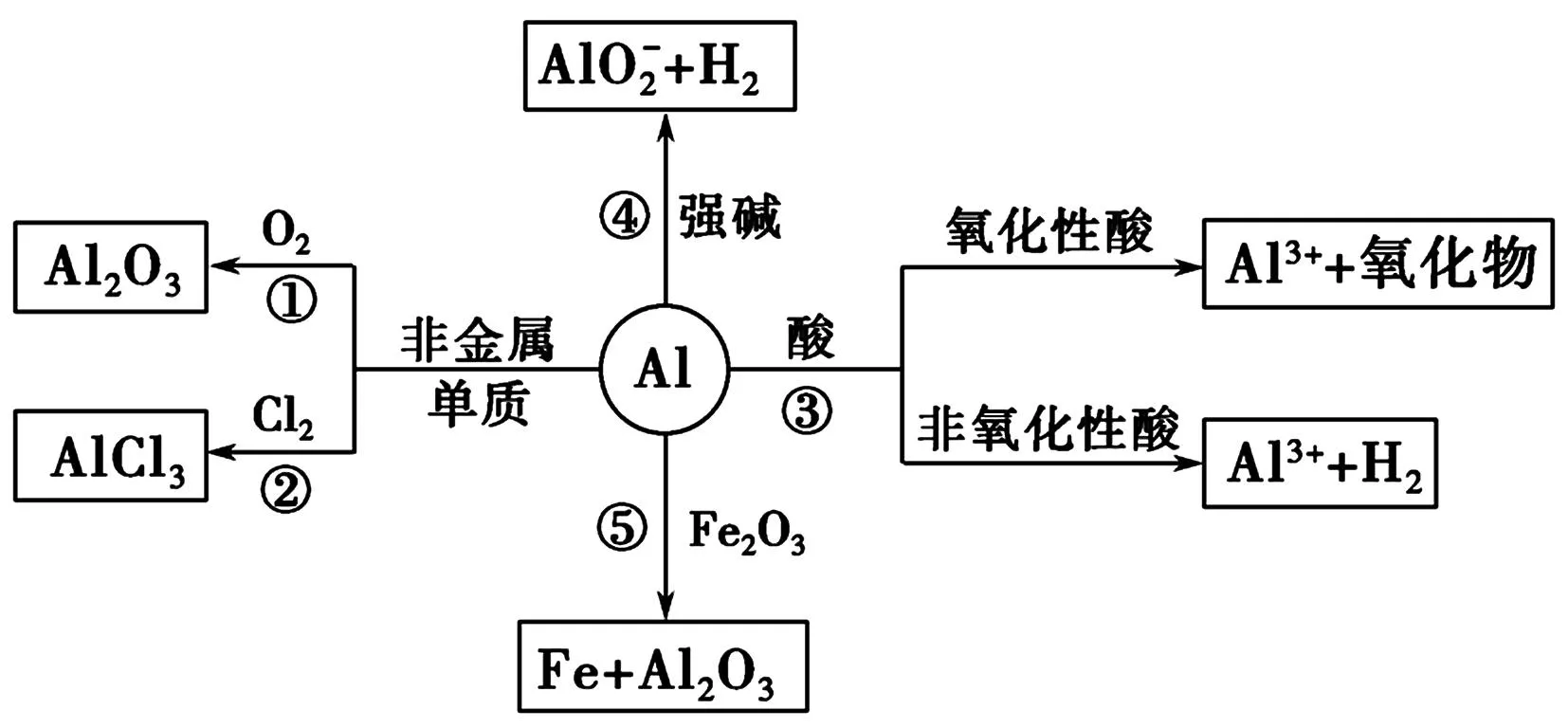
图1
2.例题分析
例1铝是中学化学学习阶段的唯一一种既能与酸(非氧化性酸)反应又能与强碱溶液反应放出H2的金属,就铝的这一特殊性质回答下列问题:
(1)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得H2的体积之比是____。
(2)将足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,产生H2的体积之比是____。
(3)将足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,两者产生的H2相等,则HCl和NaOH的物质的量浓度之比是____。
二、铝的重要化合物的主要性质及应用
1.STS简单问题思考
例2化学在工农业生产和日常生活中有着重要的应用。下列说法不正确的是()。
A.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化
B.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
C.用Al(OH)3治疗胃酸过多
D.电解AlCl3饱和溶液,可制得金属铝
解析:由于H+的放电能力大于Al3+,故电解饱和AlCl3溶液,得到的是Al(OH)3、H2和Cl2,无法得到金属铝。
2.易错题展示
例3向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为()。
A.3 mLB.7.5 mL
C.15 mLD.27.5 mL
作者单位:江苏省昆山中学
