新型全反式维甲酸衍生物 4-氨基-2-三氟甲基苯基维甲酸酯对肝癌细胞株 HepG2增殖的影响
2016-04-27刘慧,周青,汪渊
刘 慧,周 青,汪 渊
新型全反式维甲酸衍生物 4-氨基-2-三氟甲基苯基维甲酸酯对肝癌细胞株 HepG2增殖的影响
刘 慧,周 青,汪 渊
目的研究 4-氨基-2-三氟甲基苯基维甲酸酯 (ATPR)对人肝癌细胞株 HepG2增殖的影响,并初步探讨其可能的作用机制。方法选取 HepG2细胞为研究对象,全反式维甲酸(ATRA)和 ATPR分别作用细胞,应用 MTT比色法测定细胞增殖,流式细胞术检测细胞周期分布情况,Western blot法检测 HepG2细胞内周期蛋白 D(cyclinD)及细胞周期蛋白依赖性激酶 4(CDK4)和 CDK6蛋白表达量。结果ATPR能够显著抑制 HepG2细胞的增殖,将细胞阻滞在 G0/G1期,呈浓度与时间依赖性(P<0.05),并且同浓度、同一处理时间下,ATPR的抑 制率更高(P<0.05);此外,Western blot结果显示,ATPR较 ATRA更能显著下调 HepG2细胞中cyclinD和 CDK6蛋白表达水平(P<0.05),而 CDK4蛋白水平在各组变化均不明显。结论同等浓度下,ATPR抑制HepG2细胞增殖的效果明显强于 ATRA,其机制可能是 ATPR通过下调 cyclinD和 CDK6蛋白的表达水平,造成 G0/G1期阻滞,最终导致肝癌细胞株 HepG2的增殖抑制。
肝癌;HepG2细胞;全反式维甲酸;4-氨基-2-三氟甲基苯基维甲酸酯;细胞周期;细胞增殖
全 反 式 维 甲 酸 (all-trans retinoic acid,ATRA)(图1)是维生素 A的主要活性代谢物,为维甲酸类药物的代表,可诱导分化多种肿瘤细胞,已被广泛用于治疗急性早幼粒细胞性白血病[1]。Sait et al[2]发现 ATRA能上调肿瘤细胞中的血管内皮细胞生长因子(vascular endothelial growth factor,VEGF),促进肿瘤血管的生成而引起恶性增殖。此外,ATRA还可产生较强的维甲酸综合征,长期使用会产生维甲酸抵抗,限制了其在肿瘤治疗中的作用[3]。因此,开发低毒高效的新型维甲酸衍生物是必需的。4-氨基-2-三氟甲基苯基维甲酸酯 (4-amino-2-trifluoromethyl-phenyl retinate,ATPR)(图2)是由本校合成的新型维甲酸衍生物,研究[4-6]表明在抑制细胞迁移与诱导分化和凋亡方面,ATPR效果明显优于 ATRA。然而关于 ATPR对肝癌细胞株 HepG2增殖的研究较少,相关的机制尚不清楚。该研究以肝癌细胞株 HepG2为模型,通过比较 ATRA与 ATPR对其增殖能力的影响,为新型维甲酸衍生物用于肝癌临床治疗提供科学依据。
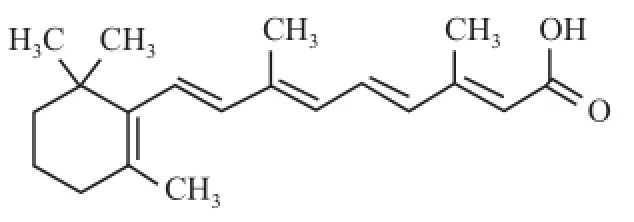
图1 ATRA结构式

图2 ATPR结构式
1 材料与方法
1.1 材料人肝癌细胞株 HepG2购自美国 ATCC公司;ATPR由安徽医科大学药学院提供;ATRA、二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT)购自美国 Sigma公司;低 糖 DMEM 培养基购自美国 Gibco公司,4℃储存备用;新生牛血清购自杭州四季青生物工程材料有限公司,-20℃保存,用前 4℃融化,无需灭活;Coulter DNA检测试剂盒购自美国 Beckman Coulter公 司;鼠 抗 人 β-actin购 自 美 国 Santa Cruz公司;鼠抗人 cyclinD、CDK6以及兔抗人 CDK4抗体购自上海联世生物科技有限公司;辣根过氧化酶(horseradish peroxidase,HRP)标记的羊抗鼠 IgG、羊抗兔 IgG、ECL显色试剂盒以及 BCA定量试剂盒均购自美国 Pierce公司。ATRA、ATPR用 DMSO溶解配制成 20 mmol/L,-20℃避光保存,使用时用完全培养基稀释至使用浓度。
1.2 方法
1.2.1细胞株以及细胞培养 人肝癌细胞株HepG2用含 10%新生牛血清的低糖 DMEM培养基,并加入青霉素 100 U/ml和链霉素 100μg/m l,在 37℃、5%CO2饱和湿度的细胞培养箱中培养。每 2~3 d换一次液,当细胞密度达 80% ~90%,用 0.25%胰酶(含 0.53 mmol/L EDTA)传代,取对数生长期的细胞进行实验。
1.2.2细胞增殖实验(MTT法) 收集对数生长期细胞,以 2.5×107/L的密度接种于 96孔板,每孔200μl,边缘孔用 200μl PBS填充。待细胞贴壁后弃去培养液,用 PBS轻洗 3遍,然后分别加入含有不同浓度(5、12.5、20、25、50、75、100μmol/L)的ATRA和 ATPR的培养液孵育 48 h,以及同一浓度(25μmol/L)ATRA和 ATPR处理不同的时间(24、48、72、96 h),并设置细胞对照组、溶剂对照组(DMSO),其中溶剂对照组是与最大浓度 100μmol/L药物中所含有的 DMSO等体积,其他药物组均将 DMSO体积补齐至最大体积,以消除各组溶剂体积不同所造成的干扰。指定作用时间后,每孔加入 20μl MTT,于细胞培养箱中孵育 4~6 h。小心弃去上清液,每孔加入 100μl DMSO,37℃振动 15 min以溶解结晶,酶 标 仪 检 测 570 nm 波 长 吸 光 度 (optical density,OD)。每个浓度设置 6个复孔,做 3次实验,取平均值。抑制率(%)=(对照组 OD570-试验组 OD570)/对照组 OD570×100%。用 SPSS 16.0计算药 物 的 半 数抑制浓度 (half inhibitory concentration,IC50)。
1.2.3流式细胞术检测细胞周期 收集处于对数生长期的 HepG2细胞,接种于 6孔板,待细胞贴壁后换成无血清培养基饥饿24 h,使细胞周期同步化,然后用含 25μmol/L的 ATRA和 ATPR的完全培养液处理细胞,48 h后常规消化收集各组细胞,预冷PBS洗3次后,用100μl PBS重悬并调整细胞密度为 1×106/ml。按 Coulter DNA检测试剂盒操作,每组加入50μl固定破膜剂,反应30 s后立即加入500 μl PI染液,室温避光反应 30 min后用流式细胞仪检测,每个标本检测 105个细胞,重复计数 3次,由ModFIT软件分析 G0/G1、S、G2/M期细胞比例。
1.2.4Western blot检测蛋白表达 5、25μmol/L的 ATRA和 ATPR分别处理 HepG2细胞 48 h后,取出细胞,用预冷的 PBS洗涤 3遍,在滤纸上控干PBS,并吸去残余 PBS。然后每组加入 200μl蛋白提取缓冲液(Tris-HCl,pH 7.14,150 mmol/L NaCl,1 mmol/L EDTA,1%Triton X-100,0.1%SDS,5 mg/ml Leupeptin,1 mmol/L PMSF),冰 上 放 置 20 min后,置冰上用细胞刮刮取细胞,移入 1.5 ml EP管,并反复冻融 3次(-80℃、4℃)。之后,在超速冷冻离心机中 4℃、14 000 r/min离心 30 min,吸取上清液,使用 BCA试剂盒定量,用生理盐水调整至相同浓度后,加入等体积的 4×蛋白上样缓冲液,煮沸 8~10 min,-80℃保存待用。等量的各组样品用于 SDS-PAGE电泳,然后将蛋白转移到 PVDF膜上。转膜成功后,室温下用含 5%的脱脂奶粉封闭2 h或者4℃封闭过夜,接着将膜放入用一抗稀释液配制的一抗中,4℃孵育过夜。经 TBST(含 0.05% Tween-20)洗涤 3遍后加入相应浓度 HRP标记的二抗室温孵育 2 h,用 TBST洗涤 3遍后,TBS洗涤 1遍,每遍 10 min。在暗室中将等比例混合后的 ECL试剂 A液和 B液均匀涂于膜上,X线片曝光,显影,定影。底片扫描后使用 Quantity One软件分析条带的灰度值。
1.3 统计学处理采用 SPSS 16.0软件进行分析,实验数据均以 ¯x±s表示;组间数据比较采用单因素方差分析,两两比较采用 LSD-t检验。
2 结果
2.1 ATRA和ATPR对HepG2细胞增殖的影响
MTT结果显示,当细胞经不同浓度的 ATRA和ATPR处理 48 h后,与细胞对照组相比,低浓度的ATRA组(5、12.5、20、25μmol/L)对细胞无抑制作用,当作用浓度升至 50μmol/L,开始以剂量依赖方式抑制 HepG2细胞株的增殖(FATRA=53.919,P<0.05),而 ATPR组从低浓度到高浓度均能抑制细胞的生长,并呈浓度依赖关系(FATPR=8 269.029,P<0.05),见图3。通过 SPSS 16.0计算出 ATRA和ATPR的 IC50分别为 102.190、31.723μmol/L。随后选取 25μmol/L药物浓度分别作用于 HepG2细胞24、48、72、96 h,随着药物处理时间的延长,抑制率逐渐升高。相比之下,同一处理时间下 ATPR较ATRA的抑制率更高(F24h=44.499,F48h=271.387,F72h=1 479.019,F96h=2 130.531,P<0.05),见图4。以上结果均提示,与同一浓度的 ATRA相比,ATPR对 HepG2细胞增殖抑制作用更强。
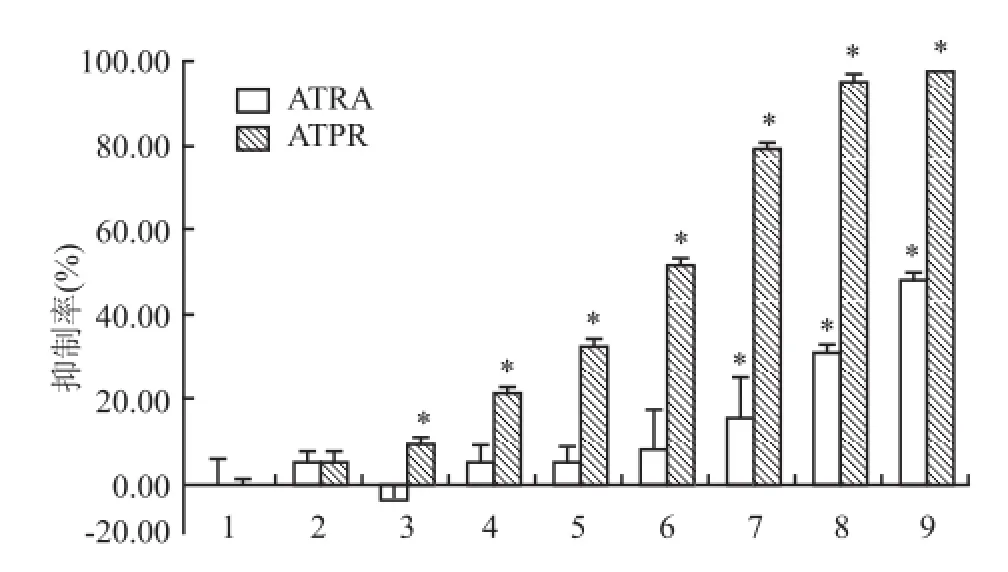
图3 不同浓度的 ATRA及 ATPR对 HepG2细胞增殖的作用1:细胞对照组;2:溶剂对照组;3:5μmol/L;4:12.5μmol/L;5:20μmol/L;6:25μmol/L;7:50μmol/L;8:75μmol/L;9:100μmol/L;与细胞对照组比较:*P<0.05

图4 ATRA和 ATPR对 HepG2细胞增殖的作用1:细 胞对 照组;2:溶 剂 对 照 组;3:ATRA 25μmol/L;4:ATPR 25 μmol/L;与细胞对照组比较:*P<0.05;与同一时间的 ATRA组比较:#P<0.05
2.2 ATRA以及ATPR对HepG2细胞周期的影响25μmol/L ATRA和 ATPR处理 HepG2细胞 48 h后,流式细胞术检测细胞周期显示,与溶剂对照组相比,25μmol/L的 ATPR能够显著抑制 HepG2细胞增殖(P<0.05),使 G0/G1期细胞的比例明显增加,而 同 浓 度 的 ATRA 组 无 明 显 作 用 (FG0/G1= 123.523,FS=74.587,FG2=63.385),见图5。以上结果提示 ATPR能将 HepG2细胞周期阻滞在 G0/G1期,从而抑制细胞增殖。
2.3 ATRA及ATPR对HepG2细胞中cyclinD、CDK 4和CDK 6蛋白水平的影响5、25μmol/L ATRA和 ATPR作用细胞 48 h后,与细胞对照组相比,ATPR能明显下调 cyclinD与 CDK6的水平(P<0.05),而 ATRA 组 变 化 不 显 著 (FcyclinD=65.190、FCDK6=65.651)。同时,CDK4蛋白的表达水平在各组中均变化不明显(FCDK4=5.298),见图6。
3 讨论
肝癌是我国最常见的恶性肿瘤之一,经治疗的早期肝癌,5年生存率仅为 50%,占恶性肿瘤死亡率的第二位[7-8]。除手术切除外,药物化疗是治疗肝癌的重要手段,但由于疗效缺乏特异性,并且长期用药会产生 耐 性,从 而 影响了药物 治 疗 效 果[9]。因此,寻找高效、安全的新型抗癌药是必要的。本实验室采用的 ATPR是在 ATRA的结构基础上进行羧基改造而成。研究[4-5,10]证实,ATPR可以有效抑制肺癌细胞株 A549、胃癌细胞株 BGC-823以及乳腺癌细胞株 MDA-MB-231的迁移。
细胞增殖是通过细胞分裂方式增加细胞数量的复杂过程,是细胞生命活动的重要特征之一。然而,当正常细胞在多种因素的影响下,细胞周期调节失控,获得自主生长信号,导致细胞无限增殖,就会产生肿瘤[11],肝癌的发生发展也是肝癌细胞无限增殖的结果。因此,该文主要从细胞增殖方面,研究 ATRA与新型维甲酸衍生物 ATPR对肝癌 HepG2细胞株的作用。MTT实验显示,ATPR从低浓度到高浓度(5~100μmol/L)均能够抑制 HepG2细胞的增殖,有浓度依赖性和时间依赖性,抑制率远远高于同等浓度下的 ATRA,即在相同浓度与作用时间下,ATPR抑制 HepG2细胞增殖的能力比 ATRA更强。
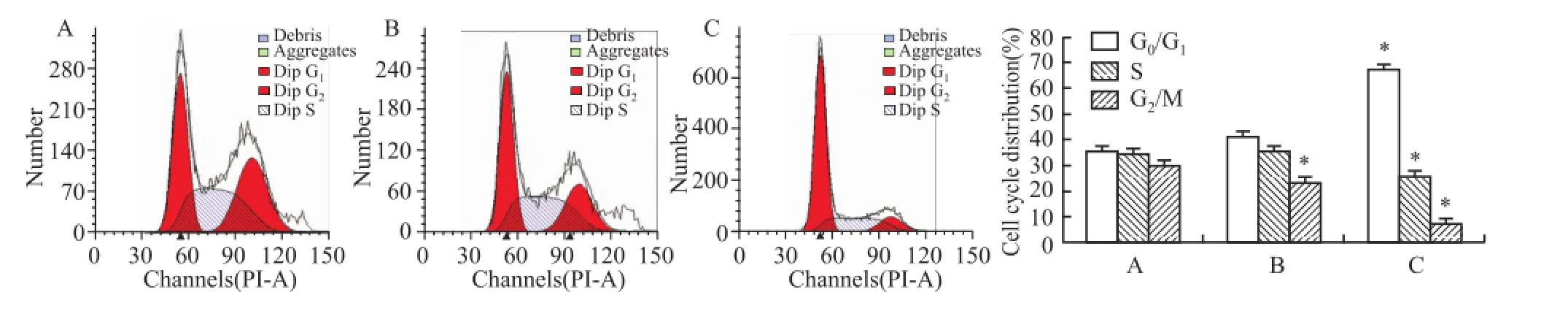
图5 ATRA与 ATPR对肝癌 HepG2细胞周期的影响A:溶剂 对照组 ;B:ATRA 25μmol/L;C:ATPR 25μmol/L;与溶 剂对 照组 比较:*P<0.05

图6 ATRA和 ATPR对 HepG2细胞 内 cyclinD、CDK 4和 CDK 6蛋白表达的影响1:细胞对照 组 ;2:溶 剂 对 照 组 ;3:ATRA 5μmol/L;4:ATRA 25 μmol/L;5:ATPR 5μmol/L;6:ATPR 25μmol/L;A:ATRA和 ATPR对HepG2细胞内 cyclinD蛋白的影响;B:ATRA和 ATPR对 HepG2细胞内 CDK4和 CDK6蛋白表达的影响;与细胞对照组比较:*P<0.05;与相同浓度的 ATRA组比较:#P<0.05
细胞周期检测点是细胞增殖调控的关键位点,包括细胞周期蛋白 cyclin和细胞周期蛋白依赖性激酶 CDK的调控系统[11]。流式细胞术检测细胞周期发现,ATPR可以显著导致 HepG2细胞阻滞在 G0/G1期,抑制细胞增殖,这与MTT结果是一致的。CyclinD蛋白在细胞增殖过程中发挥重要作用,是调节 G1期细胞增殖信号的关键蛋白,其可与 CDK4或CDK6形成激酶复合物,使关键底物 PRb磷酸化,加快释放转录因子 E2F,从而加速 G1/S期转换[11-12]。细胞周期的失控会导致细胞恶性增殖,从而导致癌症[11,13],因此,开发抗癌药物来抑制细胞周期的进程显得尤为重要。有研究[14]表明,在食管癌细胞株EC-9706和乳腺癌细胞株 MDA-MB-231中,通过抑制 cyclinD和 CDK4的水平,能够诱导细胞 G0/G1期阻滞,从而抑制细胞增殖。因此,本研究检测了 cyclinD、CDK4和 CDK6蛋白,结果显示,经 ATPR处理48 h后的 HepG2细胞 cyclinD和 CDK6表达降低,而 CDK4蛋白水平恒定。因此,ATPR可能通过下调 cylinD和 CDK6蛋白水平来减少 cyclinD和 CDK6复合物的形成,抑制细胞周期 G1向 S期转变,致使细胞阻滞在 G0/G1期,最终实现对 HepG2细胞的增殖抑制作用。
本实验研究中,ATRA较其衍生物 ATPR对 cyclinD及 CDK6的抑制能力较弱,这可能与二者调节肝癌 HepG2细胞增殖方面存在不同的作用机制有关。研究[15]显示 ATRA及其衍生物通过其核受体发挥抗癌作用,目前已发现两种维甲酸受体家族:RARs和 RXRs家族,分别都有 α、β、γ3个亚型。ATRA与其衍生物通过与细胞内相应维甲酸受体结合后,特异性结合到靶基因调控区的维甲酸应答元件(RARE)上,选择性地激活或抑制基因转录,调节细胞的增殖、分化和凋亡[15]。研究[5]证明 在胃癌BGC-823细胞中,ATPR较 ATRA能显著下调 RARα和 RARβ受体,导致 ATPR抑制 BGC-823细胞迁移的能 力 更 强。因 此,ATRA 与 ATPR 调 节 肝 癌HepG2细胞增殖机制的不同可能与其进入 HepG2细胞内结合不同的维甲酸受体有关,二者对受体调节的研究也正在本实验室进行。
综上所述,在同等浓度下,新型维甲酸衍生物ATPR较 ATRA更能显著抑制肝癌细胞株 HepG2的增殖。其机制可能是通过下调 cyclinD和 CDK6的表达水平阻滞 HepG2细胞周期进展,从而抑制细胞增殖,为肝癌的药物治疗提供了新的实验依据。然而,细胞增殖是一个极其复杂且受严格调控的过程,ATPR如何下调 cyclinD和 CDK6的机制以及相关通路仍不清楚,有待后续研究进一步探讨。
[1]Siddikuzzaman,Guruvayoorappan C,Berlin Grace V M.All trans retinoic acid and cancer[J].Immunopharmacol Immunotoxicol,2011,33(2):241-9.
[2]Saito A,Sugawara A,Uruno A,et al.All-trans retinoic acid induces in vitro angiogenesis via retinoic acid receptor:possible involvement of paracrine effects ofendogenous vascular endothelialgrowth factor signaling[J].Endocrinology,2007,148(3):1412-23.
[3]Su Y C,Dunn P,Shih L Y,et al.Retinoic acid syndrome in patients following the treatmentof acute promyelocytic leukemiawith all-trans retinoic acid[J].Chang Gung Med J,2009,32(5):535-42.
[4]Fan T T,Cheng Y,Wang Y F,et al.A novel all-trans retinoid acid derivative N-(3-trifluoromethyl-phenyl)-retinamide inhibits lung adenocarcinoma A549 cell migration through down-regulating expression ofmyosin light chain kinase[J].Asian Pac J Cancer Prev,2014,15(18):7687-92.
[5]Hu A,Yang Y,Zhang S,et al.4-Amino-2-trifluoromethyl-phenyl retinate inhibits themigration of BGC-823 human gastric cancer cells by downregulating the phosphorylation level of MLC II[J].Oncol Rep,2014,32(4):1473-80.
[6]周佳丽,颜蕴文,江巧玲,等.全反式维甲酸及其衍生物对乳腺癌细胞株 MDA-MB-231凋亡的影响[J].安徽医科大学学报,2015,50(2):154-8.
[7]Koudah S,EIMouhadi S,ArrivéL.Fibrolamellar hepatocellular carcinoma[J].Clin Res Hepatol Gastroenterol,2012,36(1):5-6.
[8]Jemal A,Bray F,Center M M,et al.Global cancer statistics[J]. CA Cancer JClin,2011,61(2):69-90.
[9]Abrams P,Marsh JW.Current approach to hepatocellular carcinoma[J].Surg Clin North Am,2010,90(4):803-16.
[10]王 北,颜韵文,周 青,等.4-氨基-2-三氟甲基维甲酸酯对乳腺癌细胞株 MDA-MB-231迁移的影响及其可能机制[J].安徽医科大学学报,2013,48(2):115-9.
[11]周春燕,冯作化.医学分子生物学[M].北京:人民卫生出版社,2014:152-4.
[12]Okayama H.Cell cycle control by anchorage signaling[J].Cell Signal,2012,24(8):1599-609.
[13]Lange C A,Yee D.Killing the second messenger:targeting loss of cell cycle control in endocrine-resistant breast cancer[J].Endocr Relat Cancer,2011,18(4):C19-24.
[14]Wang H,Chen X,Chen Y,et al.Antitumor activity ofnovel chimeric peptides derived from cyclinD/CDK4 and the protein transduction domain 4[J].Amino Acids,2013,44(2):499-510.
[15]Soprano D R,Qin P,Soprano K J.Retinoic acid receptors and cancers[J].Annu Rev Nutr,2004,24:201-21.
Effects of a novel all-trans retinoid acid derivative 4-am ino-2-trifluoromethyl-phenyl retinate on the proliferation of HepG2 cells
Liu Hui,Zhou Qing,Wang Yuan
(Dept of Biochemistry and Laboratory of Molecular Biology,AnhuiMedical University;Dept of Key Laboratory,Gene Resource Utilization for Severe Disease of Anhui Province,Hefei 230032)
Objective To explore the effects of4-amino-2-trifluoromethyl-phenyl retinate(ATPR)on the proliferation of human hepatocellular carcinoma(HCC)HepG2 cells and preliminarily clarify the probable mechanisms. Methods HepG2 cells were used as the research model and treated with all-trans retinoic acid(ATRA)and ATPR respectively.The viability of HepG2 cells was investigated by MTT assay.Flow cytometry was used to detect cell cycle distribution.The expression of cyclinD,cyclin-dependent kinase 4(CDK4) and CDK6 proteins in HepG2 cellswere detected by Western blot.Results ATPR significantly inhibited the proliferation of HepG2 cells in a dose-and time-dependentmanner compared with cell group and arrested cells on G0/G1phase(P<0.05). The inhibition rate of ATPR wasmuch higher than that of ATRA at the same dose for the indicated time(P<0.05).In addition,Western blot results showed that ATPR down regulated the expression of cyclinD and CDK6 more dramatically than ATRA(P<0.05),while CDK4 expression was constant in all groups.Conclusion ATPR exhibits a better inhibitory effect on HepG2 cells proliferation than ATRA.The mechanism may be partly through down regulating the expression of cyclinD and CDK6 to cause G0/G1arrest,which finally leads to growth inhibition.
hepatocellular carcinoma;HepG2 cells;all-trans retinoic acid;4-amino-2-trifluoromethyl-phenyl retinate;cell cycle;cell proliferation
R 735.7;R 966;R 34
A
1000-1492(2016)02-0156-05
时间:2016-1-20 10:32:26
http://www.cnki.net/kcms/detail/34.1065.R.20160120.1032.004.htm l
2015-11-17接收
国家自然科学基金(编号:81272399);安徽省自然科学基金(编号:090413116)
安徽医科大学分子生物学实验室、生物化学与分子生物学
教研室、安徽省 /省部共建教育部重要遗传病基因资源利用重点实验室,合肥 230032
刘 慧,女,硕士研究生;
汪 渊,男,教授,博士生导师,责任作者,E-mail:aydesm-1@163.com
